High ozone concentrations in the Mediterranean Italy: a threat to forests?
Forest@ - Journal of Silviculture and Forest Ecology, Volume 2, Pages 130-140 (2005)
doi: https://doi.org/10.3832/efor0269-0020130
Published: Mar 10, 2005 - Copyright © 2005 SISEF
Research Articles
Guest Editors: Matera Meeting (2004)
« Climate change and pollution: effects on the southern Italian forests »
Collection/Special Issue: Elena Paoletti
Abstract
Tropospheric ozone pollution has changed from local phenomenon to global issue, because of a continuous rising - especially in developing countries - and intercontinental transport. Ozone ground levels, however, are higher in the world regions with strong photochemical activity, like the Mediterranean basin. The aim of this work is to review available data on ozone ground levels and damages to forests in Italy, with focus on the areas exposed to the highest concentrations, i.e. Southern Italy. Data from both ozone monitors and passive samplers suggest that ozone levels increase North to South in Italy. Therefore, an increase in ozone damages to forests is likely across this gradient. Conversely, the reports (presence/absence) of visible ozone-like foliar injury do not show a clear geographic trend, although they are still limited in number. Preliminary investigations suggest that ozone tolerance in evergreen sclerophylls and Southern provenances is higher than in mesophilic species and Northern provenances. The higher tolerance is due both to avoidance, i.e. stomatal closure, and to an active antioxidant pool. This would suggest AOT40 is modified on the basis of both stomatal conductance and antioxidant capacity. Available data are still not enough to determine the effect of present ozone regimes on Italian Mediterranean forests. Future investigations should aim at: (1) filling the gap on ozone levels in Italian remote areas, by using passive samplers and/or biomonitoring; (2) establishing ozone responses in the most typical Italian vegetation, for both O3 uptake and detoxification, in realistic conditions and in interactions with other factors, mainly drought and the increase in atmospheric CO2 concentrations; (3) extensive monitoring and quantification of ozone-like foliar injury across Italy. Confirmation of higher ozone tolerance in the Mediterranean vegetation might imply differing ozone critical levels across Europe.
Keywords
AOT40, Foreste mediterranee, Livelli critici per l’ozono, Ozono troposferico, Sclerofille
L’ozono troposferico
L’ozono (O3) presente negli strati più bassi dell’atmosfera, la troposfera, è un così detto inquinante secondario perché non viene emesso direttamente dalle fonti, ma si forma a partire da precursori. La chimica troposferica dell’O3 è molto complessa e ancora non del tutto chiarita. In sintesi, l’O3 si forma naturalmente in presenza di luce a partire dall’ossigeno, ma naturalmente e rapidamente degrada di nuovo ad ossigeno. Ecco dunque che l’O3 manifesta delle dinamiche classiche di formazione: è più elevato nelle ore centrali del giorno e nei mesi più caldi perché sono questi i periodi in cui si ha maggiore radiazione luminosa. Quando nell’atmosfera si trovano anche altri composti, in particolare ossidi di azoto (NOx) e composti organici volatili (COV), l’equilibrio si sposta verso la formazione dell’O3.
L’inquinamento da ozono è un fenomeno diffuso soprattutto nei paesi industrializzati, ma in espansione anche in quelli in via di sviluppo ([62]), per cui la percentuale di foreste mondiali esposte a concentrazioni potenzialmente dannose è andata continuamente crescendo negli ultimi 50 anni e si prevede raggiungerà il 50% durante il 2100 ([22]). Inoltre, recentemente è stato dimostrato il trasporto intercontinentale dell’O3 dal Nord-America e l’Asia verso l’Europa ([63]). Ciò significa che i livelli di ozono in Europa non dipendono solo dalla nostra politica di emissioni, ma anche da quella di altri continenti ([15]), per cui l’inquinamento da O3 è passato dalla scala locale a quella globale. In base agli scenari di emissione dei suoi precursori, NOx e COV, si prevede che la concentrazione media globale di O3 aumenterà dello 0.5-2% ogni anno ([62]). E questo nonostante siano stati fatti notevoli progressi nel controllo dei suoi precursori, grazie a limitazioni normative e soprattutto grazie al progresso tecnologico che ha portato, ad es., all’introduzione delle marmitte catalitiche. Basti pensare che negli anni ’70 nell’aria di Los Angeles si registravano picchi di 580 ppb (parti per miliardo), picchi che sono gradualmente diminuiti nonostante l’aumento della popolazione e del traffico veicolare ([3]). A scala mondiale, si assiste ad una riduzione generalizzata dei picchi di concentrazione e ad un aumento dei livelli medi ([18], [44]). In Europa, l’esposizione della popolazione urbana all’O3 è aumentata costantemente nello scorso decennio ([17]), per cui è stata varata una norma più restrittiva, la Direttiva 2002/3/CE, che fissa il valore da raggiungere per evitare effetti dannosi alla salute umana a 120 μg m-3 (per l’O3, 1 ppb = 1.96 µg m-3 a 20°C e 101.325 kPa), come media delle otto ore giornaliere, da non superare per più di 25 giorni per anno (il valore da raggiungere per la protezione della vegetazione è invece di 18000 μg m-3 h). La soglia di allarme è definita come valore medio orario di 240 µg.m-3. L’Italia, dove la Direttiva 2002/3/EC è stata recepita con D. L.gvo n. 183 del 21/05/2004, è l’unico Paese europeo che nel 2004 ha superato questa soglia per quasi tutta la stagione vegetativa, da Maggio a Settembre inclusi ([19]). Non c’è dubbio, infatti, che l’inquinamento da O3 sia un fenomeno più grave nelle regioni con alta attività fotochimica, come appunto il bacino mediterraneo ([42]). In previsione della prossima applicazione della Dir. 2002/3/CE in Italia, prevista a regime per la fine del 2006, è quindi indispensabile aumentare le nostre conoscenze sui livelli di ozono e sui suoi reali effetti sulla vegetazione.
L’obiettivo di questo lavoro è quindi quello di censire i dati disponibili sui livelli di ozono ed i danni da O3 alle foreste in Italia, con particolare riferimento alle aree esposte alle concentrazioni più elevate, cioè le regioni meridionali.
La misura dell’ozono
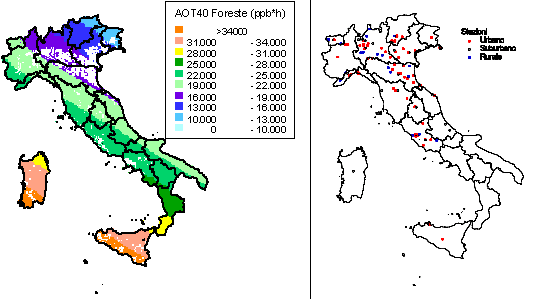
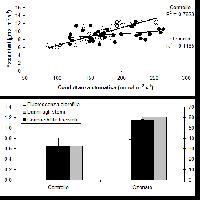
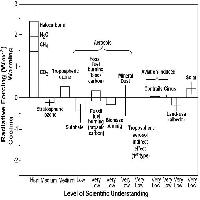
Per misurare le concentrazioni di O3 a livello del suolo generalmente si usano tre tipi di tecniche: analitiche, da passivo, o biologiche. Il nostro obiettivo non è quello di descriverne i dettagli tecnici, ma di delinearne le potenzialità nel monitoraggio a larga scala spaziale. Le centraline automatiche di monitoraggio contengono sofisticate strumentazioni analitiche che misurano non solo l’O3 ma anche altri inquinanti (ossidi di azoto, polveri, ecc.). I monitor per l’O3 generalmente usano l’assorbimento nell’UV, che è selettivo per l’O3 e fornisce informazioni veloci, affidabili e sicure. Tramite i dati in continuo delle centraline, si può calcolare l’indice di esposizione all’O3 oggi più adottato a livello internazionale, la così detta AOT40 ([12]), cioè la sommatoria delle concentrazioni orarie che eccedono le 40 ppb, e sulla cui base è stato definito il livello critico per le foreste, che è oggi di 10000 ppb h come media di 5 anni nelle ore di luce della stagione vegetativa ([33], [23], [56]), recentemente dimezzato (5000 ppb h) ma solo per le specie più sensibili e per le condizioni più favorevoli all’assorbimento di O3 ([34]). La regione Lombardia ha una rete di centraline sufficientemente sviluppata per mappare l’AOT40 sul territorio regionale ([25]), da cui risulta che il livello critico per le foreste è superato costantemente. A livello nazionale, l’elaborazione dei dati di concentrazione di O3 delle centraline di monitoraggio di qualità dell’aria ha portato l’ENEA ha elaborare una mappa dell’AOT40 per le foreste che mostra il superamento del limite per le foreste su tutto il territorio nazionale (Fig. 1a). Per il calcolo dell’AOT40 sono stati utilizzati i dati orari di concentrazione di O3 provenienti dalle centraline rurali e suburbane, dal 1996 al 2000, di tutte le reti di monitoraggio presenti sul territorio nazionale. La mappa, relativa al 1999 cioè all’anno con il maggior numero di dati, è stata ottenuta spazializzando i valori puntuali degli indici di livello critico dell’O3 su tutto il territorio italiano, con opportuni metodi statistici e tenendo conto dell’uso del suolo. La mappa ottenuta va tuttavia interpretata alla luce dei vari limiti della rete nazionale di rilevazione dell’O3, sia per la non omogenea distribuzione delle centraline di monitoraggio sia per la mancanza di centraline in aree rurali. Infatti, la maggior parte delle nostre centraline è collocata in stazioni urbane (Fig. 1b), sia perché sono alimentate a corrente e quindi non possono essere posizionate in mezzo a un bosco, sia perché l’interesse è concentrato sugli effetti degli inquinanti sulla popolazione e questa vive prevalentemente in città. Tuttavia, la predominanza di stazioni di rilevamento cittadine non fornisce informazioni utili a comprendere l’esposizione all’O3 delle nostre foreste. Anche perché in genere le concentrazioni di O3 sono più basse in città che non in aree remote, un fenomeno che a New York è stato considerato il maggior responsabile della migliore crescita delle piante rispetto alle zone rurali limitrofe ([28]). Un simile effetto può sembrare paradossale, ma bisogna considerare che l’O3 è un inquinante secondario (e quindi la sua formazione richiede un certo tempo dopo l’emissione dei precursori) e che l’elevato inquinamento urbano favorisce le reazioni di ritorno che portano alla sua degradazione ([41]). Inoltre le piante (in modo diverso a seconda delle specie) liberano composti organici volatili (soprattutto isoprenoidi) che stimolano la produzione di O3 ([51]). Questi composti proteggono le membrane vegetali contro gli stress ossidativi, incluso l’O3. Tuttavia, per quanto le quantità emesse siano molto basse, queste sostanze entrano nella chimica troposferica dell’O3 e ne favoriscono la produzione. Tanto che ad esempio si suggerisce che la scelta delle specie per l’arredo urbano favorisca quelle che presentano un basso potenziale di ozono formazione ([4]).
Fig. 1 - Mappa dell’AOT40 per le foreste italiane nell’anno 1999 (a sinistra) e stazioni di rilevamento (a destra) (da [54]).
Per conoscere il livello di O3 in ambienti rurali, si può ricorrere ai campionatori passivi o al biomonitoraggio. Per biomonitoraggio si intende l’uso di un organismo per ottenere informazioni sulla qualità dell’ambiente ([47]). La misura fisico-chimica dei livelli di inquinamento è un metodo oggettivo ed accurato, mentre la risposta delle piante agli inquinanti è modificata dagli altri fattori ambientali e dal loro stesso stato fisiologico. Tuttavia, il biomonitoraggio valuta gli effetti integrati di tutti questi fattori e dell’inquinamento, mentre i metodi fisico-chimici non forniscono sufficienti informazioni sul rischio biologico associato all’esposizione. Il biomonitoraggio è in genere meno costoso degli altri metodi ed è quindi idoneo a studi di lungo periodo su grandi aree senza l’uso di attrezzature sofisticate e ad alto costo di acquisto e manutenzione. Inoltre, i dati biologici possono essere raccolti periodicamente invece che in continuo. Il biomonitor oggi più diffuso a livello internazionale è una cultivar di una specie di trifoglio (Trifolium repens cv. Regal) con due suoi cloni: NC resistente e NC sensibile (⇒ http://icpvegetation.ceh.ac.uk/). Purtroppo questo trifoglio non sta dando ottimi risultati da noi perché non si adatta bene al clima mediterraneo e soffre di numerose avversità parassitarie. Il biomonitor più classico è Nicotiana tabacum cv Bel-W3, grazie al quale la provincia di Firenze realizza delle mappe di distribuzione spaziale dell’O3 a partire dall’anno 2000 (⇒ http://www.provincia.fi.it/acp1/ambiente/ozono.htm). Al momento, non sono disponibili inventari nazionali di biomonitoraggio dell’ozono in Italia.
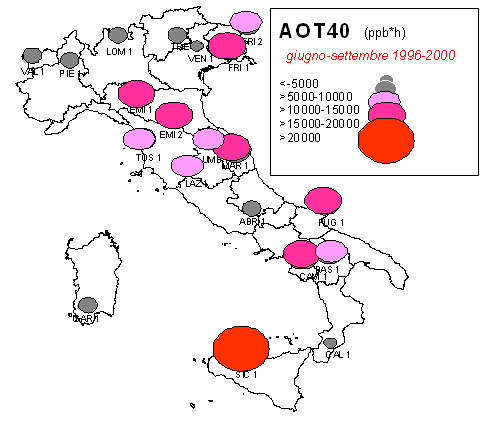
Esistono diversi tipi di campionatori passivi per l’O3. All’interno dei campionatori si trova un composto che reagisce in modo specifico con l’O3. In laboratorio si determina la quantità di composto che ha reagito e, quindi, la concentrazione dell’inquinante nel periodo in cui il campionatore è stato esposto all’aria (in genere 15 giorni). Il campionamento da passivo, quindi, fornisce un dato cumulato (giorno e notte nel periodo di esposizione). Recentemente, sono state sviluppate delle tecniche che permettono con buona approssimazione di derivare l’AOT40 anche dai campionatori passivi ([60]). Un’indagine condotta nell’ambito del Programma Nazionale per il CONtrollo degli ECOsistemi FORestali (CONECOFOR) tramite campionatori passivi ha consentito di calcolare l’AOT40 in 20 delle attuali 31 aree permanenti, nelle quali il Programma gestito dal Corpo Forestale dello Stato rileva numerosi parametri, inclusi gli inquinanti atmosferici ([20]). I dati, calcolati per il periodo 1996-2000, mostrano valori più ridotti sulle Alpi, generalmente superiori al livello critico per le foreste nella penisola, altissimi in Sicilia (45000 ppb h, Fig. 2).
Fig. 2 - Stima degli AOT40 nel periodo 1996-2000 nelle aree permanenti del Programma Nazionale CONECOFOR (ridisegnata, da [20]).
Sia i dati da passivo che quelli analitici finora disponibili per l’Italia, indicano dunque un aumento del livello di inquinamento da O3 al diminuire della latitudine. Ci si aspetterebbe quindi un aggravamento dei danni da ozono alle foreste secondo un gradiente da Nord verso Sud.
Effetti dell’ozono
Gli effetti dell’O3 sulle piante sono documentati da una vastissima letteratura (vedi [55], [37], [40], [36]). In estrema sintesi, si possono suddividere in visibili e invisibili. Gli effetti visibili consistono essenzialmente nella riduzione della crescita vegetale e quindi della biomassa, e nell’espressione di sintomi fogliari. Gli effetti invisibili includono tutto ciò che porta all’espressione di danni visibili, cioè alterazioni a livello molecolare, biochimico e fisiologico.
Danni visibili da ozono
Gli effetti biologici dell’ozono sulla crescita vegetale sono stati ampiamente studiati per più di 50 anni. La maggior parte dei primi studi consisteva in esperimenti dose-risposta a breve termine, condotti in camere di esposizione controllata ([46]). Soprattutto a causa dello spazio limitato, successivamente sono stati ideati sistemi sperimentali a maggiore capacità, come le camere open-top (OTC) ([30]). Le dimensioni delle OTC e la possibilità di controllare la concentrazione dell’aria in esse insufflata sono ideali per condurre esperimenti dose-risposta. Tuttavia le OTC presentano tutta una serie di problemi che rendono difficile estrapolare i risultati alle condizioni di campo ([39], [45]). In particolare, la ventilazione forzata entro le OTC riduce il tempo in cui il fogliame sarebbe normalmente bagnato in campo ([39]). Questo ed altri effetti microclimatici (“effetto camera”) alterano i processi di sviluppo vegetale ([29]). L’etilendiurea (EDU), descritta per la prima volta da Carnahan et al. ([9]), è un prodotto di sintesi che ha trovato un vasto impiego per proteggere le piante dall’O3, sebbene le basi biochimiche della sua azione antiossidante non siano ancora note ([43]). L’EDU è stata impiegata con successo in esperimenti di campo volti a verificare l’effetto dell’O3 ambiente su piante trattate e non trattate con EDU ([59]). Tuttavia, le difficoltà di somministrazione dell’EDU ad alberi adulti e l’inadeguatezza dei test tossicologici preliminari hanno portato spesso a risultati contraddittori ([1]). Studi di campo attentamente pianificati costituiscono un’alternativa ideale che permette l’esposizione delle piante alle condizioni ambientali e all’O3 dell’ambiente, anche se l’interpretazione e la ripetibilità dei dati sono problematiche a causa delle variazioni climatiche naturali ([43]). Il monitoraggio a lungo termine delle condizioni delle chiome può fornire informazioni importanti per valutare gli effetti dell’O3 sulle foreste, anche se in genere questi programmi non sono portati avanti specificatamente per l’O3 e quindi soffrono di lacune di impostazione che si riflettono sull’accuratezza dei risultati ([16]). L’indicatore più comunemente utilizzato in Europa è la defogliazione (trasparenza delle chiome) che è tipicamente aspecifico e dipende da una molteplicità di fattori, quali la specie, il genotipo, le proprietà del suolo e del clima, la gestione forestale, la competizione per le risorse ([21]). I risultati di 10 anni di monitoraggio lungo una griglia 16x16 km in Europa mostrano che la defogliazione aumenta al crescere del livello di O3 e che questo aumento è più marcato in una specie mesofila come il Faggio che non in una xerotollerante come il Leccio ([35]). Risultati analoghi sono stati (sorprendentemente) ottenuti in una nazione tradizionalmente caratterizzata da basso inquinamento da O3, la Gran Bretagna ([31]). In Italia, uno studio condotto nelle aree CONECOFOR mostra che la defogliazione aumenta all’aumentare dell’AOT40 nel Faggio, ma non nell’Abete rosso ([21]). Tuttavia, la maggior parte della varianza dei dati (90%) è spiegata dai fattori stazionali, il che riduce notevolmente l’impatto potenziale dell’O3. Un’analisi della variazione geografica delle condizioni delle chiome riporta che i maggiori valori di defogliazione si osservano nelle regioni meridionali, in particolare per il Faggio, ma attribuisce questa risposta all’adattamento allo stress idrico ([6]). Sempre Ferretti et al. ([21]) hanno analizzato la variazione dell’incremento di area basimetrica (BAI), che è l’indicatore più prossimo a quello usato per definire i livelli critici per l’O3, cioè i cambiamenti della biomassa ([34]). I valori di BAI diminuiscono significativamente al crescere dell’AOT40 nell’Abete rosso e nelle Querce decidue, ma non nel Faggio. In pratica, 50 anni di studi non sono stati sufficienti a definire con certezza gli effetti dell’ozono sulla crescita delle foreste in situ ([44]). Oggi l’attenzione sugli effetti visibili dell’O3 si concentra sui così detti danni fogliari tipo-ozono ([52]). La variabilità dei sintomi facilita gli errori diagnostici, per cui è corretto riferirsi solo a sintomi attribuibili ad O3 (appunto “tipo-ozono” o ozone-like). Il danno tipo-ozono si esprime usualmente come una punteggiatura scura (più piccola di 1 mm) sulla pagina superiore della foglia oppure come una pigmentazione diffusa sulla pagina superiore, che può consistere in una bronzatura o in un arrossamento (Fig. 3). In ogni caso, la pagina inferiore della foglia è esente da sintomi. Solo verso la fine della stagione, il danno da O3 può manifestarsi anche sulla pagina inferiore. I sintomi non sono mai presenti sulle nervature, mostrano un effetto età ed un effetto ombra. L’effetto età fa sì che le foglie più giovani siano esenti da sintomi, mentre le foglie più vecchie sono maggiormente danneggiate, forse perché sono state esposte più a lungo ma probabilmente vi sono anche ragioni di ordine fisiologico e biochimico. L’effetto ombra impedisce il manifestarsi dei sintomi sulla parte ombreggiata della foglia sottostante (Fig. 3).
Fig. 3 - Classico effetto ombra su foglie di vitalba con sintomi tipo-ozono (Foto Della Rocca). Le zone fogliari ombreggiate risultano asintomatiche.
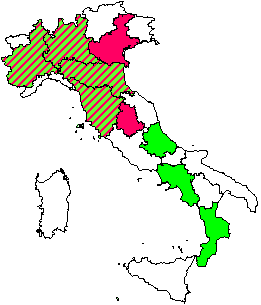
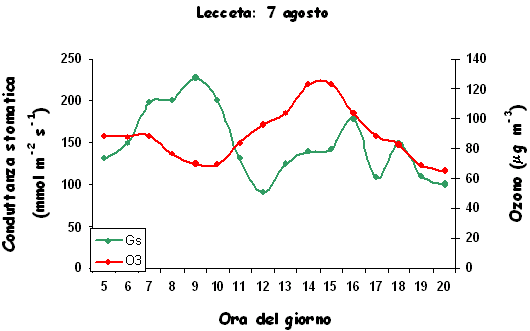
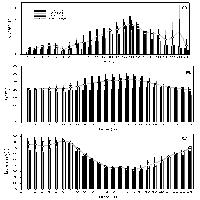
Manuali fotografici per il riconoscimento dei sintomi sono aggi disponibili anche on-line (⇒ http://www.gva.es/ceam/ICP-forests/, ⇒ http://www.ozone.wsl.ch/), oltre al tradizionale supporto cartaceo ([57], [32]). Al momento, il rilievo dei sintomi tipo-ozono in campo fornisce ancora dati solo qualitativi, cioè vengono indicati la presenza/assenza dei sintomi e le specie sintomatiche. Nel 2004, nel Submanual for the Assessment of Ozone Injury on European Forest Ecosystems (⇒ http://www.icp-forests.org/Manual.htm) dell’UN/ECE ICP Forests sono state introdotte delle modifiche allo scopo di consentire una valutazione quantitativa dei sintomi e favorire quindi i confronti fra siti e nel corso del tempo. In Fig. 4 si riassumono le segnalazioni di sintomi tipo-ozono (presenza/assenza) finora disponibili per l’Italia, da cui emerge immediatamente la mancanza di una tendenza crescente da Nord a Sud di espressione dei sintomi, come invece ci saremmo aspettati in base ai calcoli dell’AOT40. Un esempio di ulteriore discrepanza è relativo alla stazione CONECOFOR VEN1 (Cansiglio, Veneto), che, a fronte di basse concentrazioni di O3, è la sola a mostrare sintomi sul faggio tra le varie faggete investigate ([5]). La spiegazione fornita dagli autori è che questa stazione presenta una grande disponibilità di acqua. In caso di stress idrico, infatti, gli stomi tendono a chiudersi, limitando così anche l’assunzione dell’O3, dato che essi rappresentano l’unica via di assorbimento dell’ozono all’interno della pianta. In ambiente mediterraneo, inoltre, gli stomi mostrano una depressione di mezzogiorno, cioè tendono a chiudersi nelle ore più calde del giorno (per limitare le perdite idriche) che sono anche le ore a più elevate concentrazioni di O3 (Fig. 5). Una possibile spiegazione alla minor presenza di sintomi nelle foreste meridionali caratterizzate dai più alti livelli di O3 è dunque proprio l’evitanza, cioè gli stomi si chiudono in risposta allo stress idrico e evitano anche l’assorbimento di O3. Per questo, a livello internazionale, è stato proposto di modificare l’AOT40, che è solo un indice di esposizione, in base alla conduttanza stomatica, derivandone un indice di assorbimento gsto, flusso potenziale di ozono effettivamente assorbito ([61]). A parte le difficoltà tecniche nel mettere in pratica un simile approccio, non esiste la certezza che questa sia realmente la strada giusta da percorrere.
Fig. 4 - Segnalazioni di sintomi tipo-ozono finora disponibili in Italia (da [24], [27], [11], [58], [7], [26], [5], [10], [53], [8]). In rosso le regioni in cui i vari rilievi hanno sempre individuato sintomi; in verde quelle per cui i rilievi non hanno riportato sintomi; in rosso e verde quelle in cui i rilievi hanno dato sia esito positivo che negativo.
Fig. 5 - Conduttanza stomatica in foglie di leccio e concentrazioni atmosferiche di ozono in una giornata d’agosto (stazione CONECOFOR TOS2 - Cala Violina).
Risposte fisiologiche e biochimiche all’ozono in sempreverdi mediterranee
A più riprese, la comunità scientifica internazionale ha chiesto una maggiore attenzione agli ecosistemi dell’Europa meridionale e alla loro risposta all’O3 ([2]). La foresta di latifoglie sempreverdi costituisce la formazione vegetale più tipica della regione mediterranea ([14]). Le sclerofille sempreverdi (tipo Corbezzolo e Fillirea) riducono le perdite idriche grazie a radici profonde e foglie coriacee. Le laurifille sempreverdi (come l’Alloro) sfuggono lo stress idrico occupando siti freschi e ombreggiati. Nali et al. ([48]) hanno esposto tre latifoglie sempreverdi mediterranee, scelte secondo un gradiente di xerofilia (dalla Fillirea, Phillyrea latifolia, più xerotollerante, all’Alloro, Laurus nobilis, più igrofilo, passando per il Corbezzolo, Arbutus unedo), a 0, 55 o 110 ppb di O3 per i tre mesi primaverili, fino a raggiungere una volta e mezzo oppure più di tre volte il livello critico per le foreste. Dosi dunque massicce anche se le concentrazioni sono del tutto realistiche. In una stazione rurale di monitoraggio dell’O3, 55 è il valore medio orario in primavera (Chini, comm. pers.), e 110 è dunque un livello 2x ambiente. I risultati mostrano che il livello ambientale di O3 non danneggia gli scambi fotosintetici, mentre il livello 2x ambiente riduce significativamente la fotosintesi del Corbezzolo e ancor più dell’Alloro, ma non della Fillirea, nonostante questa specie mostri gli scambi (fotosintesi e conduttanza stomatica) più elevati. Questo dato è sorprendente perché se la Fillirea ha la maggiore conduttanza stomatica dovrebbe assorbire più O3 e quindi dovrebbe essere più danneggiata. Per questo sono stati indagati alcuni metaboliti ed enzimi ad attività antiossidante, da cui si evince che il contenuto costitutivo di alcuni antiossidanti (soprattutto la superossido dismutasi) e la loro risposta all’O3 (sia per la superossido dismutasi che per il glutatione) possono concorrere a spiegare il gradiente di risposta all’ozono tra le tre specie. In pratica, la xerotollerante Fillirea può permettersi di tenere aperti gli stomi e di assorbire O3 perchè ha un efficace sistema di detossificazione. Un mero meccanismo di evitanza in effetti non spiegherebbe come mai le provenienze meridionali di Faggio ([49]) e Abete bianco ([38]) siano meno sensibili all’O3 delle provenienze dell’Europa settentrionale. L’esistenza di meccanismi intrinseci che attribuiscono una resistenza specie-specifica all’O3 aprirebbe la possibilità di diversificare i livelli critici di O3 in base sia all’assorbimento gsto, sia alla capacità di detossificazione del mesofillo. Ma ovviamente sono ancora necessarie ulteriori indagini. Una complicazione deriva dal fatto che l’esposizione all’O3 rende gli stomi più lenti nell’aprirsi e soprattutto nel chiudersi in risposta agli stress ([50]). Le attività umane che favoriscono la produzione di O3 determinano anche l’aumento della concentrazione atmosferica di anidride carbonica (CO2). L’accumulo di gas serra (inclusi CO2 e O3) incrementa la temperatura globale media della Terra. Le comunità vegetali del Mediterraneo possono così trovarsi a fronteggiare condizioni di siccità più severe per il contemporaneo aumento delle temperature e decremento delle precipitazioni ([64]). Una chiusura ritardata degli stomi in risposta ad un sempre più frequente stress idrico comporta un aggravamento del deficit idrico vegetale ed un’alterazione dei bilanci idrologici e di flusso di ozono a livello territoriale.
Conclusioni
Per una corretta valutazione dei reali effetti dell’ozono sulle foreste dell’Italia meridionale, è indispensabile migliorare la conoscenza dei livelli di inquinamento da O3 in aree remote italiane (tramite campionatori passivi e/o biomonitoraggio), e delle risposte all’O3 nella vegetazione più tipicamente italiana, sia attraverso esperimenti in condizioni controllate che in campo. Un passo cruciale, infatti, è verificare in condizioni naturali i dati ottenuti nei sistemi di esposizione artificiale. In particolare, sono necessarie più informazioni per determinare le risposte difensive delle piante all’O3, in quanto la complessità della capacità antiossidativa delle piante rende ancora difficile determinarne il potere antiossidante totale ([13]).
Sulla base dei pochi dati finora disponibili, gli attuali livelli di inquinamento da O3 non sembrano rappresentare un rischio gravissimo per le foreste mediterranee italiane, soprattutto per quelle di sclerofille, ben adattate a fronteggiare un altro stress di natura ossidativa come la siccità. Questa capacità di autodifesa sembra legata sia all’evitanza, cioè alla chiusura degli stomi, sia al pool antiossidante, il che suggerirebbe di modificare l’AOT40 sulla base sia della conduttanza stomatica sia della capacità antiossidante. Il quadro comunque non è del tutto rassicurante perché l’O3 rallenta la risposta degli stomi agli stress, il che in definitiva può peggiorare il controllo delle perdite idriche, con tutto ciò che questo comporta nel quadro dei cambiamenti climatici in atto. La valutazione degli effetti del Cambiamento Globale sugli ecosistemi forestali mediterranei deve quindi considerare gli effetti a lungo termine dell’O3 sulle risposte vegetali al variare delle altre condizioni ambientali e dei fattori di stress interagenti, in particolare siccità e incremento della CO2 atmosferica.
Informazioni utili a definire l’impatto dell’O3 sulle nostre foreste possono derivare dal monitoraggio estensivo dei danni fogliari tipo-ozono, purchè condotto secondo le nuove procedure che consentono la quantificazione e quindi la confrontabilità dei risultati.
La conferma della maggiore tolleranza all’ozono delle formazioni vegetali mediterranee potrebbe porre le necessarie basi scientifiche per diversificare i livelli critici per l’ozono in Europa.
Ringraziamenti
Lavoro eseguito nell’ambito del progetto OZONIT, coordinato dal prof. Fausto Manes del Dipartimento di Biologia Vegetale dell’Università“La Sapienza” di Roma e finanziato dal Ministero dell’Ambiente e Tutela del Territorio. Si ringrazia Gianni Della Rocca, IPP-CNR, per le foto di Fig. 3, e Marco Chini, ARPAT Livorno, per i dati di ozono della stazione di Gabbro.
References
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar