Relationships between landscape and moth diversity in Mediterranean mountain forest ecosystems at multiple spatial scales
Forest@ - Journal of Silviculture and Forest Ecology, Volume 14, Pages 75-83 (2017)
doi: https://doi.org/10.3832/efor2296-014
Published: Feb 27, 2017 - Copyright © 2017 SISEF
Research Articles
Guest Editors: ALForLab Project (PON03PE_00024_1 - PON R&C- PAC 2007-2013)
« Public-private lab for the application of innovative technologies with high environmental sustainability in the forest-wood-energy chain »
Collection/Special Issue: Alessandro Paletto (CREA, Trento), Giorgio Matteucci & Mauro Maesano (CNR-ISAFOM)
Abstract
The diversity in composition of moth communities living forest habitats is strongly related to habitat characteristics, depending mainly on dominant forest type. The species in a community have different behaviors and are more or less influenced by the surrounding landscape diversity. The effects of landscape diversity on moth communities are significant when the appropriate spatial scale is considered, which depends on the ecological needs and dispersion abilities of species. In this study we assessed the relationships between landscape diversity at different spatial scales in four different forest Calabrian scenarios, identified by using the CORINE Land Cover, and moth diversity. Nocturnal Lepidoptera were sampled in beech, chestnut, Calabrian black pine and fir forests by using LED light traps. In each forest type 9 traps were positioned, in a total of 36 sample plots selected by the maturity of forest. The diversity of Lepidoptera communities was related to landscape diversity, considering each sample plots as the center of the surrounding landscape analyzed with different buffers (500m, 1000m, 2000m, 3000m, and 5000m). Diversity moth-landscape correlations were performed for: (i) all 36 sample plots; (ii) only broadleaves forest sites; (iii) only conifers forest sites; (iv) only forested plots; (v) only non-forested plots. Our results suggest that landscape composition in forest ecosystems, both at small and medium spatial scale, have a driving role in determining moth communities diversity, pointing out that the landscape structure is a parameter to taking in account for the sustainable management of forests.
Keywords
Lepidoptera, Diversity, Landscape Ecology, CORINE Land Cover, Calabria
Introduzione
L’ecologia del paesaggio (landscape ecology) è una disciplina complessa che ha tra i principali obiettivi lo studio delle interazioni tra i vari elementi del paesaggio, di come essi siano configurati in relazione l’uno all’altro in un mosaico complesso e come tale struttura possa influire su una vasta gamma di modelli e processi ecologici ([21]). Le comunità animali si distribuiscono all’interno di un paesaggio in funzione soprattutto dell’estensione e della qualità ambientale complessiva. Nel caso degli ambienti forestali, i principali parametri che determinano distribuzione e composizione delle comunità sono la tipologia e la maturità dei boschi, ma anche gli ambienti circostanti esercitano un ruolo la cui importanza varia a seconda della scala di indagine ([17]).
Il monitoraggio delle comunità animali restituisce una risposta dell’influenza del paesaggio sulle loro dinamiche. In linea di principio un paesaggio è costituito da una matrice, caratterizzante l’ambiente dominante, e dagli elementi paesaggistici (patch, corridoi, margini, ecc.), i quali garantiscono la presenza ed i movimenti delle specie all’interno della matrice stessa ([6], [18], [5]). Gli insetti rappresentano una delle componenti più sensibili degli ecosistemi forestali, pertanto di grande aiuto nella valutazione degli effetti del paesaggio sulla biodiversità. In particolare, i Lepidotteri vengono spesso utilizzati come bioindicatori a causa dei molteplici ruoli funzionali che ricoprono in qualità di erbivori selettivi, impollinatori, detritivori e prede per altri animali ([16]). L’influenza della struttura del paesaggio sulle comunitàè scala-dipendente, poiché varia in base alle dimensioni delle specie e alla loro capacità di dispersione all’interno della matrice ([21]). Le comunità di Lepidotteri hanno dinamiche differenti a livello di habitat, paesaggio o regione. A piccole scale spaziali (aree non superiori ad 1 ha), la composizione di una comunitàè determinata principalmente dalle piante ospiti, a scale intermedie (aree di circa 10 km2) i processi che influenzano la diversità dei Lepidotteri sembrano essere influenzati maggiormente dal turnover della composizione floristica, dall’isolamento dei siti forestali e dal trattamento selvicolturale a cui sono sottoposte le aree interessate invece che dalle singole specie arboree, infine a scale spaziali più ampie (aree di oltre 100 km2) i fattori che contribuiscono alla formazione di comunità tipiche sono legati alla storia biogeografica e all’eterogeneità del paesaggio ([16]).
Nello scenario nazionale, il paesaggio italiano racchiude uno straordinario patrimonio di biodiversità dovuto alla grande varietà di habitat legati alle pratiche agricole e alle molteplici tipologie di foreste, specie in territori contrassegnati da una ruralità diffusa come quelli del Mezzogiorno ([15]). La frammentazione, la perdita di habitat e il loro deterioramento sono certamente tra le maggiori minacce alla biodiversità e incrementano sensibilmente il rischio di estinzione per alcune specie, danneggiando contestualmente la capacità degli ecosistemi di produrre beni e servizi. Gli effetti conseguenti all’azione dell’uomo (cambi di uso/copertura del suolo, inquinamento, incendi, sovrasfruttamento delle risorse, ecc.) unita ai fenomeni legati al riscaldamento globale (incremento delle temperature, riduzione delle piogge, maggiore occorrenza di eventi estremi, ecc.) hanno portato, specialmente nell’area mediterranea, alla formazione di eterogenei paesaggi agro-forestali con un notevole grado di frammentazione, un mosaico variegato e complesso frutto di una gestione antropica millenaria ([7], [10]).
L’analisi di paesaggio è di fondamentale importanza come supporto alle azioni di pianificazione e sviluppo. In quest’ottica è nata l’iniziativa del progetto CORINE (COoRdination of INformation on the Environment), varato dalla Comunità Europea nel 1985 allo scopo di rilevare e monitorare le caratteristiche di copertura e uso del suolo. È stato realizzato a scala continentale per la prima volta nel 1990 (CLC90), seguito da aggiornamenti progressivamente più accurati (CLC2000, CLC2006 e CLC2012) che hanno coinvolto un numero crescente di Paesi dell’UE. Oggi tale progetto si rivela uno strumento di grande utilità finalizzato non solo all’interpretazione della copertura del suolo ma applicato anche nelle valutazioni di rischio ([12]).
La conoscenza delle relazioni tra popolazioni animali e struttura del paesaggio è necessaria per poter programmare una gestione ecologicamente sostenibile delle risorse ambientali.
In questo lavoro sono stati presi in esame i Lepidotteri notturni di quattro diverse tipologie forestali (faggete, castagneti, pinete ed abetine) per valutare il rapporto fra la diversità delle loro comunità e la diversità del paesaggio e capire a quale scala sia più significativo. Questa analisi potrà contribuire a proporre un modello di gestione sostenibile del paesaggio forestale che tenga in considerazione anche la struttura orizzontale delle foreste come determinante della biodiversità ospitata.
Materiali e metodi
Aree di studio
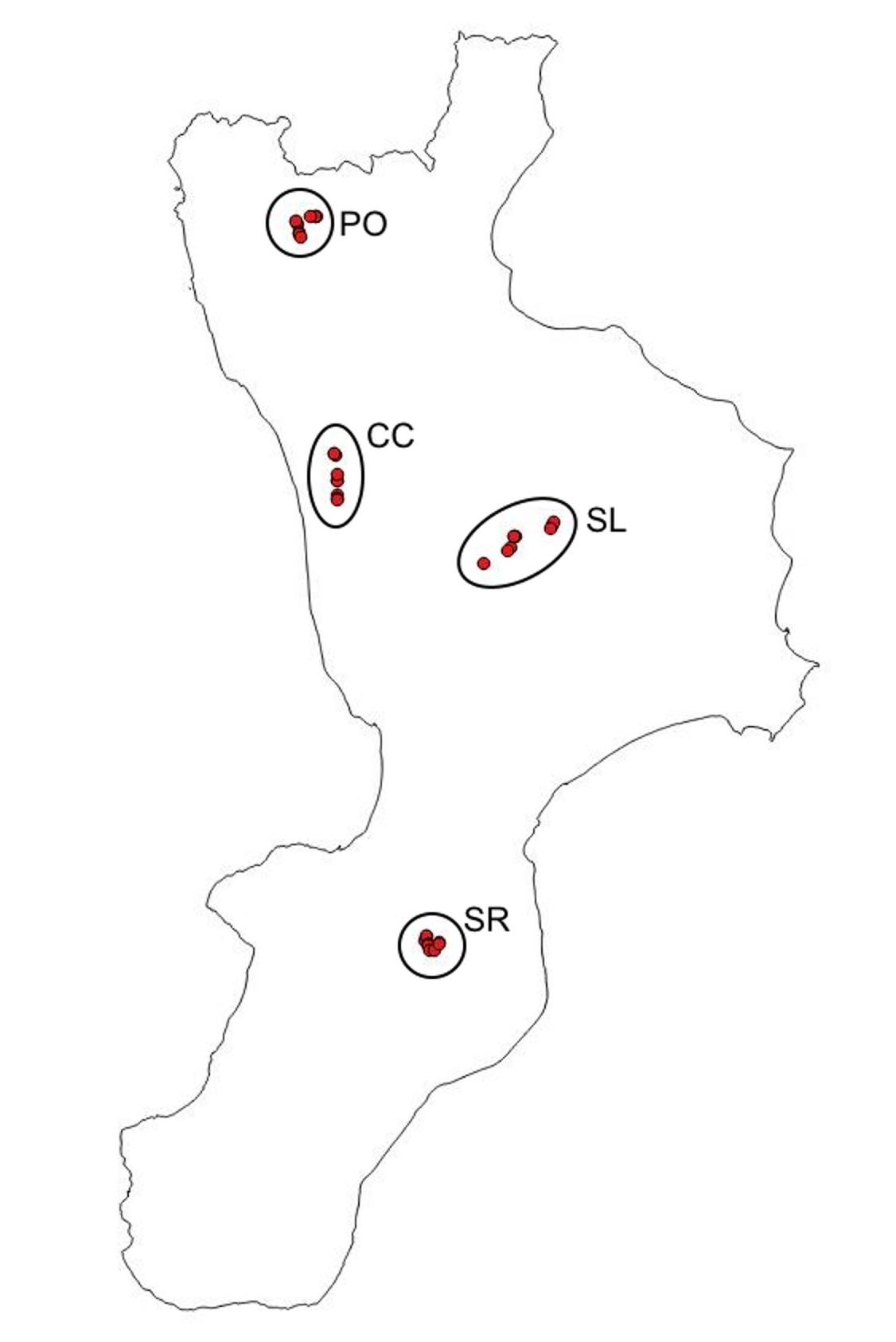
Le comunità di Lepidotteri notturni sono state campionate in quattro diversi scenari boschivi, rappresentanti i maggiori tipi forestali montani della Calabria ([1]). Le indagini hanno interessato: le faggete a Fagus sylvatica L. del Massiccio del Pollino (PO); i castagneti a Castanea sativa Mill. della Catena Costiera (CC); le pinete a Pinus nigra calabrica (Loud.) Cesca & Peruzzi dell’Altopiano della Sila (SL); le abetine a Abies alba Mill. delle Serre Vibonesi (SR) (Fig. 1).
Fig. 1 - Ubicazione dei punti di campionamento nei quattro scenari boschivi indagati (Pollino PO, Catena Costiera CC, Sila SL, Serre SR).
In ciascuno scenario, sono stati selezionati 9 punti di campionamento raggruppati in triplette (A1-A2-A3, B1-B2-B3 , C1-C2-C3), per un totale di 36 siti di raccolta. In ciascuna tripletta sono rappresentati tre diversi stadi successionali del bosco, rispettivamente: (1) boschi maturi, con alberi di età superiore agli 80 anni; (2) boschi giovani (fustaie o cedui) di età compresa tra 20 e 40 anni; (3) ambienti aperti, radure o tagli recenti circondati da una matrice boschiva (Tab. 1).
Tab. 1 - Descrizione delle stazioni campionate: vengono riportati i codici alfanumerici assegnati a ogni stazione, i nomi delle località, le coordinate UTM, la quota e lo stadio di maturità del bosco.
| Scenario | Località | Codice | Coord.UTM E | Coord. UTM N | Quota(m) | Tipologia trattamento |
|---|---|---|---|---|---|---|
| Pollino | Serrapaolo | PO_A1 | 593380.280 | 4408629.750 | 990 | Faggeta - fustaia matura disetanea |
| Pollino | Serrapaolo | PO_A2 | 593145.980 | 4408625.880 | 1010 | Faggeta - ceduo avviato a fustaia |
| Pollino | Serra Ambruna | PO_A3 | 592154.600 | 4408713.410 | 1035 | Radura in faggeta mista |
| Pollino | Bocca di Novacco | PO_B1 | 589227.260 | 4407585.740 | 1315 | Faggeta - fustaia matura disetanea |
| Pollino | Bruscata | PO_B2 | 589605.060 | 4407229.840 | 1370 | Faggeta - ceduo avviato a fustaia |
| Pollino | Bocca di Novacco | PO_B3 | 589457.290 | 4407641.730 | 1339 | Radura in faggeta |
| Pollino | Timpone della Magara | PO_C1 | 590076.780 | 4405412.040 | 1465 | Faggeta - fustaia matura disetanea |
| Pollino | Timpone della Magara | PO_C2 | 589926.230 | 4405142.610 | 1460 | Faggeta - ceduo avviato a fustaia |
| Pollino | Timpone della Magara | PO_C3 | 590112.840 | 4404524.500 | 1475 | Radura in faggeta |
| Catena Costiera | Fiego di S. Fili | CC_A1 | 597305.260 | 4354806.350 | 723 | Castagneto da frutto |
| Catena Costiera | Fiego di S. Fili | CC_A2 | 597338.100 | 4354031.430 | 749 | Castagneto - ceduo maturo |
| Catena Costiera | Fiego di S. Fili | CC_A3 | 597286.880 | 4353884.900 | 734 | Castagneto - ceduo (< 3 anni) |
| Catena Costiera | Bosco dei Gesuiti | CC_B1 | 597450.200 | 4357511.910 | 618 | Castagneto da frutto |
| Catena Costiera | Bosco dei Gesuiti | CC_B2 | 597428.660 | 4357562.120 | 626 | Castagneto - ceduo |
| Catena Costiera | Mandarino | CC_B3 | 597407.180 | 4358601.680 | 583 | Castagneto - ceduo (< 3 anni) |
| Catena Costiera | Glicarello | CC_C1 | 596907.770 | 4362569.920 | 550 | Castagneto da frutto |
| Catena Costiera | Vallone Argentino | CC_C2 | 596647.810 | 4362750.450 | 565 | Castagneto - ceduo maturo |
| Catena Costiera | Vallone Argentino | CC_C3 | 596863.170 | 4362822.960 | 545 | Castagneto - taglio con rilascio matricine |
| Sila | Montagna Grande | SL_A1 | 638895.150 | 4348709.710 | 1352 | Pineta - fustaia matura |
| Sila | Montagna Grande | SL_A2 | 639189.070 | 4349312.450 | 1325 | Pineta - rimboschimento 2x2 non diradato |
| Sila | Montagna Grande | SL_A3 | 638566.080 | 4348166.120 | 1344 | Radura |
| Sila | Torre Scarda | SL_B1 | 630869.060 | 4344438.230 | 1324 | Pineta - fustaia disetanea matura |
| Sila | Quaresima | SL_B2 | 625633.510 | 4341424.980 | 1306 | Pineta - rimboschimento diradato |
| Sila | Quaresima | SL_B3 | 630222.350 | 4343968.610 | 1325 | Radura pascolata |
| Sila | Colle Macchie | SL_C1 | 631744.210 | 4346638.830 | 1428 | Pineta - fustaia matura disetanea |
| Sila | Vallivone | SL_C2 | 632054.060 | 4346721.550 | 1446 | Pineta - rimboschimento diradato |
| Sila | Colle Macchie | SL_C3 | 631599.430 | 4346653.070 | 1433 | Radura pascolata |
| Serre | S. Maria | SR_A1 | 614221.470 | 4268211.510 | 847 | Abetina - fustaia matura |
| Serre | Palmento | SR_A2 | 614499.700 | 4269051.600 | 831 | Abetina - fustaia giovane |
| Serre | Palmento | SR_A3 | 614593.160 | 4269034.600 | 827 | Abetina - taglio con matricine e rinnovamento con latifoglie |
| Serre | Cattarinella | SR_B1 | 614985.160 | 4267580.800 | 943 | Abetina - fustaia matura |
| Serre | Cattarinella | SR_B2 | 615080.790 | 4267287.710 | 963 | Abetina - rimboschimento 2x2 |
| Serre | Cattarinella | SR_B3 | 615261.050 | 4266275.330 | 1045 | Radura |
| Serre | Sietto dello Caricatore | SR_C1 | 617070.030 | 4267910.150 | 1086 | Abetina - fustaia matura |
| Serre | Pietra del Signore | SR_C2 | 616059.050 | 4266558.500 | 1090 | Abetina mista a faggio con rinnovazione |
| Serre | Sietto dello Caricatore | SR_C3 | 617022.420 | 4267763.470 | 1091 | Abetina mista a faggio diradata selettivamente |
Metodi di campionamento
Per la cattura dei Lepidotteri notturni sono state impiegate trappole luminose a LED con picco di emissione a 395 nm (15 W - [8]), posizionate in ciascun punto di campionamento. Le trappole ricadenti nello stesso scenario sono state attivate simultaneamente, mentre ogni ciclo di campionamento, comprendente tutte le aree indagate, è stato completato nel giro di 10-15 giorni. I campionamenti sono stati effettuati tra maggio e novembre 2015, attivando le trappole per una notte al mese in ciascuno scenario indagato. Gli esemplari raccolti sono stati identificati e conservati presso l’Unità di Ricerca per la Selvicoltura in Ambiente Mediterraneo (CREA-SAM) di Rende (CS).
Analisi dei dati
La diversità delle comunità campionate è stata misurata tramite il software EstimateS 9.1.0 ([4]) utilizzando l’indice Alpha di Fisher che tiene conto sia del numero di specie (S) che del numero di individui (N) presenti nel campione, pertanto valido indicatore di ricchezza specifica poiché sensibile anche alle specie rare ([3]).
Mappa di land cover
Allo scopo di analizzare le caratteristiche di composizione e configurazione del paesaggio è stata utilizzata la CORINE Land Cover 2012 al IV livello di dettaglio (CLC2012). L’unità minima cartografabile (MMU) è di 25 ha, mentre i cambiamenti di uso del suolo registrato nei successivi aggiornamenti sono stati mappati se superiori ai 5 ha. In particolare, la realizzazione della CLC2012 è avvenuta tra il 2011 e il 2012 usando come contenuti informativi dati provenienti dai satelliti IRS P6 LISS III e RapidEye. In questo lavoro abbiamo utilizzato la versione della mappa al IV livello di dettaglio, così da ottenere una migliore identificazione delle classi di copertura del suolo (circa 80 classi) con una particolare attenzione per le diverse specie forestali.
Per esplorare l’influenza delle caratteristiche del paesaggio a differenti scale spaziali, sono stati utilizzati buffer a raggio crescente (500m, 1000m, 2000m, 3000m e 5000m) aventi come centro i 36 punti di campionamento ubicati nei 4 scenari.
Metriche di paesaggio
Le metriche di paesaggio possono essere calcolate a tre diversi livelli di ordine gerarchico, corrispondenti a differenti livelli di organizzazione. Trascurando il livello di patch, che rappresenta l’unità base minima costituita da piccoli insiemi omogenei di pixel, e il livello di classe (aggregazione di patch con le stesse caratteristiche), è stato analizzato solo il livello di landscape (l’intero mosaico).
Sulla base degli esempi presenti in letteratura e focalizzati sulle medesime tematiche ([19]), in questo lavoro è stato utilizzato l’indice di diversità di Shannon (SHDI) come metrica di eterogeneità di paesaggio.
Correlazione tra paesaggio e Lepidotteri
La diversità del paesaggio (SHDI) e delle comunità dei Lepidotteri (Alpha di Fisher) sono state correlate utilizzando l’indice di correlazione di Pearson. Le correlazioni sono state analizzate per ciascun buffer prendendo in esame: (i) tutte le stazioni; (ii) solo le stazioni di latifoglie (PO e CC); (iii) solo le stazioni di conifere (SR e SL); (iv) solo le stazioni “bosco” (tutti i siti 1 e 2); (v) solo le stazioni “non bosco” (tutti i siti 3).
Risultati
Il maggior numero di specie (72.8%) e di individui (85.7%) di Lepidotteri notturni è stato campionato nei siti con copertura forestale (1- boschi maturi e 2-boschi giovani/cedui maturi). I siti in cui è stata campionata la maggior parte delle specie e degli individui non necessariamente presentano anche i più alti valori di diversità di Fisher. Questo indice infatti mostra un andamento variabile, presentando valori più o meno elevati indipendentemente dallo stadio successionale del bosco (Tab. 2).
Tab. 2 - Diversità dei Lepidotteri e diversità di paesaggio misurate per ciascuna stazione. Si riportano numero di individui (N), numero di specie (S) campionati e indice di diversità di Fisher (Alpha) per le comunità dei Lepidotteri e diversità di Shannon (SHDI) del paesaggio ai diversi buffer indagati.
| Stazione | Comunità di Lepidotteri | SHDI paesaggio | ||||||
|---|---|---|---|---|---|---|---|---|
| N | S | Alpha | 500m | 1000m | 2000m | 3000m | 5000m | |
| SR_A1 | 672 | 119 | 42.00 | 0.3176 | 0.933 | 1.5822 | 1.9985 | 2.1534 |
| SR_A2 | 751 | 136 | 48.55 | 1.1997 | 1.4117 | 1.7018 | 1.9467 | 2.1642 |
| SR_A3 | 155 | 73 | 53.86 | 1.2328 | 1.4205 | 1.6851 | 1.9227 | 2.1608 |
| SR_B1 | 487 | 98 | 36.96 | 1.0258 | 1.2413 | 1.4519 | 1.8084 | 2.1589 |
| SR_B2 | 637 | 103 | 34.79 | 1.1702 | 1.342 | 1.4766 | 1.8192 | 2.1479 |
| SR_B3 | 221 | 76 | 40.96 | 1.3082 | 1.5643 | 1.5822 | 1.9543 | 2.1364 |
| SR_C1 | 641 | 93 | 29.89 | 0.3453 | 0.5755 | 1.3981 | 1.7968 | 2.1239 |
| SR_C2 | 1201 | 113 | 30.57 | 0.839 | 1.2541 | 1.5725 | 1.9128 | 2.1204 |
| SR_C3 | 260 | 69 | 30.69 | 0.3849 | 0.6662 | 1.3979 | 1.7984 | 2.1215 |
| SL_A1 | 1114 | 147 | 45.36 | 0 | 0.1712 | 0.5819 | 0.9077 | 1.1879 |
| SL_A2 | 2530 | 157 | 37.04 | 0 | 0.216 | 0.7656 | 0.863 | 1.2281 |
| SL_A3 | 1046 | 141 | 43.9 | 0 | 0.2138 | 0.5119 | 0.9265 | 1.2362 |
| SL_B1 | 1367 | 139 | 38.69 | 0.6243 | 0.8888 | 1.6253 | 1.712 | 1.9492 |
| SL_B2 | 869 | 135 | 44.76 | 1.2277 | 1.7935 | 2.0841 | 2.0683 | 2.3182 |
| SL_B3 | 247 | 75 | 36.65 | 0.7401 | 0.992 | 1.5441 | 1.6972 | 1.9508 |
| SL_C1 | 1119 | 142 | 43.10 | 0.5236 | 1.3339 | 1.8052 | 1.9544 | 2.0753 |
| SL_C2 | 1790 | 146 | 37.59 | 0.8719 | 1.2925 | 1.7716 | 1.9381 | 2.0594 |
| SL_C3 | 405 | 83 | 31.61 | 0.4612 | 1.311 | 1.8042 | 1.9768 | 2.0843 |
| PO_A1 | 6361 | 204 | 40.24 | 0.6698 | 0.7452 | 1.3155 | 1.6199 | 2.0984 |
| PO_A2 | 8295 | 226 | 42.88 | 0.6603 | 0.7073 | 1.3078 | 1.5903 | 2.0551 |
| PO_A3 | 1966 | 166 | 43.25 | 0.6313 | 0.8008 | 1.1315 | 1.5141 | 1.9105 |
| PO_B1 | 918 | 110 | 32.62 | 1.0598 | 0.7645 | 0.3826 | 0.6607 | 1.6483 |
| PO_B2 | 2399 | 128 | 28.88 | 0.5087 | 0.7757 | 0.4322 | 0.4926 | 1.5061 |
| PO_B3 | 602 | 90 | 29.32 | 0.8217 | 0.7283 | 0.4076 | 0.6745 | 1.6423 |
| PO_C1 | 3491 | 97 | 18.49 | 0 | 0.1638 | 0.5304 | 0.5995 | 0.9983 |
| PO_C2 | 1842 | 119 | 28.42 | 0 | 0.0387 | 0.5342 | 0.6054 | 0.9584 |
| PO_C3 | 684 | 121 | 42.69 | 0 | 0.2021 | 0.5291 | 0.7037 | 0.9459 |
| CC_A1 | 1029 | 150 | 48.42 | 0.2767 | 1.0021 | 1.6926 | 1.9352 | 2.2381 |
| CC_A2 | 987 | 145 | 46.87 | 0.0634 | 0.9166 | 1.7237 | 1.8906 | 2.2329 |
| CC_A3 | 507 | 121 | 50.32 | 0.271 | 0.9572 | 1.7479 | 1.8948 | 2.2299 |
| CC_B1 | 651 | 143 | 56.62 | 1.0564 | 1.3926 | 1.9403 | 2.125 | 2.3673 |
| CC_B2 | 1649 | 193 | 56.70 | 0.9938 | 1.3215 | 1.9256 | 2.1237 | 2.3685 |
| CC_B3 | 452 | 120 | 53.39 | 1.0028 | 1.2827 | 1.8327 | 2.2036 | 2.4143 |
| CC_C1 | 665 | 137 | 52.33 | 0.8669 | 1.1955 | 1.7289 | 2.0122 | 2.3385 |
| CC_C2 | 1601 | 172 | 48.87 | 0.4649 | 1.0999 | 1.5302 | 1.9549 | 2.3456 |
| CC_C3 | 623 | 118 | 43.10 | 0.8134 | 1.2314 | 1.7201 | 1.9979 | 2.3224 |
La diversità di paesaggio (SHDI) aumenta tendenzialmente con l’aumentare del buffer considerato, ad eccezione dei siti PO_B1 e PO_B2 per i quali si ha un decremento della diversità ai buffer 2000m e 3000m. Inoltre per siti A della Sila e per i siti C del Pollino non è presente diversità di paesaggio secondo il CLC2012 considerando il buffer di 500m (Tab. 2).
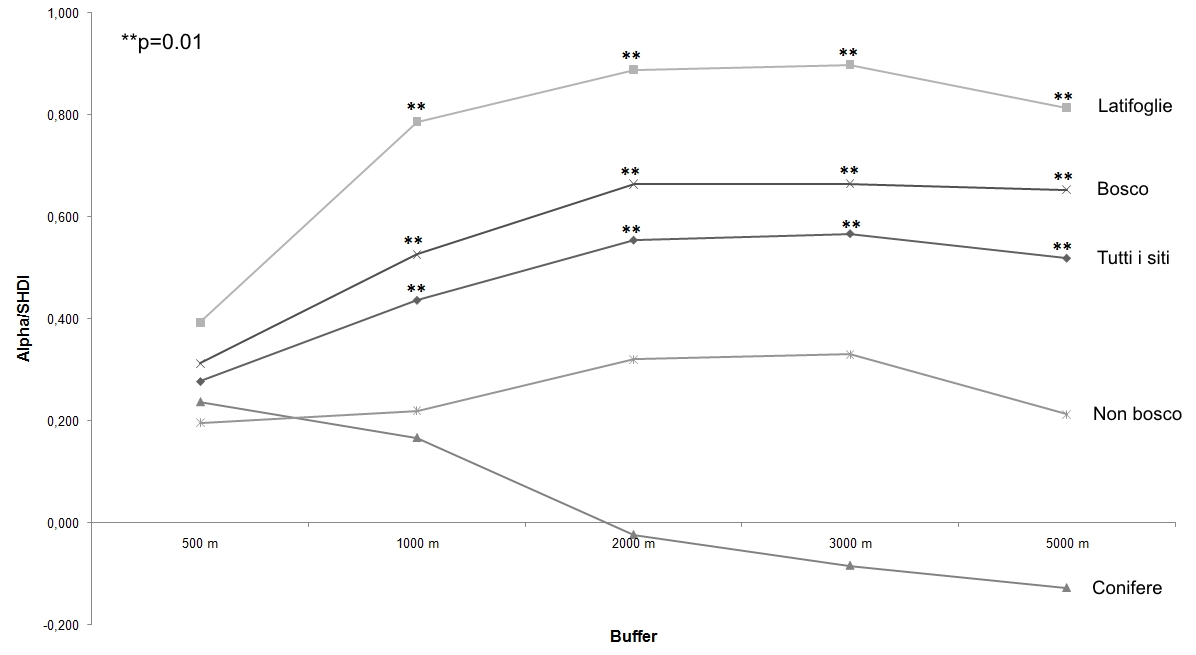
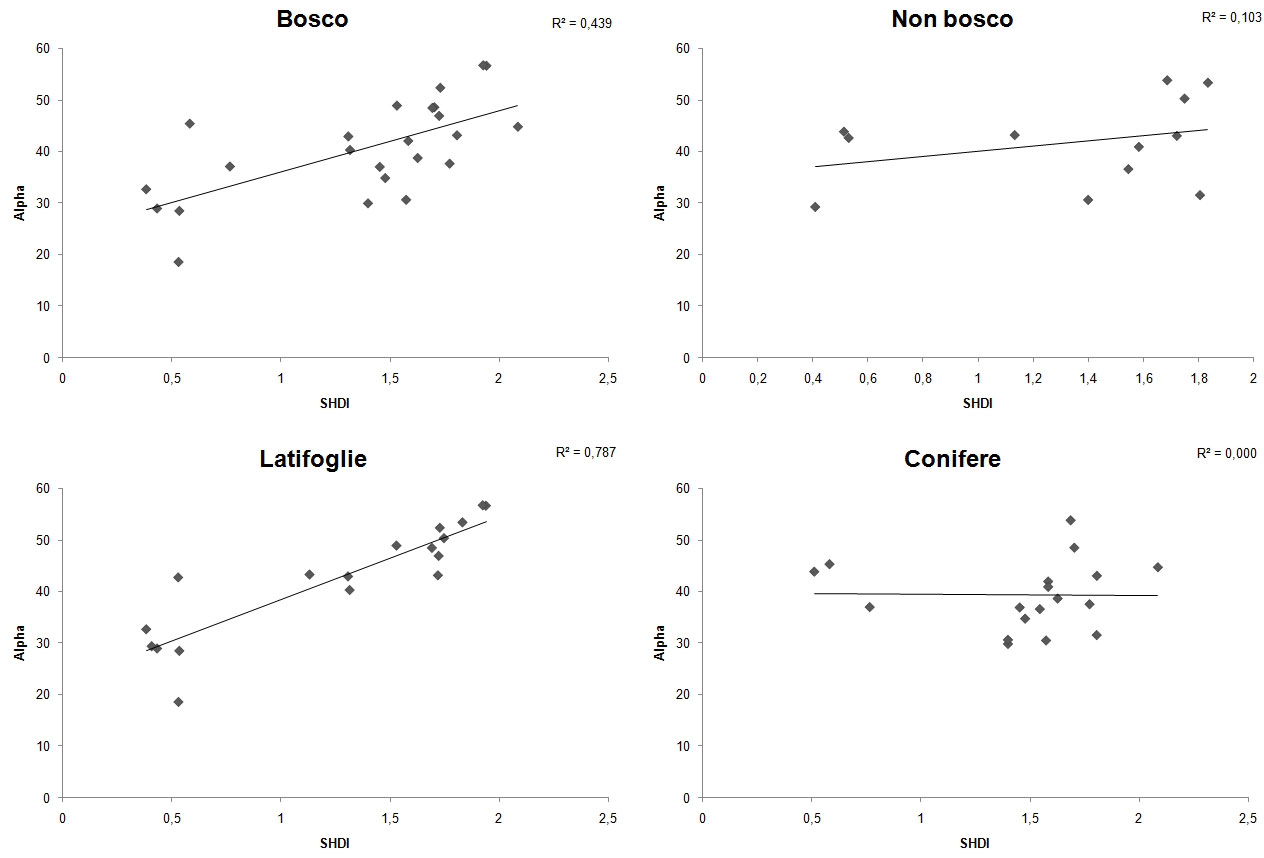
La diversità del paesaggio mostra correlazioni statisticamente significative con la diversità dei Lepidotteri a buffer superiori ai 500 m prendendo in esame: (a) tutti i siti indagati; (b) solo i siti di latifoglie (faggete e castagneti); e (c) solo i siti boscati (Fig. 2). Non è stata evidenziata alcuna correlazione della diversità del paesaggio con la diversità delle comunità delle conifere (pinete ed abetine) e dei siti relativi allo stadio più giovane della successione ecologica, a prescindere dal buffer in considerazione. La correlazione aumenta sensibilmente fino al buffer di 2000 m, mentre per buffer superiori rimane pressoché costante o subisce un leggero decremento. Tuttavia, l’analisi della regressione al buffer di 2000 m, mostra valori piuttosto bassi di R2 anche quando la correlazione è significativa, ad eccezione delle latifoglie che ne mostrano, invece, un valore elevato (Fig. 3).
Fig. 2 - Correlazioni fra diversità del paesaggio (SHDI) e diversità (Alpha) delle comunità di Lepidotteri campionate a buffer crescenti. Le correlazioni statisticamente significative sono evidenziate con asterischi (**: p=0.01).
Fig. 3 - Trend di dispersione della correlazione tra diversità di paesaggio (SHDI) e comunità di Lepidotteri (Alpha) per i siti boscati (tutti i siti 1 e 2), i siti non boscati (tutti i siti 3), solo i siti di latifoglie (PO e CC), solo i siti di conifere (SL e SR) analizzata al buffer di 2000m.
Discussione
La diversificazione dei paesaggi forestali indagati è dovuta in massima parte all’alternanza fra boschi e aree aperte sottoposte ad utilizzi vari come pascoli, coltivi, aree ceduate, ecc.
La diversità dei Lepidotteri notturni è influenzata dalla diversità del paesaggio, ma questo sembra dipendere in maniera importante dalla tipologia forestale presa in considerazione. Infatti, ad un significativo rapporto fra le comunità di Lepidotteri e le foreste di latifoglie fa da contraltare l’assenza di relazioni di queste con le conifere.
Probabilmente l’assenza di correlazione con le conifere è da porre in relazione con la presenza nelle comunità di specie in comune con le formazioni erbacee proprie degli ambienti aperti, i quali, in questo scenario, non contribuiscono all’aumento complessivo della biodiversità. D’altra parte, la presenza di ambienti aperti nel paesaggio dominato dalle latifoglie, il cui sottobosco è piuttosto povero di diversità floristica, fornisce un contributo importante alla diversità complessiva del paesaggio. Pertanto, mentre nelle aree dominate da conifere i Lepidotteri legati allo strato erbaceo sono comunque presenti a prescindere dalla composizione del paesaggio, questi possono entrare a far parte delle comunità delle latifoglie in maniera apprezzabile solo se nel paesaggio sono presenti delle patch di zone aperte. Come osservato anche da Van Halder et al. ([19]), le differenze nella struttura delle comunità di Lepidotteri dipendono in massima parte dalla composizione della vegetazione del sottobosco piuttosto che dal tipo di habitat.
Questo è risultato particolarmente vero per le specie le cui larve sono troficamente legate alle graminacee. Ad esempio, Agrotis cinerea (Denis & Schiffermüller, 1775 - famiglia Noctuidae), è egualmente abbondante lungo la successione ecologica delle pinete della Sila (77 individui nei boschi maturi, 55 nei boschi giovani e 80 nelle aree aperte), ma è molto più asimmetricamente distribuita nelle faggete del Pollino (19 individui nei boschi maturi, 10 nei boschi giovani e 104 nelle aree aperte). Un altro esempio è dato dalla distribuzione di Pachetra sagittigera (Hufnagel, 1766 - famiglia Noctuidae), che mostra un pattern simile e che ha addirittura il suo massimo proprio nello stadio più maturo della successione ecologica delle pinete (111 individui nei boschi maturi, 54 nei boschi giovani e 49 nelle aree aperte) in virtù della sua elevata sciafilia. Nella faggeta del Pollino, invece, anche questa specie è decisamente più abbondante nei prati e nei pascoli (8 individui nei boschi maturi, 12 nei boschi giovani e 73 nelle aree aperte).
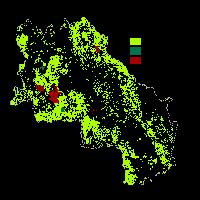
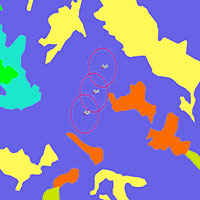
Dall’analisi di correlazione tra diversità di paesaggio e comunità di Lepidotteri è emerso che non vi è significatività considerando un buffer di 500 m intorno al punto di campionamento. Ciò porterebbe alla spiegazione che a piccole scale spaziali la diversità delle comunità non sembra essere influenzata dal paesaggio circostante. In realtà, analizzando in dettaglio i siti indagati, emerge una discordanza nell’identificazione delle patch fornita dal CLC2012 e da quella ottenuta da fotointerpretazione. Ad esempio i siti SL_A1, SL_A2, SL_A3 delle pinete della Sila e i siti PO_C1, PO_C2, PO_C3 delle faggete del Pollino, secondo il CLC2012 non presentano alcuna diversità di paesaggio al buffer di 500 m (SHDI = 0) anche se dalla fotointerpretazione è evidente la disomogeneità all’interno del buffer (Fig. 4).
Fig. 4 - I siti PO_C1, PO_C2, PO_C3 con un buffer di 500 m appartengono alla categoria 3115 (Boschi a prevalenza di faggio) secondo l’interpretazione del CLC12 IV livello (1A), mentre in 1B è chiara la presenza di zone aperte; i siti SL_A1, SL_A2, SL_A3 con un buffer di 500 m rientrano nella categoria 3112 (Boschi a prevalenza di pini montani e oromediterranei (pino nero e laricio, pino silvestre, pino loricato) mentre dall’ortofoto 2B il paesaggio si presenta disomogeneo.
La scarsa efficienza dell’unità di mappatura minima (MMU) del CLC2012 nel riconoscere discontinuità paesaggistiche a piccole scale spaziali potrebbe alterare l’interpretazione dei risultati riguardanti la diversità delle comunità di Lepidotteri. In alcuni lavori è emerso che specie stenoecie e con scarsa capacità di dispersione sono correlate alla diversità del paesaggio solo considerando piccole scale spaziali, ossia buffer inferiori ai 500 m e che, al contrario, per le specie generaliste si apprezzano gli effetti della diversità di paesaggio a scale spaziali più ampie ([2], [9], [5], [13]). La scelta del buffer ottimale per la correlazione tra diversità del paesaggio e comunità di Lepidotteri resta comunque un parametro di fondamentale importanza negli studi ecologici. Secondo Ovaskainen et al. ([11]) per verificare gli effetti della struttura del paesaggio sulla diversità delle comunità, bisogna considerare un buffer che sia superiore alla capacità di dispersione delle specie, il quale varia notevolmente tra specie sedentarie o poco vagili e migratrici. Un maggiore dettaglio delle caratteristiche paesaggistiche anche a piccola scala è necessario nella determinazione dei fattori che influenzano le comunità dei Lepidotteri. Come osservato in altri studi, è bene tenere in conto le caratteristiche sia dei singoli habitat che del paesaggio circostante, poiché la diversità ecologica risente degli effetti del paesaggio a scale differenti ([20], [14], [19]). La tutela di habitat di ridotte superfici è importante per una corretta redazione dei piani di gestione delle aree protette, i quali devono prevedere interventi mirati alla protezione di questi habitat che possono ospitare specie di importanza conservazionistica. Pertanto, nella pianificazione degli interventi sostenibili, un’analisi multiscala rappresenta la scelta ottimale per la valutazione dei pattern di biodiversità che si alternano nelle piccole patch e condividono lo stesso paesaggio a più ampia scala.
Ringraziamenti
Si ringraziano Carlo Di Marco, Franco Calabrese, Gino Scarpelli, Massimo ed Ettore Salerno per il supporto tecnico. Il lavoro è stato finanziato dal Progetto “ALForLab” (PON03PE_00024_1) cofinanziato dal Programma Operativo Nazionale Ricerca e Competitivita’ (PON R&C) 2007-2013, attraverso il Fondo Europeo di Sviluppo Regionale (FESR) e risorse nazionali (Fondo di Rotazione (FDR) - Piano di Azione e Coesione (PAC) MIUR).
References
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar