Ozone: threat perception and early-defense reactions. The poplar case
Forest@ - Journal of Silviculture and Forest Ecology, Volume 2, Pages 98-106 (2005)
doi: https://doi.org/10.3832/efor0258-0020098
Published: Mar 10, 2005 - Copyright © 2005 SISEF
Research Articles
Guest Editors: Matera Meeting (2004)
« Climate change and pollution: effects on the southern Italian forests »
Collection/Special Issue: Elena Paoletti
Abstract
Air pollution is believed to be one of the main factors contributing to forest decline. There is growing evidence that ozone, the concentration of which is continuously increasing and in many European region exceeds the threshold of toxicity for sensitive species, is involved in the genesis of this phenomenon. Recently, the similarities between O3-induced responses and the hypersensitive reactions induced by a pathogen attack, led to the suggestion that O3 phytotoxicity could be the consequence of a cascade of events regulated by signalling molecules, interacting with each others in a rather complex manner and ultimately leading to the induction of defense responses or cell death. The present work was addressed at investigating the mechanisms of O3 perception and some early responses carried out by the plant cell in an attempt to counteract its effects. Two poplar clones showing different sensitivity towards the pollutant as far as visible symptoms are concerned (I-214 O3-resistant and Eridano O3-sensitive) were used as a model system. The obtained data let us to hypothesize that the major sensitivity shown by Eridano could derive from a marked H2 O2 accumulation and increase in salicylic acid content and ethylene evolution which were more pronounced than in I-214. Thus, the O3-induced damage could be the consequence of an abnormal uncontrolled induction of metabolic pathways usually involved in the defensive response, the exaggerated and prolonged stimulation of which could lead to cell death.
Keywords
Stato dell’arte
Nei primi anni ’80 la preoccupazione generata dalla drammatica perdita di vitalità di molte aree forestali in Europa e nel Nord America, associata alla crescente consapevolezza dell’importanza degli ecosistemi forestali sia da un punto di vista ecologico che economico, ha gettato le basi per una serie di studi volti a ricercare le cause responsabili del cosiddetto “forest decline”. Questo fenomeno viene sempre più spesso messo in correlazione con i danni indotti dall’inquinamento atmosferico ([6]) che nel bacino del Mediterraneo rappresenta infatti una delle principali cause del deperimento delle specie arboree ([11], [9]), manifestandosi non solo attraverso un’azione fitotossica diretta, ma anche inducendo nelle piante un’aumentata suscettibilità a fattori stressanti abiotici e a malattie parassitarie, soprattutto secondarie e opportunistiche. Tra i diversi fattori correlabili all’insorgenza di questo fenomeno, l’ozono troposferico non è esente da responsabilità, dal momento che è in grado di esercitare la propria fitotossicità a concentrazioni piuttosto basse. Le piante che dimostrano elevata sensibilità nei confronti dell’inquinante sono infatti già a rischio in presenza di 40 nl l-1 di ozono ([10]). Negli ultimi cento anni la concentrazione di ozono è più che raddoppiata, raggiungendo e superando, in molte regioni europee, i limiti di tossicità per le specie vegetali sensibili ([34]). Studi condotti sulla distribuzione dell’O3 su scala mondiale hanno evidenziato un progressivo incremento della superficie esposta a concentrazioni di O3 superiori a 60 nl l-1 durante il mese di luglio e secondo le previsioni fatte, tale percentuale nel 2100 arriverà a coprire circa il 50% della superficie forestale globale ([7]).
Gli ecosistemi forestali sono caratterizzati da un’elevata complessità. Il monitoraggio dello stato di salute di una foresta necessita quindi dell’integrazione di analisi condotte su più livelli, a partire dall’ecosistema nel suo complesso sino ad arrivare al tessuto fogliare e alla singola cellula.
Suscettibilità all’O3 e risposte precoci
Il nostro lavoro ha previsto l’impiego di due cloni di pioppo con diversa sensibilità nei confronti dell’O3, in termini di sintomatologia fogliare, (clone I-214, O3-resistente, e clone Eridano, O3-sensibile) come sistema modello per indagare i meccanismi attraverso i quali la pianta percepisce il fattore di disturbo rappresentato dall’O3 e per studiare le reazioni precoci di risposta messe in atto nel tentativo di contrastarne gli effetti. A questo scopo le talee sono state fumigate con 150 nl l-1 di O3 in un esperimento della durata di 5 ore, effettuato in condizioni controllate di luce, temperatura e umidità relativa. Questo tipo di esposizione, pur rappresentando una situazione poco naturale e una evidente esemplificazione del complesso fenomeno responsabile del forest decline, permette di isolare gli effetti dell’O3 da quelli indotti da altri fattori di stress, e costituisce quindi un indispensabile complemento agli studi di tipo eco-fisiologico e di monitoraggio ambientale.
La risposta di una pianta all’ozono dipende da una serie di eventi che hanno inizio con l’assorbimento dell’inquinante, cui fanno seguito alterazioni o danni metabolici a carico della cellula vegetale la cui entità dipende, oltre che dalle condizioni ambientali, dalla sensibilità delle specie all’inquinante. La quantità di O3 assorbita dai tessuti vegetali gioca un ruolo chiave nel determinare gli effetti sul metabolismo e sulla fisiologia della pianta. L’assorbimento è principalmente regolato dalla velocità degli scambi gassosi a livello di foglia, anche se altri fattori operanti a diversi livelli possono contribuire alla regolazione ([1]). È noto che l’O3 penetra attraverso gli stomi e che tale ingresso è regolato dal numero e dalle dimensioni degli stomi, nonché dal loro grado di apertura ([29]). Un’elevata conduttanza stomatica potrebbe quindi effettivamente determinare una maggiore sensibilità all’inquinante anche se più importante risulta essere il flusso effettivo di gas che penetra all’interno del mesofillo, parametro che dipende sia dalla conduttanza stomatica che dall’area effettiva del mesofillo esposta all’inquinante, dallo spessore della parete cellulare e dalla presenza di molecole detossificanti capaci di reagire con l’O3 e quindi limitarne il flusso prima che esso possa raggiungere le plasmamembrane ([5]). Tuttavia, un nostro studio, condotto in collaborazione con il Prof. Moldau dell’Institute of Molecular and Cell Biology dell’Università di Tartu, Estonia, ha evidenziato come la conduttanza stomatica e il flusso di ozono che raggiunge il plasmalemma, calcolato applicando il modello di Chameides ([5]), non possano essere considerati responsabili della diversa sensibilità all’ozono manifestata dai due cloni di pioppo in esame, Eridano ed I-214 ([22]).
Una volta penetrato all’interno della cavità sottostomatica, l’ozono si decompone rapidamente nella fase acquosa della matrice apoplastica dando origine ad una serie di specie reattive dell’ossigeno (ROS), quali l’anione radicale superossido (O2 -), il radicale idrossilico (OH-) ed il perossido di idrogeno H2 O2 ([13]). Il bersaglio primario dell’azione delle ROS è rappresentato dai lipidi e dalle proteine di membrana, con conseguente perdita della permeabilità selettiva, alterazione dell’integrità cellulare e possibile produzione di molecole messaggero ([35]).
Mentre un’esposizione di tipo cronico, cioè una prolungata esposizione a basse concentrazioni dell’inquinante, determina effetti molto simili a quelli provocati da una senescenza precoce, un’esposizione di tipo acuto, caratterizzata da alte concentrazioni dell’inquinante somministrate per brevi periodi, induce risposte d’ipersensibilità (HR) analoghe a quelle attivate in seguito all’attacco di fitopatogeni ([31]), tra cui la comparsa di lesioni necrotiche.
Al termine delle 5 ore di esposizione all’ozono tale sintomatologia era distintamente visibile solo nel clone Eridano sotto forma di lesioni puntiformi che, nell’arco delle 24 ore successive alla fine della fumigazione, subivano un progressivo ampliamento che culminava nella formazione di estese aree necrotiche (Fig. 1).
Fig. 1 - Lesioni fogliari indotte da in due cloni di pioppo con diversa suscettibilità all’O3, clone I-214, tollerante (di sopra), e clone Eridano, sensibile (di sotto); a sinistra i controlli, al centro le foglie dopo 5 ore di esposizione a 150 nl l-1 di O3, adestra dopo 24 ore.
La comparsa di sintomi visibili sulla superficie fogliare rappresenta la manifestazione macroscopica di una serie di eventi e modificazioni che si realizzano a livello cellulare e che si concludono con la morte della cellula stessa. A conferma della perdita dell’integrità di membrana, l’utilizzo del colorante vitale Evan’s blue, al quale le membrane cellulari risultano impermeabili, ha evidenziato ampie regioni caratterizzate dalla presenza di cellule blu nei dischetti prelevati dalle piante del clone Eridano trattate con O3, il cui numero aumentava in modo apprezzabile nelle 24 ore successive alla fine dell’esposizione. In analogia a quanto osservato a livello macroscopico, nei dischetti prelevati dalle foglie del clone I-214 non erano evidenti cellule danneggiate, ad eccezione della comparsa di alcune cellule colorate in blu durante il periodo di osservazione successivo alla fumigazione (Fig. 2).
Fig. 2 - Danno cellulare indotto da 5 ore di esposizione a 150 nl l-1 di O3 in due cloni di pioppo con diversa suscettibilità all’O3, clone I-214, tollerante, e clone Eridano, sensibile, stimato mediante la permeabilità delle plasmamembrane al colorante Evan’s blu.
Ozono e vie di trasduzione del segnale
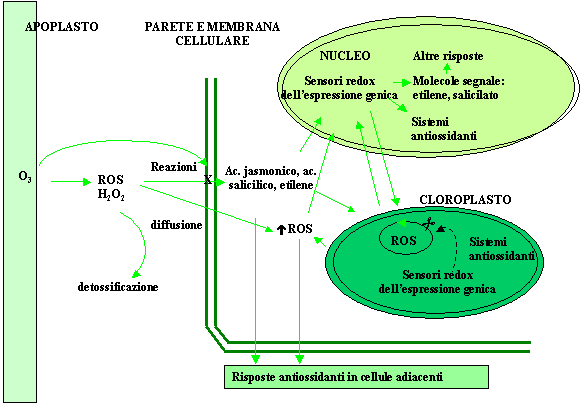
Recentemente, le somiglianze riscontrate tra le risposte indotte dall’ozono e la risposta ipersensibile osservata nell’interazione incompatibile pianta-patogeno hanno suggerito che l’ozono possa comportarsi alla stregua di un elicitore fungino. In quest’ottica gli effetti dell’ozono si esplicherebbero attraverso una cascata di eventi regolati dall’induzione di molecole segnale che medierebbero la stimolazione di risposte secondarie a livello genico, metabolico ed ormonale. Le ROS, in particolare l’H2O2, così come l’acido salicilico, l’acido jasmonico e l’etilene, entrambi prodotti precocemente in seguito all’esposizione all’inquinante, sembrano essere ottimi candidati nel mediare l’elicitazione degli effetti diversificati che costituiscono la reazione delle piante all’O3 (Fig. 3 - [32], [35], [37]).
Fig. 3 - Modello semplificativo del processo di trasduzione del segnale di stress rappresentato dall’ozono in cui si evidenzia il ruolo delle ROS, dell’etilene e dell’acido salicilico come molecole messaggero responsabili dell’induzione della risposta delle piante all’O3.
H2O2: il suo duplice ruolo
Durante l’ultimo decennio, l’H2O2 è stata oggetto di crescente attenzione a causa del suo duplice ruolo come molecola segnale e come composto tossico promotore di danni ossidativi a carico della struttura cellulare ([12], [35], [26]).
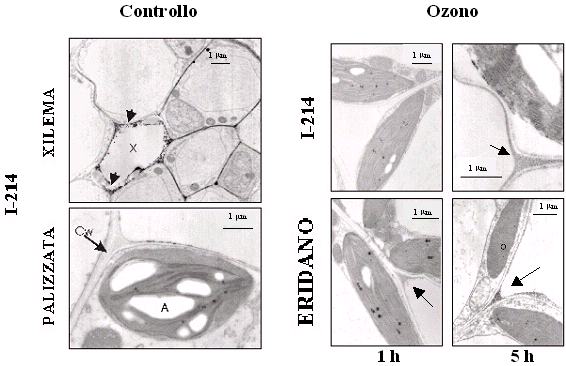
Nelle foglie del clone sensibile Eridano, la localizzazione citochimica dell’H2O2 mediante microscopia elettronica ha rivelato numerosi ed evidenti precipitati, localizzati prevalentemente nelle cellule del tessuto a palizzata in prossimità degli spazi intercellulari (Fig. 4). Nelle foglie del clone tollerante I-214, dopo 5 ore di esposizione all’inquinante, il numero e le dimensioni dei granuli elettrondensi risultavano decisamente inferiori rispetto a quelli rilevabili nei campioni del clone sensibile prelevati nello stesso momento (Fig. 4), a suggerire una capacità da parte del clone tollerante di mantenere livelli ottimali di H2O2, sufficienti ad assicurare la trasduzione del segnale ma non tanto elevati da indurre il danno ossidativo.
Fig. 4 - Localizzazione citochimica in situ dell’H2O2 presente nel tessuto fogliare (palizzata) di piante di pioppo di controllo (clone I-214) o trattate con 150 nl l-1 O3 per 1 e 5 ore. Nelle foglie di controllo l’accumulo di H2O2 era evidente solo nei tessuti vascolari dello xilema interessati da un attivo processo di lignificazione mentre nelle cellule del parenchima a palizzata non si osservava alcun precipitato indicativo della presenza di H2O2. La figura mostra le immagini di controllo relative al solo clone I-214 dal momento che il comportamento dei due cloni non differiva sostanzialmente. X = xilema; CW = parete cellulare; A = amido; P =plastidi.
L’accumulo di H2O2 a livello apoplastico in piante esposte ad O3 nonché una stretta connessione tra la produzione di questa ROS e la sensibilità all’inquinante sono ampiamente testimoniati in letteratura da studi condotti su numerose specie vegetali, tra cui betulla (Betula pendula - [18]) e pomodoro (Lycopersicon esculentum - [39]) ed alcuni genotipi di arabidopsis (Arabidopsis thaliana - [25])
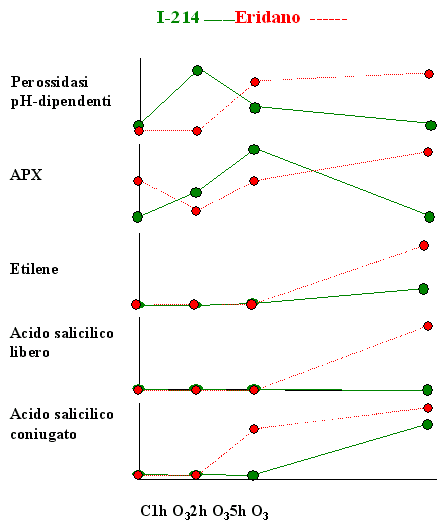
L’origine delle ROS conseguente alla presenza di O3 non è ancora stata completamente chiarita. In aggiunta alla decomposizione spontanea dell’O3 nell’apoplasto ([13]) e all’interazione dell’inquinante con molecole organiche contenenti legami C-C, quali gli acidi grassi della componente lipidica delle plasmamembrane o gli idrocarburi endogeni emessi dalle piante (etilene, isoprene, terpeni) ([30]), secondo le più recenti acquisizioni le ROS sarebbero attivamente generate da sistemi enzimatici quali il complesso NAD(P)H ossidasi legato al plasmalemma, in associazione con le superossido dismutasi, ed alcune isoforme perossidasiche extracellulari pH-dipendenti ([4], [3], [25], [33]). Dal momento che la capacità delle perossidasi di produrre H2O2 è massima in ambiente neutro o basico, la loro attività sarebbe favorita dalla temporanea alcalinizzazione dello spazio extracellulare conseguente all’ingresso dell’O3. Nei due cloni di pioppo esaminati, l’esposizione all’ozono induceva una risposta temporalmente differente relativamente alla produzione endogena di H2O2 da parte delle perossidasi pH-dipendenti. Infatti, mentre il clone resistente I-214 manifestava un precoce e transiente incremento di attività solo durante le prime 2 ore di esposizione all’O3, nel clone sensibile il trattamento con O3 stimolava tale attività solo a partire dalle 2 ore di fumigazione (Fig. 5). Una formazione precoce di H2O2, quale quella testimoniata dalla rapida attivazione delle perossidasi extracellulari, è tipica di specie o cultivar O3-resistenti. Nelle specie sensibili, invece, la produzione di ROS sembra continuare anche dopo la fine del trattamento, estendendosi all’interno della cellula e provocando, in ultima istanza, la comparsa di necrosi fogliari ([35], [18]). Sebbene il nostro disegno sperimentale non abbia previsto alcuna analisi nel periodo successivo alla fumigazione, la presenza, esclusivamente nel clone sensibile, di una elevata attività al termine delle 5 ore di esposizione all’O3 potrebbe far pensare ad una prolungata generazione di H2 O2, preludio del fenomeno di morte cellulare programmata ([14]).
Fig. 5 - Rappresentazione schematica dell’andamento temporale di alcune risposte indotte da 5 ore di esposizione a 150 nl l-1 di O3 in due cloni di pioppo con diversa suscettibilità all’O3, clone I-214, tollerante, e clone Eridano, sensibile.
Benché l’importanza dell’H2O2 nel ruolo di molecola segnale sia ampiamente riconosciuta, è opportuno ricordare che la sua concentrazione deve essere accuratamente tenuta sotto controllo da parte della cellula per evitare l’insorgenza di danni ossidativi. Dal momento che i livelli di H2O2 necessari ad indurre i geni di difesa risultano meno elevati di quelli richiesti per innescare la morte cellulare ([14]), la capacità di mantenere livelli di H2 O2 ottimali, ossia sufficienti ad assicurare la trasduzione del segnale ma non tanto elevati da indurre il danno ossidativo, risulta di fondamentale importanza per il destino della cellula vegetale. In questo contesto risulta essenziale la presenza di enzimi e metaboliti antiossidanti in grado di detossificare questa molecola.
L’ascorbico perossidasi (APX), in virtù della sua elevata affinità per l’H2O2 e della sua presenza in numerosi compartimenti cellulari, rappresenta uno dei sistemi più efficaci nella detossificazione delle ROS ([8]). L’importanza dell’APX nel processo di protezione della cellula contro livelli eccessivi di H2O2 è ampiamente testimoniata dall’aumento di attività dell’enzima riscontrato in risposta a vari tipi di stress ossidativo, tra cui l’esposizione all’ozono ([19], [24], [28], [20], [36], [23], [21]). In particolare, nella cv. di tabacco Bel-W3, O3-sensibile, è stato osservato un incremento dell’attività dell’APX inferiore rispetto a quello rilevato nella cv. tollerante Havana ([2]). A conferma di ciò è stato dimostrato che piante di tabacco transgeniche, caratterizzate sia da una riduzione dei livelli endogeni di APX mRNA che da una diminuzione dell’attività enzimatica, manifestano un’aumentata sensibilità nei confronti dell’O3 ([15]). In accordo a questi riscontri, ad ulteriore conferma della stretta correlazione esistente tra i meccanismi di detossificazione delle ROS e la sensibilità all’O3, nei due cloni di pioppo oggetto di studio si osservava una marcata e precoce stimolazione dell’attività dell’APX da parte dell’O3 nel clone resistente, mentre in quello sensibile l’incremento di attività, rilevabile peraltro solo al termine del trattamento, risultava inferiore rispetto a quello rilevato in I-214 ed era preceduto da una evidente diminuzione durante le prime 2 ore di esposizione (Fig. 5).
Etilene e acido salicilico
L’attiva produzione di ROS da parte della cellula vegetale, il cosiddetto “burst ossidativo”, sarebbe parte della complessa strategia di difesa attuata dalla pianta in risposta alla presenza di O3 che vede coinvolta l’H2O2 come molecola messaggero a breve distanza, in virtù della sua capacità di attraversare le membrane e diffondere alle cellule vicine e di reagire con componenti di membrana e di parete generando altri composti a loro volta capaci di agire come segnali intra o extracellulari ([26]). Tuttavia, dal momento che l’H2 O2 è rapidamente rimossa da enzimi e metaboliti antiossidanti è poco probabile che il solo incremento dei livelli di questa molecola possa essere sufficiente a regolare la complessa risposta all’ozono a livello dell’intera pianta. Analogamente a quanto descritto nel caso dell’infezione da patogeni, si ritiene che altre molecole messaggero quali etilene, acido salicilico e acido jasmonico siano necessarie alla pianta per innescare la risposta difensiva ([26]).
Una stretta correlazione tra l’emissione di etilene e la sensibilità all’O3, in termini di comparsa di lesioni fogliari, è stata evidenziata da più autori sia in specie erbacee che in piante arboree ([12], [38], [32]). In accordo con queste osservazioni, il clone sensibile Eridano, che manifestava sintomi visibili sulla superficie fogliare, esibiva una marcata emissione di etilene in seguito all’esposizione all’inquinante. Sebbene un incremento nella produzione di etilene sia stata osservata anche nel clone asintomatico I-214, la quantità di ormone emessa dal clone Eridano al termine del periodo sperimentale risultava ben 6 volte superiore rispetto a quella liberata dal clone I-214 (Fig. 5), confermando quanto riportato in letteratura sulla connessione esistente tra l’emissione di etilene e la sensibilità all’O3 ([12], [38], [32]). Anche in questo caso, come già suggerito per l’H2O2, i livelli della molecola sembrano essere fondamentali nel determinare il destino della cellula. Analogamente, concentrazioni ottimali di acido salicilico sono richieste per ottenere la massima induzione delle risposte difensive e per minimizzare l’influenza avversa dell’O3, senza attivare la morte cellulare programmata ([25], [27], [17]). Infatti, piante compromesse per l’accumulo di SA o con una ridotta capacità di percepire l’SA manifestano una debole stimolazione delle risposte difensive che può portare all’accumulo di metaboliti tossici e alla conseguente induzione del danno cellulare, mentre livelli elevati di SA potenziano il circolo di amplificazione a feed-back responsabile della produzione di un eccesso di ROS ed innescano un ciclo di morte cellulare programmata ([25]). Nei due cloni di pioppo in esame, il clone sensibile Eridano mostrava il maggiore incremento nei livelli di acido salicilico sia libero che coniugato (Fig. 5) in seguito al trattamento di O3, suggerendo l’ipotesi che in questo clone l’accumulo di elevate quantità di SA, potenziando la produzione di ROS, possa attivare una risposta ipersensibile che determina la morte cellulare.
Alla luce dell’insieme dei risultati ottenuti è possibile ipotizzare che la maggior sensibilità all’O3 manifestata dal clone Eridano in termini di sintomatologia fogliare sia imputabile al consistente incremento del contenuto di molecole che partecipano alla catena di trasduzione del segnale di stress. Il danno che la pianta subisce sarebbe quindi la conseguenza di un’esplosione abnorme, non più controllata, di vie metaboliche normalmente indirizzate verso la difesa, ma che potenziate in modo esagerato e persistendo probabilmente ben oltre la fine dell’esposizione all’O3, porterebbero alla morte della cellula. Come già accennato, non si deve infatti dimenticare che la risposta all’O3 è un evento altamente regolato che dipende dall’interazione di numerose molecole coinvolte in una molteplicità di vie di segnalazione che comunicano tra di loro in maniera assai complessa, determinando effetti sinergici o antagonisti in funzione non soltanto del tipo di molecole coinvolte ma anche della loro concentrazione e del momento della loro produzione ([16], [26]).
Prospettive aperte
Tra i molteplici interrogativi tuttora irrisolti rimane ancora da chiarire se, nonostante la diversa tipologia di effetti determinati da esposizioni all’inquinante di tipo acuto e di tipo cronico, i meccanismi che determinano la risposta della pianta ad un’esposizione prolungata all’O3 siano sostanzialmente analoghi a quelli descritti sopra. È inoltre utile ribadire come la definizione dell’esatto ruolo giocato dall’ozono nel deperimento forestale necessiti di un approccio interdisciplinare, che preveda indagini a livelli gerarchici crescenti (dalla cellula alla foresta), affinché i risultati ottenuti in condizioni controllate possano essere convalidati da studi svolti a livello di ecosistema naturale, dove molteplici fattori di stress si sommano agli effetti dell’O3 nel determinare lo stato di sofferenza delle foreste.
References
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar