The Pine Processionary moth in the pinewoods of Calabrian Apennines, Italy
Forest@ - Journal of Silviculture and Forest Ecology, Volume 2, Pages 345-357 (2005)
doi: https://doi.org/10.3832/efor0315-0020345
Published: Dec 19, 2005 - Copyright © 2005 SISEF
Research Articles
Abstract
The results of a study carried out on the Pine Processionary moth [Traumatocampa (=Thaumetopoea) pityocampa (Denis & Schiffermüller)] in Calabria (Italy) during 1997-98 are reported. The preliminary aim of this investigation was to assess the presence of the lepidopteran in the main pinewoods of the Calabrian Apennine ridge. The research started with a census, conducted in 1997, of the areas where the Processionary moth was present; in the second year (1998) male flight dynamics were monitored using pheromone traps in 26 selected sites. Besides, during the first year the infestation levels were measured, recording the percentage of infested plants as well as the number of nests on 10 infested trees randomly chosen. The correlation coefficient of the above-mentioned parameters was measured in order to be able to optimize the monitoring system. The data collected confirmed that the Pine Processionary caterpillars adapt their own biology and ethology to the different altitudes and to the various climatic conditions of the Calabrian pinewoods. Pure pinewoods were more infested than the mixed ones, besides artificial woods were more susceptible to the attacks of the moth than the natural ones. The parameters that were measured (% of infested plants and number of winter nests per plant) were positively and significantly correlated. Male captures were higher at elevations ranging from 0 to 400 m and peaked in August up to 800 m and at the beginning of July between 800 and 1400 m. Statistical analysis showed that the number of nests per plant is not significantly related to the number of male captures during the following season.
Keywords
Traumatocampa pityocampa, Southern Italy, Males flight dynamics, Winter nests, Altitude
Introduzione
Il lepidottero notodontide Traumatocampa (=Thaumetopoea) pityocampa (Denis & Schiffermüller) (Fig. 1) comunemente noto come "Processionaria dei pini" è sicuramente il fitofago chiave nella gestione delle pinete vegetanti nell’areale Mediterraneo.
È un defogliatore tipicamente legato a diverse specie del genere Pinus, e in presenza di formazioni miste dello stesso, l’attività defogliatrice risulta più marcata ([16]). Ospiti occasionali del lepidottero possono essere: Cedrus spp., Picea abies L. e Pseudotsuga menziesii (Mirbel) ([1]). Nelle regioni meridionali italiane, i maggiori danni, in rapporto ai luoghi e alle condizioni di vegetazione, sono segnalati su Pinus pinaster Aiton nei popolamenti naturali dell’isola di Pantelleria e nelle formazioni degradate lungo il litorale ionico, nonché in comprensori dell’Etna a quota 2000 m su Pinus laricio Poiret, dove la specie è stata utilizzata per i rimboschimenti ([10]). Infine, si segnalano intense pullulazioni del defogliatore a carico delle pinete naturali di P. halepensis in Puglia ([3]).
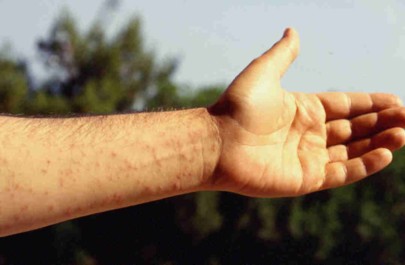
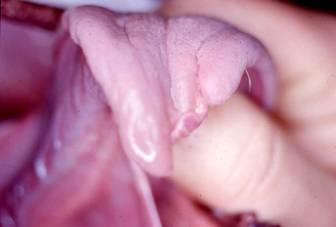
Le ricorrenti pullulazioni causano estese defogliazioni in ambienti forestali e urbani (Fig. 2); inoltre la presenza sulle larve di peli urticanti rende di difficile fruizione, alle persone e agli animali, i biotopi interessati dalle infestazioni; all’interno dei peli, infatti, si trova una proteina (thaumetopoeina) che causa dermatiti (Fig. 3) e alterazioni delle congiuntive e delle mucose (Fig. 4), con possibili complicanze a livello respiratorio ([5], [8]).
Fig. 4 - Necrosi e conseguente deformazione provocata da peli larvali di T. pityocampa su lingua di cane.
Le ricorrenti pullulazioni del defogliatore, possono incidere per il 60% sul ridotto sviluppo in altezza del pino laricio, mentre i mancati accrescimenti in diametro sono stati valutati nell’ordine del 20-45%. L’effetto della defogliazione sull’accrescimento si manifesta nell’anno successivo a quello in cui si conclude l’attacco ([9]).
L’esizialità degli attacchi di questo defogliatore, in Italia, ne ha reso indispensabile la lotta, divenuta obbligatoria già dal 1926 con due successivi Decreti Ministeriali (D.M. del 20-05-1926 e D.M. del 12-02-1938) a cui ha fatto seguito il D.M. del 17/04/1998 recante ’disposizioni sulla lotta obbligatoria alla processionaria del pino’.
Le strategie di lotta, finalizzate al controllo del lepidottero, richiedono una profonda conoscenza della bio-etologia del fitofago e delle sue interrelazioni con l’ecosistema di cui è parte integrante. In Calabria la presenza endemica del defogliatore è stata evidenziata, nell’ultimo decennio, da imponenti pullulazioni che hanno reso difficoltoso l’accesso ad aree che in molti casi risultavano prossime a parchi suburbani e urbani o a centri abitati.
Visto l’esiguo numero di notizie riguardanti la presenza e il ruolo del notodontide all’interno delle vaste aree calabresi occupate da popolamenti di pini, il presente lavoro si propone di fornire un quadro preliminare della situazione, che possa divenire un punto di partenza per la definizione degli opportuni strumenti di gestione degli ambienti boscati della Calabria. A tal fine, di concerto con l’Osservatorio Regionale per le Malattie delle Piante e con il supporto degli Ispettorati Ripartimentali delle Foreste, nel 1997-98 è stata condotta un’indagine nelle pinete calabresi più rappresentative.
Materiali e metodi
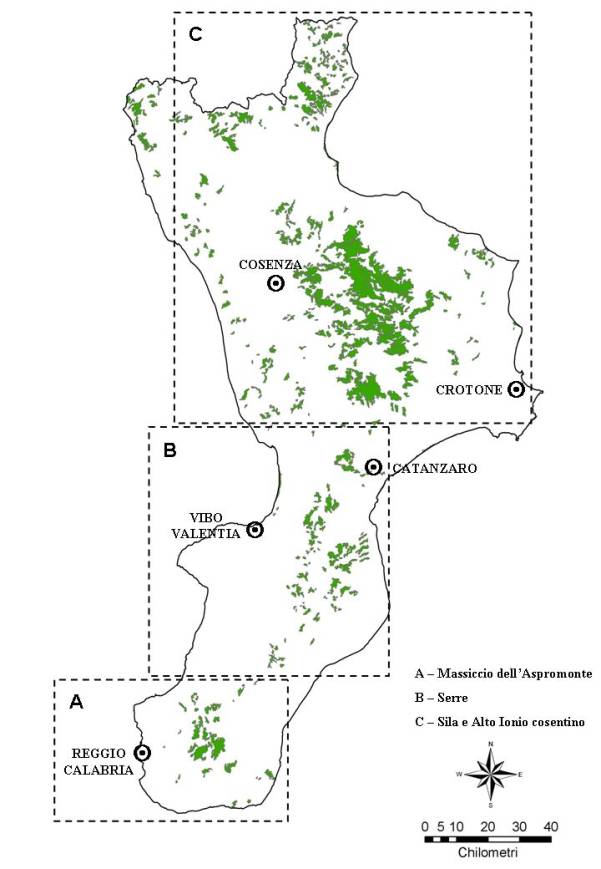
Il lavoro è stato condotto in Calabria nel biennio 1997-98 ed è stato articolato nelle due indagini di seguito descritte. I comprensori monitorati, per facilitarne la localizzazione, sono stati divisi in 3 macroaree, denominate ’Massiccio dell’Aspromonte’, ’Serre’ e ’Sila e Alto Ionio cosentino’ e corrispondenti rispettivamente ai settori meridionale, centro-meridionale e centro-settentrionale del territorio calabro (Fig. 5).
Fig. 5 - Distribuzione delle pinete (in verde) e localizzazione delle 3 ’Macroaree’ monitorate. Superficie totale delle pinete: 122714 ha (Fonte: Progetto CORINE ’ LAND COVER).
Censimento delle pinete interessate dall’infestazione
A partire dal mese di Ottobre del primo anno (1997) è stato effettuato un censimento delle pinete interessate dalle pullulazioni del lepidottero (Tab. 1), studio ritenuto propedeutico per eventuali successivi interventi di monitoraggio e di lotta al defogliatore. I rilievi di campo sono stati supportati dai Distaccamenti Forestali operanti nei comprensori montani oggetto d’indagine. Le osservazioni condotte sono state finalizzate alla delimitazione topografica delle aree interessate ricadenti nei singoli territori di competenza e sono consistite nella valutazione dell’estensione in ettari, delle specie forestali colpite, nonché dell’entità degli attacchi registrando la percentuale di piante infestate (presenza/assenza su 100 piante scelte a caso) e il numero di nidi rilevabili (Fig. 6) su 10 piante infestate scelte a caso. Per limitare l’influenza ’dell’effetto bordo’ nella valutazione della percentuale di piante infestate, il 50% delle piante veniva scelto lungo il margine della pineta e il rimanente 50% all’interno, percorrendola, ove possibile, in diagonale sulla linea di pendenza.
Tab. 1 - Estensione e tipologia delle pinete calabresi monitorate per la valutazione dell’infestazione di T. pityocampa.
| Specie | Zona | Prov. | Quota (m) |
Superficie (ha) | Tipo di popolamento |
|---|---|---|---|---|---|
| Boschi Puri (10212.7 ha) | |||||
| P. halepensis | Alto Ionio cosentino | CS | 0 - 820 | 5774 | 4730 ha - naturale |
| 1044 ha - artificiale | |||||
| P. laricio | Alto Ionio cosentino | CS | 650-1250 | 1299.7 | 52 ha- naturale |
| 1222.7 ha - artificiale | |||||
| 25 ha - naturale/artificiale | |||||
| Aspromonte | RC | 700-1600 | 1481 | 15 ha - naturale | |
| 1246 ha - artificiale | |||||
| 220 ha - artificiale/naturale | |||||
| Serre | VV | 600-1350 | 1012 | 1012 ha - artificiale | |
| P. pinea | Alto Ionio cosentino | CS | 280-470 | 535 | 100 ha - naturale |
| 435 ha - artificiale | |||||
| P. uncinata | Alto Ionio cosentino | CS | 450-460 | 41 | artificiale |
| P. radiata | Aspromonte | RC | 900 | 70 | artificiale |
| Boschi Misti (635.7 ha) | |||||
| P. laricio / P. radiata | Sila-Versante Nord | CS | 350 | 8 | artificiale |
| Serre | VV | 650-750 | 203 | artificiale | |
| P. laricio / P. pinaster | Serre | VV | 730 | 40 | artificiale |
| Aspromonte | RC | 880-1400 | 48 | artificiale | |
| P. laricio / P. sylvestris | Serre | VV | 980 | 6 | artificiale |
| P. halepensis / P. pinaster | Aspromonte | RC | 450 | 60 | artificiale |
| P. halepensis / P. laricio | Alto Ionio cosentino | CS | 450-950 | 169 | naturale /artificiale |
| P. halepensis / P. pinea | Alto Ionio cosentino | CS | 0-790 | 13 | artificiale |
| P. radiata / P. pinaster | Aspromonte | RC | 50-100 | 57.7 | artificiale |
| P. halepensis / P. pinea / P. radiata | Alto Ionio cosentino | CS | 110 | 31 | naturale /artificiale |
Fig. 6 - Nido definitivo invernale di T. pityocampa su Pinus laricio, come si presenta a inizio primavera.
Monitoraggio dell’infestazione mediante trappole a feromoni
Nel secondo anno (1998), al fine di acquisire dati preliminari relativi ai parametri bio-etologici della specie e alla luce delle osservazioni svolte nel precedente anno, sono state individuate su tutto il territorio calabrese con popolamenti di Pinus 26 stazioni di monitoraggio (Tab. 2). I siti sono stati opportunamente individuati all’interno di fasce altimetriche diverse in modo da valutare l’eventuale influenza di tale parametro sulla dinamica di popolazione del lepidottero.
Tab. 2 - Elenco delle stazioni di monitoraggio attivate durante il 1998 nelle diverse province calabresi.
| Stazione | Località (Comune - Provincia) |
Zona | Quota (m s.l.m.) |
Specie |
|---|---|---|---|---|
| 1 | Marina di Montegiordano (Montegiordano, CS) | Alto Ionio Cosentino | 900 | P. halepensis |
| 2 | Timpone Golla (Amendolara, CS) | Alto Ionio Cosentino | 200 | P. halepensis |
| 3 | Scalascio-Costa Madonna (Albidona, CS) | Alto Ionio Cosentino | 250 | P. halepensis |
| 4 | Sellata di Broglio (Trebisacce, CS) | Alto Ionio Cosentino | 500 | P. pinea |
| 5 | Masseria Gagliardi (Villapiana, CS) | Alto Ionio Cosentino | 65 | P. halepensis |
| 6 | Scilligria (Savelli, KR) | Sila | 950 | P. laricio |
| 7 | Stragola (Castelsilano, KR) | Sila | 900 | P. laricio |
| 8 | Difisella (Cotronei, KR) | Sila | 1100 | P. laricio |
| 9 | Colle Poltiglia (Petilia Policastro, KR) | Sila | 950 | P. laricio |
| 10 | Colle d’Arena (Mesoraca, KR) | Sila | 1350 | P. laricio |
| 11 | S. Caterina (Sorbo S. Basile, CZ) | Sila | 1200 | P. laricio |
| 12 | Monte Covello (Girifalco, CZ) | Serre | 800 | P. laricio |
| 13 | Piccarello (Cenadi, CZ) | Serre | 800 | P. laricio |
| 14 | Serra Pizzuti-Serra Pecorai (Davoli - S. Sostene, CZ) | Serre | 1050 | P. laricio |
| 15 | Croce Pelusa (Cardinale, CZ) | Serre | 950 | P. laricio |
| 16 | Faggio Grande (S. Caterina dello Jonio, CZ) | Serre | 800 | P. laricio |
| 17 | Gatta Scorciata (Capistrano, VV) | Serre | 1070 | P. laricio /P. pinea |
| 18 | Gatta Scorciata (Nardodipace, VV) | Serre | 1110 | P. laricio /P. pinea |
| 19 | Zu Peppi (Nardodipace, VV) | Serre | 890 | P. laricio |
| 20 | Spicchiali (Nardodipace, VV) | Serre | 550 | P. laricio |
| 21 | S. Elia (Palmi, RC) | Aspromonte | 300 | P. halepensis |
| 22 | Fondò/Vinciguerra (Sinopoli, RC) | Aspromonte | 900 | P. radiata |
| 23 | Petrulli (S. Eufemia Aspromonte, RC) | Aspromonte | 1150 | P. laricio |
| 24 | Baraccone Bruciato (S. Roberto, RC) | Aspromonte | 950 | P. laricio |
| 25 | Donna (Cardeto, RC) | Aspromonte | 1000 | P. laricio |
| 26 | Croce Romeo (Cardeto, RC) | Aspromonte | 1400 | P. laricio |
Nell’ambito delle pinete ricadenti all’interno del territorio della provincia di Cosenza, sono stati individuati cinque siti concentrati nella zona dell’Alto Ionio ai confini con la Basilicata (Macroarea C), a quote comprese tra 65 e 900 m. Nel crotonese, nel catanzarese e in provincia di Vibo Valentia le 15 zone prescelte risultavano collocate tra 550 e 1350 m lungo i versanti ionici delle Serre (Macroarea B) e della Sila (Macroarea C). In provincia di Reggio Calabria, sono state selezionate sei stazioni poste tra 300 e 1400 m e distribuite su tutti i versanti del massiccio aspromontano (Macroarea A).
Il monitoraggio condotto nelle 26 stazioni attivate ha riguardato essenzialmente la dinamica dei voli di maschi adulti di T. pityocampa e a tal fine, in ciascuna area sono state posizionate quattro trappole del tipo "Super Green" (prodotte da Serbios, s.r.l. - Fig. 7) innescate con 1 mg di (Z)-13-esadecen-11-in-1-il acetato, componente principale del feromone sessuale del lepidottero, disposte a una distanza di 50 m una dall’altra in modo da formare un ipotetico quadrato. Tutte le trappole sono state collocate su piante ben esposte, a un’altezza di 2-3 m.
Fig. 7 - Trappola a feromoni del tipo ’Super green’utilizzata per la cattura di maschi adulti di T. pityocampa.
L’attivazione delle trappole è avvenuta all’inizio del mese di giugno; le stesse sono state mantenute in campo fino a novembre quando, esauritisi i voli, non venivano registrate più catture.
Durante tutto il periodo d’indagine, il controllo delle catture è stato effettuato con cadenza decadale. Al fine di mantenere attive le trappole per l’intero periodo dei voli, i "dispenser" del feromone venivano sostituiti ogni trenta giorni.
Analisi dei dati
I dati relativi alle due variabili quantitative congiuntamente rilevate nel corso del censimento effettuato nel 1997, e cioè la percentuale di piante attaccate dal defogliatore e il numero di nidi presenti su 10 piante infestate, sono stati sottoposti ad analisi della correlazione. È stato calcolato il coefficiente di correlazione lineare di Pearson (r) per misurare il grado in cui le due variabili risultano linearmente relazionate. La significatività di tale coefficiente è stata verificata mediante test t di Student.
I dati raccolti durante l’attività di monitoraggio dei voli dei maschi mediante trappole a feromone, sono stati confrontati dividendoli in 4 classi di quota e osservandone l’andamento nel corso dell’anno. Al fine di verificare l’influenza dell’altitudine del sito nonché della specie di Pinus presente sull’entità di popolazione del notodontide, il numero totale delle catture è stato sottoposto ad analisi della regressione, utilizzando la quota come variabile indipendente.
Infine, è stato calcolato l’indice di correlazione tra l’entità delle catture ottenute nel corso del 1998 e il numero di nidi rilevato alla fine dell’anno precedente. A tal fine sono stati confrontati i dati raccolti in stazioni rappresentative delle 4 fasce fitoclimatiche considerate. Per ciascuna classe di quota è stata individuata una stazione di riferimento, mentre relativamente alla fascia fitoclimatica del Castanetum si è ritenuto opportuno prendere in considerazione i dati relativi a due diverse stazioni. La prima è stata scelta in quanto caratterizzata da una formazione naturale di Pino laricio che di norma tende a vegetare fuori dalla propria fascia climatica (Fagetum) a causa della carenza di conifere autoctone; la seconda in quanto costituita da un popolamento di Pinus radiata, specie esotica proveniente dalla costa occidentale del Nord-America utilizzata nei nostri ambienti allo scopo di far fronte alla suddetta carenza.
L’analisi statistica è stata realizzata utilizzando il software STATISTICA 6.0 ([15]).
Risultati e discussione
Censimento delle pinete interessate dall’infestazione
Tra i boschi di Pinus individuati sono stati distinti quelli puri da quelli misti, valutando parallelamente se di origine naturale o artificiale (Tab. 2). Le indagini effettuate hanno evidenziato come i popolamenti puri risultino maggiormente colpiti dal defogliatore rispetto a quelli misti e complessivamente come le pinete di Pino laricio di origine artificiale si dimostrino più suscettibili all’attacco rispetto ai soprassuoli naturali. È stata censita una superficie a Pinus complessiva di 10848.4 ha, di cui solo il 6.2% era costituito da boschi misti; le pinete maggiormente colpite sono risultate le formazioni pure e preferibilmente di origine artificiale di Pino laricio (3792.7 ha) e i boschi naturali di Pino d’Aleppo dell’Alto Ionio cosentino (5774 ha); mentre, per quanto concerne le formazioni miste, la consociazione tra Pino laricio e Pino insigne (283 ha) è stata quella maggiormente interessata dagli attacchi.
Di seguito vengono riportati i dati sulle superfici interessate e sull’entità degli attacchi in ognuna delle tre macroaree indagate:
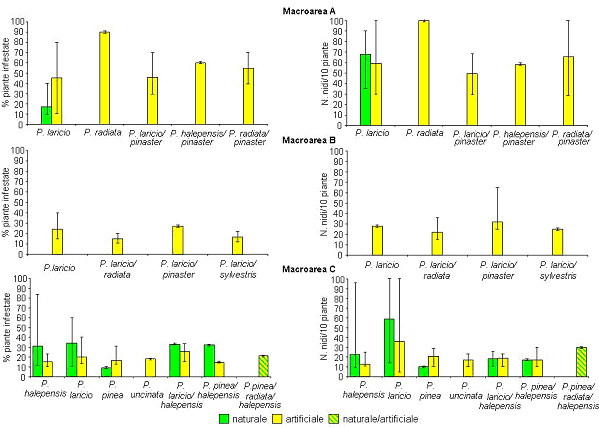
A - Massiccio dell’Aspromonte ’ Sono stati monitorati 1716.7 ha di pinete costituite prevalentemente da popolamenti artificiali di Pino laricio ubicati all’interno del comprensorio aspromontano. L’entità dell’infestazione non è risultata omogenea anche se è stato possibile rilevare un nucleo di pinete, tutte di estensione inferiore ai 100 ha, con percentuali di piante infestate superiore al 75%, localizzate lungo il versante tirrenico dell’Aspromonte tra i comuni di S. Roberto, S. Eufemia d’Aspromonte e Sinopoli. Il numero di nidi/pianta del defogliatore è risultato complessivamente alto (mai inferiore a 25 sulle 10 piante osservate) con tre zone che presentavano una densità superiore ai 100 nidi individuabili lungo i versanti ovest e sud dell’Aspromonte e in corrispondenza dei primi contrafforti delle Serre. Le formazioni naturali di Pino laricio hanno fatto registrare percentuali di piante infestate (16.86%) inferiori rispetto ai valori delle omologhe pinete artificiali (45.33%), mentre il numero di nidi su 10 piante infestate è risultato lievemente più elevato nel primo caso (67.86) rispetto ai popolamenti artificiali (58.98 - Fig. 8). I boschi misti erano tutti di origine artificiale e principalmente costituiti da P. pinaster alternativamente associato a P. laricio, P. radiata o P. halepensis. La percentuale media di piante infestate è risultata più alta in quest’ultimo caso (60%; numero di nidi/10 piante: 58) mentre livelli d’infestazione inferiori si sono avuti con P. radiata (55%; numero di nidi/10 piante: 65.40) e P. laricio (46%; numero di nidi/10 piante: 49.40 - Fig. 8).
Fig. 8 - Livelli medi d’infestazione (percentuale di piante infestate e numero di nidi / 10 piante) nelle 3 Macroaree indagate, distinti per specie attaccata, origine e tipologia del popolamento. Le barre indicano l’intervallo tra i valori minimi e massimi registrati.
B - Serre ’ La superficie a Pinus monitorata, pari a 1261 ha, era costituita prevalentemente da Pino laricio in formazioni pure di origine artificiale localizzate tra i 600 e 1350 m. La percentuale media di piante interessate dall’attacco è risultata pari a 24.39% con una media di 27.88 nidi/10 piante (Fig. 8). Nei boschi misti i livelli medi più alti di infestazione e il numero medio di nidi più elevato sono stati registrati nelle formazioni di P. laricio associato a P. pinaster (27% e 32). Nelle formazioni composte da P. laricio e P. sylvestris tali valori medi sono risultati pari a 17% e 25, per scendere a 15% e 22 nel caso di P. laricio associato a P. radiata (Fig. 8).
C - Sila e Alto Ionio cosentino ’ La presenza del lepidottero defogliatore è stata osservata su 7870.7 ha di pinete ubicate principalmente nell’Alto Ionio cosentino e costituite prevalentemente da formazioni pure e naturali di Pino d’Aleppo e Pino domestico e da soprassuoli artificiali di Pino laricio. Sia la percentuale di infestazione che la densità sono apparse modeste, fatta eccezione per alcune località della Sila (San Giovanni in Fiore, Panettieri e Campana) e dell’Alto Ionio (Oriolo e Amendolara) in cui la prima ha interessato più del 75% del popolamento e la seconda è risultata di poco superiore a 100 nidi su 10 piante.
I boschi di P. laricio hanno fatto complessivamente registrare i valori medi più elevati relativi alla percentuale di piante infestate nonché al numero di nidi su 10 piante infestate. Nel caso di formazioni naturali questi valori sono stati rispettivamente 34% e 59, mentre in boschi artificiali la percentuale di piante infestate è stata del 20.10% con un numero medio di nidi/10 piante pari a 36.05 (Fig. 8). Le formazioni miste erano rappresentate principalmente da P. halepensis insieme a P. laricio o P. pinea. Nel caso di boschi naturali la percentuale di piante interessate dagli attacchi del defogliatore e il numero di nidi erano rispettivamente 33% e 18 per l’associazione P. halepensis - P. laricio e 32% e 17 nell’altro caso. Le medesime associazioni di origine artificiale hanno fatto registrare 25.67% di piante infestate con 19.25 nidi/10 piante e 15% di piante infestate con 16.67 nidi/10 piante (Fig. 8).
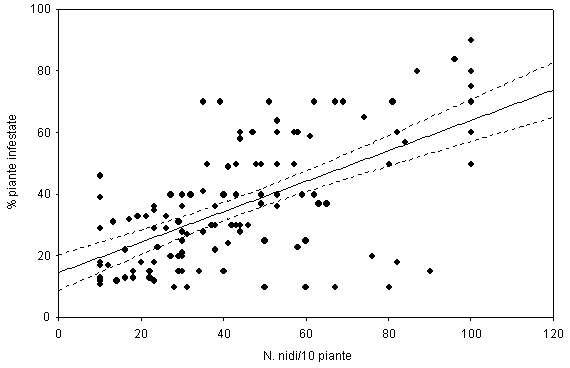
L’analisi statistica ha messo in evidenza che le due variabili misurate (% di piante infestate e numero di nidi/pianta conteggiati su 10 piante infestate) sono tra loro significativamente correlate (r = 0.62; p<0.05) e in particolare all’aumentare di un parametro, il secondo cresce proporzionalmente (% piante infestate= 14.557 + 0.49332 - N° nidi, r2 = 0.387; p<0.01 - Fig. 9).
Fig. 9 - Relazione tra la percentuale di piante infestate e il numero di nidi rilevati su 10 piante. Retta di regressione lineare con intervallo di confidenza al 95%.
Monitoraggio dell’infestazione mediante trappole a feromoni
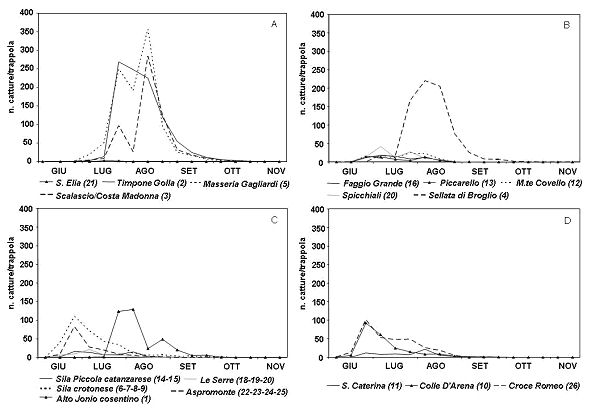
Durante il periodo d’indagine, nelle pinete ubicate tra 0 e 400 m, la comparsa dei primi adulti del notodontide si è verificata tra la fine del mese di giugno e l’inizio di luglio (Fig. 10a). In tutte le stazioni costiere dell’Alto Ionio cosentino è stato rilevato il picco di catture principale (268 ÷ 356 adulti per trappola) tra la prima e l’ultima decade di agosto. I voli degli adulti, in tale comprensorio, si sono esauriti nella prima decade di ottobre. Lungo il versante tirrenico della provincia di Reggio Calabria in C.da ’S. Elia’ le catture sono state sporadiche durante l’intero periodo di monitoraggio. Nei comprensori ubicati a quote tra 400 e 800 m (Fig. 10b), la cattura dei primi maschi della Processionaria si è verificata tra la seconda e la terza decade di giugno. L’esiguo numero di catture registrate in parte delle stazioni monitorate fa presupporre in tali siti un sostanziale andamento demografico di latenza della popolazione del defogliatore. A questa quota ha fatto eccezione la stazione di ’Sellata di Broglio’, ricadente all’interno del comprensorio dell’Alto Ionio cosentino, dove è stato registrato un unico picco di notevole entità verificatosi durante la seconda decade di agosto in perfetta sincronia con quanto rilevato per le stazioni dello stesso comprensorio poste tra 0 e 400 m. Presso la stessa stazione i voli si sono conclusi alla fine di ottobre mentre in tutte le altre località non sono state registrate catture a partire dall’ultima decade di settembre.
Fig. 10 - Andamento delle catture di maschi adulti di T. pityocampa in Calabria a quote: (A) comprese tra 0 e 400 m; (B) comprese tra 400 e 800 m; (C) comprese tra 800 e 1200 m; (D) oltre i 1200 m.
Visto il gran numero di stazioni attivate ad altitudini comprese tra 800 e 1200 m, queste sono state accorpate per aree geografiche in modo da ottenere un andamento medio delle catture per ognuno dei comprensori considerati (Fig. 10c). Le catture hanno avuto inizio alla fine di giugno e si sono concluse durante la seconda decade di settembre in tutti i comprensori monitorati, anche a questa quota ha fatto eccezione l’Alto Ionio cosentino dove l’intero periodo dei voli è risultato ritardato di circa un mese. Solo nei comprensori dell’Aspromonte, della Sila crotonese e dell’Alto Ionio cosentino è stato possibile osservare un picco di rilevante entità (83 ÷ 129 adulti/trappola) verificatosi ad inizio luglio, nei primi due comprensori, e tra la prima e la seconda decade di agosto nel terzo sito.
Nell’ultima fascia altimetrica considerata, comprendente le zone di indagine ubicate oltre i 1200 m, le prime catture si sono verificate tra la seconda e l’ultima decade di giugno (Fig. 10d). Presso le stazioni di C.da "Colle D’Arena" (Sila) e di C.da "Croce Romeo" (Massiccio dell’Aspromonte) si è registrato, agli inizi di luglio, un picco di rilevante entità (92 ÷ 101 adulti/trappola). I voli si sono conclusi, contemporaneamente in tutte le stazioni tra la fine di agosto e l’inizio di settembre, con leggero anticipo, dovuto alla notevole altitudine, rispetto alle altre fasce altimetriche considerate.
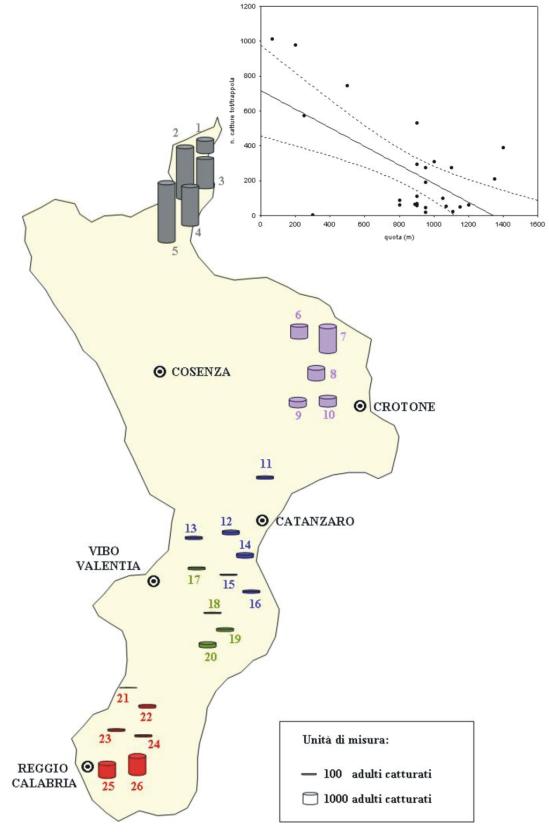
Le catture totali rilevate nelle singole stazioni attivate hanno trovato corrispondenza con le dinamiche delle catture dei maschi. I valori più elevati sono stati registrati nelle stazioni ubicate, a diverse quote, all’interno del comprensorio dell’Alto Ionio cosentino e in particolare presso la stazione n. 5 situata in C.da ’Masseria Gagliardi’ in comune di Villapiana dove sono stati catturati più di 4000 individui (Fig. 11). Per quanto riguarda gli altri comprensori calabresi indagati, solo in corrispondenza della stazione n. 7 situata in C.da ’Stragola’ nel comune di Castelsilano (Sila) e presso C.da ’Donna’ (stazione n. 25) nel comune di Cardeto (Massiccio dell’Aspromonte) si sono registrate catture totali di notevole rilievo. Le stazioni ove il numero totale di catture è stato più elevato sono state anche quelle in cui le curve descritte dall’andamento delle catture mostrano solo 1 o 2 picchi concentrati in un arco temporale abbastanza ristretto; differente è invece risultato l’andamento in quei comprensori dove non sono state registrate catture totali elevate e le curve sono state caratterizzate da più picchi di modesta entità distribuiti su tutto il periodo dei voli.
Fig. 11 - Catture totali di maschi adulti di T. pityocampa e ubicazione delle 26 stazioni di rilevamento attivate in Calabria durante il 1998 e relazione tra quota (m) e numero di catture totali per trappola (in alto a destra). Retta di regressione lineare con intervallo di confidenza al 95%.
L’analisi della regressione, effettuata considerando l’entità totale delle catture come variabile dipendente e la quota come variabile descrittiva, ha permesso di mettere in evidenza che il numero delle catture totali per trappola è significativamente dipendente dall’altitudine e in particolare diminuisce all’aumentare di quest’ultima (y = 715.75 - 0.533x; r2 = 0.39; r = -0.62; p<0.0006 - Fig. 11).
L’analisi della correlazione effettuata sul numero di nidi per pianta conteggiati nel corso del primo anno di sperimentazione e l’entità totale delle catture per trappola registrata nei medesimi siti l’anno successivo ha mostrato che i due parametri non sono significativamente correlati (r = 0.65; p = 0.24), confermando quanto già riportato in letteratura ([17], [2]).
Considerazioni conclusive
Gli elementi acquisiti hanno confermato la plasticità del defogliatore che adatta il proprio ciclo biologico alle differenti condizioni climatiche della dorsale appenninica calabrese. La maggiore suscettibilità osservata sui popolamenti puri e artificiali può essere ricondotta all’eterogeneità dei popolamenti e ai naturali meccanismi di difesa che questi mettono in atto. In particolare le percentuali più elevate di piante infestate sono state registrate su formazioni pure di origine artificiale di P. laricio, confermando quanto già noto in letteratura ([7], [2]). Da sottolineare inoltre la notevole infestazione rilevata a carico di P. radiata in formazione pura di origine artificiale. Tale dato risulta anch’esso in linea con quanto riportato in letteratura circa le preferenze di T. pityocampa per le piante ospiti, nell’ambito di queste infatti la suddetta specie di pino sembra essere particolarmente appetita per le caratteristiche chimiche degli aghi ([14]).
La correlazione positiva rilevata tra la percentuale di piante infestate e il numero di nidi per pianta può risultare un utile strumento di supporto alle attività di monitoraggio.
Le catture dei maschi sono risultate più ingenti nei siti a quote comprese tra 0 e 400 m, come confermato dall’analisi della regressione che ha messo in evidenza una relazione significativa e inversa tra numero di catture per trappola e quota. Il picco principale di catture è stato registrato nel mese di agosto nei compresori fino a 800 m e all’inizio di luglio tra 800 e 1400 m. Tale dato conferma quanto già noto in letteratura circa la precocità delle popolazioni del defogliatore in corrispondenza dell’aumento della quota altimetrica o dello spostamento a nord della latitudine ([4], [7]).
Non è stata messa in evidenza correlazione significativa tra il numero di nidi per pianta nel primo anno e l’entità delle catture per trappola registrata nell’anno successivo. La non correlabilità delle variabili, già evidenziata in precedenti studi, può essere ricondotta anche ai ben noti fenomeni di diapausa del defogliatore allo stadio di crisalide, di durata variabile, che possono fare slittare gli sfarfallamenti degli adulti di uno o più anni rispetto al momento di rilevamento dei nidi ([12], [2]).
Benché riferiti a un breve intervallo temporale, i dati raccolti possono essere considerati un punto di partenza per tracciare un quadro dell’andamento demografico della specie nei differenti biotopi oltre ad aver consentito di constatare sfasamenti delle curve di volo e delle fasi fenologiche alle diverse quote, sulla cui conoscenza si basa di norma la definizione dei programmi d’intervento.
In tale contesto va altresì considerato che la vulnerabilità dei popolamenti forestali nei confronti di questo fitofago, così come dei Lepidotteri defogliatori in generale, può dipendere dal verificarsi di eventi climatici straordinari (come siccità prolungate) o da alcuni interventi selvicolturali inappropriati ([6]); il ripristino delle canoniche procedure di governo del bosco indirizzate al conseguimento di una densità’normale’ attraverso l’eliminazione delle piante in esubero o malformate, ridurrebbe l’intensità degli attacchi. Il controllo dei fitofagi della pineta potrà inoltre avvenire in maniera indiretta attraverso opportuni interventi selvicolturali che assicurino la mescolanza del pino con latifoglie autoctone ([13], [11]), consentendo tra l’altro il ripristino delle condizioni originarie del sottobosco nonché dell’intero ecosistema.
References
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar