Impact of environmental pollution and climate change on forest ecosystems: the activity of the IUFRO Research Group 7.01
Forest@ - Journal of Silviculture and Forest Ecology, Volume 4, Pages 451-459 (2007)
doi: https://doi.org/10.3832/efor0489-0040451
Published: Dec 20, 2007 - Copyright © 2007 SISEF
Research Articles
Guest Editors: Joint Session SITE-SISEF (Viterbo 2006)
« Forests and Climate: 10 years of Research in Italy »
Collection/Special Issue: Paolo De Angelis, Riccardo Valentini
Abstract
Impact of environmental pollution and climate change on forest ecosystems: the activity of the IUFRO Research Group 7.01. The IUFRO RG 7.01 deals with “Impacts of Air Pollution and Climate Change on Forest Ecosystems”. Climate change and air pollution are closely linked, although in applied scientific research and even more in political negotiations they have been largely separated. Many of the traditional air pollutants and greenhouse gases have not only common sources, but may also interact physically and chemically in the atmosphere causing a variety of environmental impacts on the local, regional and global scales. The impacts on forest ecosystems have been traditionally treated separately for air pollution and climate change. However, the combined effects of numerous climate change and air pollution factors may significantly differ from a sum of separate effects due to an array of various synergistic or antagonistic interactions. The net effect varies for different ecosystem types and geographic regions, and depends on magnitude of climate or air pollution drivers, and types of interactions between them. This paper reviews the links between air pollution and climate change and their interactive effects on forests. A simultaneous addressing of the air pollution and climate change effects on forests is an opportunity for capturing synergies and avoiding overlaps between two lines of traditional research. This could result in more effective research, monitoring and management as well as better integration of environmental policies.
Keywords
Introduzione
In risposta alla crescente esigenza di indagini integrate sui legami tra inquinanti atmosferici e cambiamento climatico, il gruppo di ricerca della IUFRO (Research Group 7.01.00 “Impacts of Air Pollution and Climate Change on Forest Ecosystems”) organizza una serie di attività. La IUFRO (International Union of Forest Research Organization) è un’associazione internazionale no-profit che ha come principale obiettivo quello di promuovere la cooperazione internazionale nel settore della ricerca selvicolturale e dei prodotti forestali. La missione del RG 7.01.00 è quella di promuovere la collaborazione a livello internazionale e di incoraggiare processi di interazione tra scienziati, decisori politici e rappresentanti di istituzioni locali, allo scopo di condividere le conoscenze scientifiche e armonizzare le strategie volte a ridurre il rischio per le foreste derivante da inquinamento e cambiamento climatico. Il gruppo svolge la sua attività all’interno della Divisione 7 “Forest Health” ed è attualmente suddiviso in quattro gruppi di lavoro: WG 7.01.01 “Detection, Monitoring and Evaluation”, WG 7.01.02 “Mechanisms of Action and Indicator Development”, WG 7.01.03 “Atmospheric deposition, Soils and Nutrient Cycles”, e WG 7.01.04 “Genetic Aspects”. Il nostro obbiettivo è stimolare un approccio integrato nello studio degli effetti dell’inquinamento atmosferico e del cambiamento climatico sulle foreste. Tale opportunità può favorire sinergie ed evitare sovrapposizioni tra queste due tradizionali linee di ricerca, e conseguentemente consentire una maggiore efficienza della ricerca, del monitoraggio e della gestione, e una migliore integrazione delle politiche ambientali a livello locale, nazionale e globale.
Il cambiamento climatico e l’inquinamento atmosferico sono strettamente correlati, sebbene nella ricerca scientifica applicata e ancor più nelle negoziazioni politiche siano spesso separati. Molti dei tradizionali inquinanti atmosferici e gas serra hanno non solo fonti comuni, ma possono anche interagire fisicamente e chimicamente nell’atmosfera, provocando una serie di conseguenze ambientali a scala locale, regionale e globale. Tradizionalmente, gli impatti sugli ecosistemi forestali vengono trattati separatamente per l’inquinamento e il cambiamento climatico. Peraltro, gli effetti combinati dei vari fattori legati a questi fenomeni possono significativamente differire dalla somma dei loro effetti separati, a causa di una serie di interazioni sinergiche o antagoniste. L’effetto netto varia in funzione dell’ecosistema e della regione geografica, e dipende dal livello dei fattori coinvolti, e dal tipo di interazione tra loro. In questo lavoro vengono riassunti le interazioni tra inquinamento atmosferico e cambiamento climatico in atmosfera, e i loro effetti sulle foreste.
Interazioni tra inquinamento e cambiamento climatico in atmosfera
Molti dei tradizionali inquinanti e gas serra sono emessi dalle stesse fonti e interagiscono nell’atmosfera. Il più importante gas serra, l’anidride carbonica (CO2), è principalmente prodotto dalla combustione dei combustibili fossili, che rappresenta anche una fonte importante di molti inquinanti classici. L’elevata concentrazione della stessa CO2 può essere considerata un inquinante, nonostante la mancanza di effetti tossici diretti, se per inquinante si intende un composto che supera i livelli ritenuti normali nell’ambiente.
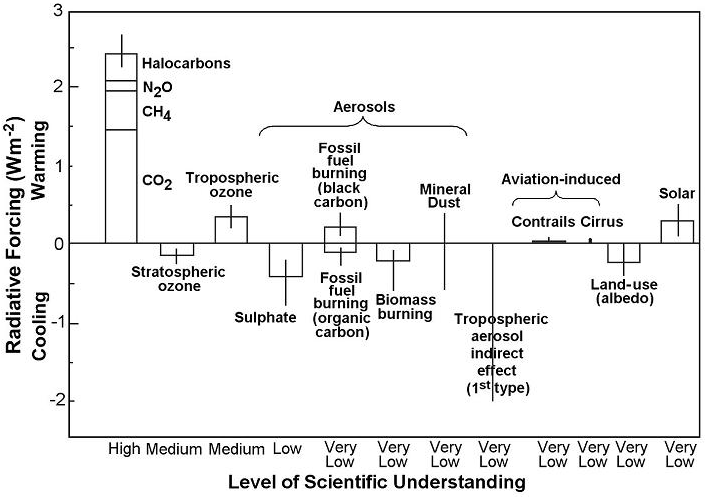
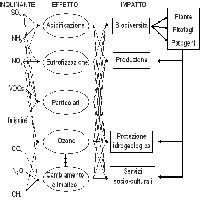
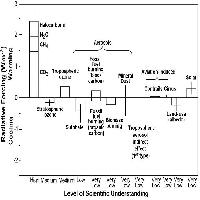
Alcuni inquinanti contribuiscono al bilancio radiativo terrestre, cioè si comportano come gas serra (Fig. 1). Fra questi, la CO2 è la più importante, seguita dal metano (CH4), gli alocarburi (come i clorofluorocarburi, CFC), e il protossido di azoto (N2O). Aerosol e polveri influenzano il clima secondo la loro composizione: la fuliggine favorisce il riscaldamento, mentre altri tipi di aerosol (come alcuni inquinanti a base di zolfo o azoto) generalmente hanno un effetto raffreddante ([24]). Il cambiamento climatico, specialmente elevate radiazioni e temperature, favorisce l’aumento dell’ozono (O3) troposferico, l’inquinante secondario generato dalle reazioni fra composti organici volatili (COV), monossido di carbonio (CO) e ossidi di azoto (NOx - Tab. 1). L’ozono stesso è un potente gas serra e indirettamente influenza la vita di altri gas serra come il metano ([20]). La deposizione acida e l’eutrofizzazione influenzano le emissioni naturali dei gas serra CH4 e N2O dai suoli ([5]). A sua volta, il cambiamento climatico aggrava il problema dell’acidificazione perché aumenta sia la produzione di acido nitrico (HNO3) a partire dagli ossidi di azoto, sia la quantità di ammoniaca (NH3) convertita in solfato di ammonio ([44]). Il cambiamento climatico può influenzare la distribuzione e il mescolamento degli inquinanti, principalmente agendo sui venti e su quantità e intensità delle precipitazioni. L’intensità delle precipitazioni influenza la concentrazione atmosferica e la deposizione dei composti acidificanti. Ciò può inoltre modificare la frequenza e la durata degli episodi di inquinamento gassoso (p.e. da O3). Comunque, le emissioni di inquinanti sono più importanti del cambiamento climatico nell’influenzare la dispersione e la trasformazione chimica degli inquinanti in atmosfera ([31]).
Fig. 1 - Bilancio radiativo medio del sistema climatico nell’anno 2000 rispetto al 1750 ([24]).
Tab. 1 - Relazioni tra gas serra e inquinanti tradizionali, ed effetti sugli ecosistemi terrestri e sul bilancio radiativo della Terra ([16]).
| Effetti | SO2 | NOx | NH3 | COV | CO | PM | CH4 | CO2 e altri gas serra |
|---|---|---|---|---|---|---|---|---|
| Effetti sugli ecosistemi terrestri | ||||||||
| · Acidificazione | x | x | x | - | - | - | - | - |
| · Eutrofizzazione | - | x | x | - | - | - | - | - |
| · Ozono | - | x | - | x | x | - | x | - |
| Effetti sul bilancio radiativo terrestre | ||||||||
| · Diretto | - | x | - | - | - | - | x | x |
| · Via aerosol | x | x | x | x | - | x | - | - |
| · Via OH | - | x | - | x | x | - | x | - |
Effetti integrati di inquinamento e cambiamento climatico sulle foreste
Il cambiamento climatico e l’inquinamento agiscono sulle foreste influenzando suolo, crescita degli alberi, biodiversità, suscettibilità delle piante agli stress, pericolo d’incendio, risorse idriche, valore ricreativo, ecc. Il cambiamento climatico può alterare gli effetti degli inquinanti sugli ecosistemi terrestri. A loro volta, gli inquinanti possono modificare le risposte degli ecosistemi agli impatti derivanti dal cambiamento climatico.
Processi nel suolo
Il cambiamento climatico (specialmente la temperatura) altera molti processi del suolo, con conseguenze sull’intero ecosistema. Le temperature più elevate, le variazioni nelle precipitazioni e le modifiche nella produzione primaria netta accelerano lo sviluppo del suolo, con conseguente aumento dei carichi critici per gli inquinanti e minore sensibilità degli ecosistemi agli inquinanti stessi ([41]). La maggiore mineralizzazione aumenta la disponibilità e la lisciviazione di azoto ([34]). Anche la deposizione di vari inquinanti aumenta la disponibilità di azoto nel terreno. Il cambiamento climatico aggrava il problema dell’acidificazione aumentando la produzione - e quindi la deposizione al suolo - di HNO3 da NOx, e la proporzione di NH3 convertito in solfato di ammonio, che a loro volta possono provocare un’ulteriore acidificazione dei suoli ([44]). La naturale capacità dei suoli forestali di assorbire il metano diminuisce a causa della deposizione di NH3 (⇒ http:/www.bae.uky.edu/IFAFS/FAQS.htm), aumentando così la concentrazione di questo gas serra nell’atmosfera. Elevati livelli di CO2 possono portare ad un aumento dell’umidità del suolo modificando l’evaporazione ([17]).
Condizioni sanitarie delle foreste
Eccetto le polveri e la CO2, tutti gli inquinanti atmosferici danneggiano gli ecosistemi terrestri e quindi le foreste (Tab. 1). L’anidride solforosa (SO2) è probabilmente l’esempio più conosciuto ([29]). NOx e NH3, come anche i vapori di HNO3, possono avere effetti fitotossici diretti, ma solo ad alte concentrazioni ([10]). Le forme gassose di azoto e i composti azotati solubili in acqua contribuiscono al complesso fenomeno dell’eutrofizzazione ([19]). L’ozono è l’inquinante con il più alto potenziale fitotossico e si prevede che entro il 2100 la metà delle foreste mondiali sarà esposta a livelli potenzialmente tossici ([21]). Comunque, alti livelli di inquinanti atmosferici non necessariamente si traducono in sostanziali effetti negativi sulle foreste ([40]). Al contrario, è stato dimostrato un aumento nella crescita delle foreste in diversi paesi europei ([48]). Le ragioni presunte riguardano l’aumento della deposizione azotata, della temperatura e della disponibilità di CO2, nonché i cambiamenti nelle pratiche selvicolturali.
I fattori del cambiamento climatico che provocano l’apertura degli stomi (p.e., l’incremento della temperatura) aumentano la sensibilità delle piante a inquinanti gassosi come SO2 e O3. I fattori che comportano la chiusura degli stomi (p.e., stress idrico, aumento della CO2) aiutano a proteggere la pianta dagli inquinanti gassosi. I fattori del cambiamento climatico che conducono a un periodo di accrescimento più lungo (p.e. riscaldamento) aumentano l’esposizione delle piante agli inquinanti, mentre i fattori che abbreviano il periodo di crescita (p.e., stress idrico) riducono l’esposizione e quindi il danno.
Crescita degli alberi e stoccaggio del carbonio
La maggior parte del carbonio accumulato nelle foreste dell’emisfero settentrionale risiede nel suolo ([14]). Il riscaldamento climatico, l’incremento della mineralizzazione dei suoli, e l’elevata disponibilità di azoto stimolano la crescita delle piante e quindi l’accumulo di carbonio, specialmente se l’azoto è un fattore limitante ([4]). È stato ipotizzato che l’aumento della produzione primaria netta registrato nelle foreste temperate dipenda dall’incremento della deposizione azotata ([36]), delle concentrazioni di CO2 ([22]), della temperatura, e dall’allungamento della stagione di crescita ([35]). Un’ulteriore causa è l’impatto della gestione forestale. Usando un approccio modellistico, la temperatura si è dimostrata relativamente non importante, mentre la combinazione di elevate quantità di CO2 e N può causare un aumento del 15-20% nella produzione primaria netta ([43]). L’elevata deposizione azotata accelera il tasso di accumulo di sostanza organica nel suolo a causa di una maggiore produzione di foglie/aghi e lettiera, e di una riduzione nella decomposizione della sostanza organica ([45]). L’aumento della concentrazione di CO2 favorisce sia l’accrescimento sia l’efficienza idrica delle piante. Comunque, le piante possono adattarsi e questi effetti diminuiscono presto ([50]).
Gli effetti dell’inquinamento sulle foreste possono avere conseguenze importanti sul ciclo del carbonio, che non sono state ancora adeguatamente considerate. La prolungata esposizione all’ozono può ridurre la crescita e quindi lo stoccaggio del carbonio ([27]). L’inclusione dell’ozono in un modello di crescita forestale applicato agli Stati Uniti del nord-est compensa una parte sostanziale degli incrementi causati da CO2 e N ([39]). Felzer et al. ([18]) hanno calcolato che l’esposizione all’O3 abbia ridotto il sequestro del carbonio di 18-38 Tg C anno-1 negli ecosistemi statunitensi dagli anni ’50.
Eventi ricorrenti di estrema siccità possono contrastare gli effetti del previsto riscaldamento globale e dell’allungamento della stagione vegetativa, e minare salute e produttività degli ecosistemi forestali, trasformando i sink di carbonio in sorgenti (Ciais et al. 2005).
Cambiamenti nella biodiversità
La composizione specifica dipende principalmente da clima, suolo e tipo forestale, ma anche la deposizione di azoto e zolfo ha un impatto significativo ([14]). Alcune specie arboree necessitano di basse temperature in inverno per innescare il riscoppio vegetativo in primavera. Queste specie non potranno più crescere in zone dove le temperature invernali stanno diventando troppo alte. Un sovraccarico azotato conduce all’eutrofizzazione e a modifiche nella composizione degli ecosistemi terrestri europei ([3]). Dal momento che i livelli critici degli inquinanti sono specie-specifici, la sensibilità all’inquinamento viene ad alterarsi se la composizione dell’ecosistema cambia. Cambiamenti nella composizione delle specie vegetali possono inoltre modificare la sensibilità di un ecosistema al cambiamento climatico. In futuro si prevedono cambiamenti in biodiversità analoghi a quelli verificatisi per le fluttuazioni climatiche occorse in passato ([42], [3]). Una valutazione degli impatti del cambiamento climatico sugli ecosistemi terrestri in Giappone suggerisce che l’aumento della produttività primaria netta potrebbe modificare il tipo di vegetazione ([46]). Per il Nord America, i modelli mostrano cambiamenti sostanziali negli habitat potenziali di molte specie e comunità ([2], [26]). La superficie forestata negli Stati Uniti potrebbe diminuire di circa l’11%. L’habitat potenziale dell’Artemisia tridentata si sposterà verso Nord fino al Canada ([23]).
Suscettibilità ai fattori di disturbo naturali
I disturbi naturali che hanno il maggiore effetto sulle foreste includono gli insetti, le malattie parassitarie, la siccità, gli incendi, gli uragani. L’eccesso cronico di azoto causa squilibri nel bilancio dei nutrienti negli ecosistemi forestali (p.e., deficienza di macro-nutrienti come K, P, Mg e Ca), che, a loro volta, aumentano la sensibilità delle piante ai fattori climatici, come il gelo o la siccità, e la suscettibilità agli attacchi parassitari ([51]). Anche l’ozono riduce l’indurimento invernale, aumentando il rischio di danni da gelo ([4]).
Si prevede che il rischio di incendi nelle foreste statunitensi aumenterà del 10% nel prossimo secolo, e addirittura del 30% in Alaska e negli Stati Uniti meridionali ([38]). In California meridionale nell’autunno del 2003 si sono avuti esempi di incendi catastrofici. Anni di lotta agli incendi hanno portato ad un accumulo di sostanza organica. Diversi anni di estrema siccità e un’esposizione cronica a elevate concentrazioni di ozono e deposizioni di azoto hanno contribuito ad aumentare la quantità di combustibile al suolo. In aggiunta, la siccità e l’inquinamento hanno indebolito le piante e favorito l’infestazione di coleotteri corticicoli ([33]) e la moria degli alberi. La stagione calda in primavera e autunno del 2003, i forti venti e i fuochi appiccati dai piromani hanno scatenato incendi catastrofici ([28]). Anche gli ecosistemi semi-aridi mediterranei sono molto soggetti a tali eventi. Gli incendi catastrofici in Spagna e Portogallo dell’estate 2005 sono un esempio di questo dilagante fenomeno.
A causa della ridotta proporzione tra l’apparato radicale e la parte aerea causata dalla deposizione di azoto, la suscettibilità delle piante agli schianti può aumentare ([7]). Anche elevati livelli di ozono riducono l’apporto di carboidrati alle radici e riducono la loro biomassa ([9]). In Svizzera, dopo l’uragano del 1999, sono stati analizzati 1600 alberi stroncati ([51]). Gli anelli di crescita annuali negli ultimi dieci anni erano più ampi rispetto a quelli degli alberi rimasti in piedi, facendo ipotizzare una ridotta resistenza meccanica. Le cause presunte risiedono nell’aumento della deposizione azotata, delle temperature e della disponibilità di CO2. Nel legno degli alberi stroncati sono state misurate alte concentrazioni di azoto, che verosimilmente riflettono un alto approvvigionamento. Negli ultimi decenni gli eventi burrascosi e la severità dei danni da vento sono aumentati in tutte le foreste europee ([51]). In Slovacchia, una tempesta nel novembre del 2004 ha distrutto 24 000 ha di superficie forestale (1.2% del totale), principalmente nel Parco Nazionale dei Tatra ([51]). La parte meridionale del Parco è soggetta ad elevati livelli di inquinamento da O3, S e N ([8]). I popolamenti distrutti sono principalmente monocolture mature di abete rosso. La scarsa resistenza delle monoculture agli schianti caratterizza ampie superfici dei popolamenti di abete rosso distrutti dalle burrasche nell’Europa centrale ([47]).
Negli Stati Uniti e nel Canada occidentali, si sono manifestate dilaganti epidemie di coleotteri corticicoli che hanno distrutto intere pinete. Recenti aumenti delle temperature, specialmente ad alta quota, hanno provocato un accorciamento del ciclo vitale dei coleotteri, passando da un ciclo annuale a due cicli in un anno. Nel Nuovo Messico e in Arizona, i coleotteri hanno ucciso circa 70 milioni di pini nel 2002 e nel 2003 ([37]). Queste foreste avevano affrontato gravi periodi di siccità. L’anno 2002 era stato il più secco degli ultimi 1400 anni. Quasi 100 anni di lotta agli incendi avevano triplicato o persino quadruplicato la densità degli alberi e limitato la disponibilità di acqua dei singoli individui, favorendo i danni da carenza idrica. Sebbene l’ozono non sia stato menzionato nel suddetto lavoro, viene da chiedersi che ruolo abbiano giocato le sue elevate concentrazioni in questa moria di pini.
Gli effetti positivi dell’aumento di temperatura sulla crescita delle piante possono essere annullati dalla carenza idrica. L’Europa ha registrato anomalie del clima durante il 2003, con le temperature di luglio di 6°C sopra la media, e le precipitazioni annuali del 50% sotto la media. Le aree forestali hanno registrato una significativa riduzione della produttività primaria lorda e dell’accumulo netto di carbonio, con alcune foreste che in agosto sono diventate fonte di carbonio (Ciais et al. 2005). Durante il resto dell’anno, la produttività primaria lorda non si è completamente ripresa dallo stress estivo. Le foreste mediterranee si sono dimostrate le meno sensibili a questo fenomeno, soprattutto perché la siccità ha comportato anche una riduzione delle perdite di carbonio per respirazione. Sebbene il 2003 non sia stato l’anno più secco, l’impatto della siccitàè stato amplificato dalle alte temperature estive e dal deficit idrico protrattosi dalla precedente primavera. Le anomalie della produttività primaria lorda sono state correlate alle precipitazioni più che alle temperature estive dell’aria (Ciais et al. 2005). Nonostante le condizioni climatiche che favoriscono la siccità e il caldo aumentino anche le concentrazioni di ozono, il ruolo di quest’ultimo non è stato menzionato nel suddetto articolo.
Conclusioni
Le politiche internazionali sul cambiamento climatico sono ancora svincolate da quelle sull’inquinamento atmosferico. Le opportunità per creare sinergie ed evitare sovrapposizioni non sono mai state considerate nelle politiche europee sulla qualità dell’aria, come il VI Programma Quadro e la Long-range Transboundary Air Pollution Convention, e nemmeno nelle negoziazioni sui cambiamenti climatici dell’UNFCCC. A livello tecnico-gestionale, tuttavia, le opportunità sono ampiamente sottolineate, p.e., nell’Intergovernmental Panel on Climate Change e nella Task Force dell’UNECE su “Integrated Assessment Modelling”. Le complesse interazioni atmosferiche tra inquinamento e cambiamento climatico, tuttavia, non sono al momento sufficientemente conosciute da permettere di incorporarle quantitativamente in modelli integrati ([16]). Supponendo una riduzione nelle emissioni di CO2 in adeguamento al protocollo di Kyoto, si avrebbero benefici aggiuntivi in termini di ridotta emissione di inquinanti e ridotti costi per il loro abbattimento, quantificabili in un risparmio del 10% sui costi di controllo dell’acidificazione e dell’ozono troposferico ([49]). Gli effetti indiretti delle politiche sul clima in Europa mirate alla stabilizzazione delle concentrazioni di gas serra nell’atmosfera influenzerebbero i costi per l’abbattimento delle emissioni di SO2 del 50-70% e dell’NOx di circa il 50% ([52]). Ci sono dunque solide argomentazioni finanziarie per sviluppare politiche congiunte per la riduzione di inquinanti e gas serra ([1]). Al di fuori dell’Europa, le sinergie potenziali tra la mitigazione dei gas serra e l’abbattimento dell’inquinamento a livello locale hanno ricevuto attenzione specialmente nei Paesi in via di sviluppo (Cile, Brasile, Messico - [13]) e negli Stati Uniti, dove le ONG come il World Resources Institute (McKenzie et al. 1992) e il Resources for the Future ([6]) hanno promosso un approccio integrato, essenzialmente sulla base dei vantaggi per la salute umana.
La stabilizzazione delle concentrazioni di gas serra nell’atmosfera richiederebbe una riduzione sostanziale (circa il 70%) nelle emissioni globali di gas serra ([24]), assai superiore a quella stabilita nel protocollo di Kyoto. Anche se i Paesi industrializzati riducessero sostanzialmente le loro emissioni di gas serra nei prossimi decenni, il sistema climatico continuerà ad esserne influenzato per secoli ([15]). Ciò dipende dal lungo lasso di tempo necessario affinchè le politiche di riduzione delle emissioni abbiano un effetto sulle concentrazioni di gas serra e, di conseguenza, sul clima. In aggiunta alla riduzione delle emissioni, è dunque necessario comprendere i meccanismi di adattamento delle foreste e degli altri ecosistemi al cambiamento climatico e alle sue interazioni con l’inquinamento.
La ricerca deve ancora dare risposta a molte domande e per questo sono necessari esperimenti a differenti scale (rami, semenzali, alberi maturi, ecosistemi) per meglio comprendere gli effetti dei singoli fattori e le loro interazioni. In particolare, dovrebbero essere incoraggiati esperimenti a lungo termine e a grande scala, come gli studi di arricchimento in aria libera (free air) già condotti a Rhinelander (elevata CO2 e ozono - [27]) o Tuscania (elevata CO2 e fertilizzazione azotata - [30]).
I dati rilevati attraverso il monitoraggio intensivo degli ecosistemi forestali possono essere utili anche in relazione ad altri problemi ambientali, come il cambiamento climatico e le variazioni nella biodiversità. I dati delle stazioni integrate di monitoraggio ICP sono già stati utilizzati in ricerche sui cambiamenti globali, p.e, per i calcoli delle riserve e dei flussi di carbonio e azoto nelle foreste finlandesi ([25]).
Chiaramente, c’è necessità di una migliore utilizzazione delle risorse esistenti, p.e. attraverso una maggiore cooperazione tra le varie attività ICP nell’UE, il coordinamento dei vari programmi di monitoraggio negli Stati Uniti (CASTNET, NADP, IMPROVE, FHM, FIA, LTER, etc.), e una più efficiente collaborazione tra Stati Uniti, Canada, Europa e Asia nello sviluppo di strategie coordinate per la valutazione dei livelli critici di azoto, zolfo e acidità.
Un approccio integrato tra queste due tradizionali linee di ricerca (inquinamento atmosferico e cambiamento climatico) può favorire sinergie ed evitare sovrapposizioni, e quindi consentire una maggiore efficienza della ricerca, del monitoraggio e della gestione, e una migliore integrazione delle politiche ambientali. Le società scientifiche, come SISEF, SITE, IUFRO, hanno un ruolo chiave nel favorire la divulgazione e i contatti con il mondo politico. I problemi che inquinamento e cambiamento climatico pongono alle foreste sono tipicamente transnazionali e intrinsecamente di natura politica. Solo una corretta informazione, all’interno e all’esterno della comunità scientifica, può permettere un ottimale utilizzo dei dati e dei modelli disponibili, il trasferimento tecnologico e delle conoscenze, progetti cooperativi a lungo termine multidisciplinari e multinazionali, e l’armonizzazione delle politiche ambientali.
Ringraziamenti
Il lavoro è basato su una comunicazione orale tenuta al XXII IUFRO World Congress (Agosto 2005, Brisbane, Australia). Una versione estesa è stata pubblicata su Environmental Pollution ([11]).
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar