Ecophysiological responses of Pinus leucodermis at high elevation in the Mediterranean area
Forest@ - Journal of Silviculture and Forest Ecology, Volume 5, Pages 28-38 (2008)
doi: https://doi.org/10.3832/efor0503-0050028
Published: Mar 26, 2008 - Copyright © 2008 SISEF
Research Articles
Abstract
Pinus leucodermis Antoine (= Pinus heldreichii var. leucodermis) is a species of the Balkan flora which in Italy grows in a small area between the Regions of Basilicata and Calabria, in the Pollino National Park. A relict of the oro-Mediterranean Tertiary forests, it is found from the lower vegetation belt, where it is mixed with evergreen sclerophyllous vegetation, up to the alpine vegetation belt beyond the closed formations of Fagus sylvatica, where it makes up stands with very old, isolated and big trees growing in open spaces between rocks. The ecophysiological and dendrochronolgy features of the P. leucodermis stands growing on the west slope of Serra di Crispo (Monte Pollino), between 1800 and 2000 m a.s.l., have been studied during recent years and some of the results are presented in this work. Ecophysiological measurements in situ show that reduced atmospheric vapour pressure deficit conditions, due to humid currents from the western Tyrrhenian Sea, allow the trees to escape from summer drought. When day summer weather conditions are optimal P. leucodermis exhibits a remarkable photosynthetic activity and adaptation to high irradiance. The tree ring width chronology documents a marked reduction of radial growth from 1950 to 1985, followed by a strong recovery, still continuing. In the same period differences between the annual minimum and maximum temperatures tend to increase. Anthropic and grazing pressure is reduced markedly after the institution of the National Park of Pollino.
Keywords
Pinus leucodermis, Mediterranean mountain, Treeline, Tree rings, Water relations, Transpiration, Photosynthetic capacity, Dendrochronology
Introduzione
Negli ultimi anni la crescita degli studi riguardanti gli alberi vegetanti alla treeline è motivata dal fatto che i cambiamenti climatici potrebbero avere marcati effetti in questo ecotone. Almeno tre sarebbero, infatti, i cambiamenti cui le piante dovrebbero adattarsi ([14]). Essi riguardano l’aumento: 1) della concentrazione di CO2 nell’atmosfera; 2) della temperatura; 3) delle deposizioni azotate.
Nel bacino del Mediterraneo, gli effetti dei cambiamenti climatici si manifestano mediante riduzione e variabilità stagionale delle precipitazioni e, quindi, con un prolungamento del periodo di stress idrico ([21]). Ciò può influenzare in modo significativo la distribuzione e la composizione della vegetazione.
Pinus leucodermis (= Pinus heldreichii var. leucodermis) è specie relitta delle foreste oromediterranee del Terziario, il cui areale si estende principalmente nella penisola Balcanica, con un’appendice disgiunta sud-occidentale ristretta alle montagne tra Basilicata e Calabria. Nell’Appennino meridionale la specie vegeta in un ampio range altitudinale, compreso fra le propaggini superiori della vegetazione mediterranea sempreverde (400-500 m s.l.m.) ed il limite superiore della vegetazione arborea (2000-2100 m s.l.m.) con preferenza per le posizioni rupestri e i conoidi detritici ([3], [22], [17]).
Le popolazioni di P. leucodermis più vetuste sono relegate nella porzione superiore di versanti carbonatici, al di sopra del limite superiore di vegetazione in massa di Fagus sylvatica. Esse ricadono nel cuore del Parco Nazionale del Pollino dove le attività antropiche sono soggette a restrizioni dal 1993, anno della sua istituzione. Tali popolamenti sono caratterizzati da basse densità (20-40 piante per ha), con piante di dimensioni imponenti (0.6-1.2 m di diametro a petto d’uomo) e di età molto avanzata, fino a 1000 anni ([24], [4]).
La diminuzione della temperatura al crescere della quota è il fattore che limita fortemente la distribuzione degli alberi al loro limite superiore di distribuzione. Piuttosto che le temperature invernali di per sé, la breve durata del periodo vegetativo, il prolungato gelo e il vento sono i fattori che rendono difficile la sopravvivenza della vegetazione arborea all’aumentare della quota ([27], [19]).
Le severe condizioni climatiche che si verificano in alta quota condizionano l’habitus di P. leucodermis. La chioma è, di norma, tabulare e, spesso, a profilo asimmetrico, a causa dei danni meccanici inferti dal vento e dai sovraccarichi di neve e dai cristalli di ghiaccio. Il fusto mostra, quasi sempre, una o più lesioni longitudinali impartite da fulmini che, in occasione di temporali estivi, si abbattono frequentemente nell’area. Molto frequenti sono, inoltre, ferite da ascia localizzate nella parte bassa del fusto e il taglio di grosse branche inferiori, dovute alle attività legate alla pastorizia.
Il periodo vegetativo si svolge tra la fine di maggio e la fine di settembre. In estate sono frequenti giornate con andamento termico limitante per la fotosintesi e/o con elevata umidità atmosferica che condensa sulle chiome fino a determinare sgocciolamento sottochioma.
Per P. leucodermis i principali riferimenti in letteratura, relativi alle popolazioni del gruppo montuoso del Pollino e dintorni, riguardano il comportamento di germinazione di semi raccolti a quote differenti ([7]), lo studio della rinnovazione naturale ([22]), lo studio dendrocronologico di piante di alta quota ([24], [4], [26]), l’andamento stagionale dell’attività xilematica ([23]) e il comportamento fotosintetico di semenzali generati da semi raccolti a quote differenti ([12]).
Nel presente lavoro vengono presentati alcuni risultati relativi allo studio dendrocronologico ed ecofisiologico dei popolamenti di P. leucodermis vegetanti al di sopra del limite superiore del faggio, nel Parco Nazionale del Pollino. A partire dal 2002 sono state istituite aree permanenti in soprassuoli ubicati fra 1800 e 2032 m s.l.m., al cui interno sono comprese piante ultrasecolari vegetanti allo stato isolato. L’analisi dendrocronologica degli ultimi 600 anni circa (1464-2003) ha avuto come obiettivo quello di documentare le variazioni temporali di crescita radiale e di indagarne le relazioni con il clima, utilizzando le temperature medie e le precipitazioni del periodo 1925-2000. Lo studio del comportamento ecofisiologico in situ ha avuto come obiettivo principale quello di individuare il fattore climatico che maggiormente regola le relazioni idriche di P. leucodermis alla treeline. Curve di risposta della fotosintesi alla luce sono state costruite allo scopo di indagare le potenzialità biochimiche della specie.
Materiali e metodi
Area di studio
L’area di studio ricade in zona 1 del Parco Nazionale del Pollino, in località Serra di Crispo (39° 56’ N, 16° 12’ E, fra 1800 e 2032 m s.l.m.), nel Comune di Terranova del Pollino (Provincia di Potenza, Basilicata).
Serra di Crispo è una dorsale rocciosa ad andamento N-S. Le tre aree permanenti (1.0 ha ciascuna) sono collocate sulla porzione superiore del versante esposto ad Ovest, a pendenza variabile fra 40% e 60%. Il substrato roccioso è costituito da calcari fessurati ceroidi grigi e nocciola e calcari grigio bruni del Mesozoico. Serra di Crispo, e le contigue Serra delle Ciavole, Serra Dolcedorme (a Sud) e Monte Pollino (a Ovest) formano un ampio anfiteatro che racchiude i Piani del Pollino ove sono molto evidenti i morfotipi glaciali del Würm.
Gli affioramenti rocciosi sono ben diffusi e il suolo si presenta in tasche poco profonde, costituite da rendzina con humus di tipo xeromoder. A causa della distribuzione irregolare delle precipitazioni nel corso dell’anno, il clima è mediterraneo di tipo umido. Le precipitazioni medie annue sono dell’ordine di 1570 mm distribuite per il 39.5% in inverno, il 23.7% in primavera, il 29.2% in autunno e il 7.6% in estate. A 2000 m la temperatura media annua è di 4 °C ([3]), mentre la durata della copertura della neve va da Novembre a Maggio.
Gli alberi isolati di P. leucodermis (Fig. 1) punteggiano una prateria discontinua ascrivibile al Caricetum-Seslerietum nitidae ([6]), intercalata, a tratti, con arbusti di taglia molto bassa a dominanza di Juniperus hemisphaerica Presl. e gruppi di Gentiana lutea L.. Daphne oleoides Schreber, Rhamnus pumilus Turra e Sorbus graeca (Spach) Kotschy, localizzati in aree decisamente rocciose.
Fig. 1 - Esemplare plurisecolare di P. leucodermis in prossimità del crinale di Serra di Crispo (Terranova del Pollino, PZ).
Misurazione ecofisiologiche
All’interno di un’area permanente sono stati individuati tre alberi (T) con le seguenti caratteristiche:
- T1 ø = 1.05 m, h = 11 m, età stimata 600 anni;
- T2 ø = 1.01 m, h = 9 m, età stimata 600 anni;
- T3 ø = 0.19 m, h = 5 m, età 40 anni.
Nel corso delle stagioni vegetative 2004 e 2005 sono stati misurati i seguenti parametri ecofisiologici: 1) densità di flusso xilematico (u), 2) potenziale idrico di base (Ψb) e potenziale idrico giornaliero (Ψg) degli aghi; 3) curve di risposta della fotosintesi alla variazione della quantità di flusso radiante (A/Q) su aghi di 1 anno, in due giornate con cielo sereno (giorni giuliani 209 e 210 nel 2005).
Per la misura della densità di flusso (u) è stato utilizzato il metodo termoelettrico ([15], [16]).
I sensori, costituiti da una coppia di aghi ciascuno contenente una termocoppia e avvolti con un rivestimento resistivo, sono stati inseriti radialmente nell’alburno (direzione NE del fusto) ad una distanza verticale di circa 12 cm uno dall’altro, a circa 1.30 m da terra e protetti dalle escursioni termiche esterne mediante fogli isolanti in termoflex. Il ΔT che si genera tra il sensore superiore (costantemente riscaldato) e quello inferiore (che registra la temperatura del legno) è indice dell’attività traspirativa della pianta, espressa come variazione della densità di flusso (u) e calcolata utilizzando la seguente equazione ([15], [16] - eqn. 1):
dove u indica la densità di flusso xilematico espressa in g m-2 s-1 e K è detto indice di flusso, dato dal rapporto (eqn. 2):
Sono stati misurati in continuo i seguenti parametri ambientali e climatici: temperatura (T), umidità dell’aria (UR), contenuto idrico relativo del suolo (rswc) e radiazione fotosinteticamente attiva (PAR). Il contenuto idrico del suolo è stato misurato ad una profondità di 30 cm mediante tecnica TDR (TDR - Time domain reflectometry - mod CS615, Campbell scientific, Logan, Utah, USA), mentre per la misura della PAR è stato utilizzato un quantum sensor (LI-COR 190, LI-COR Bioscience, Lincoln, USA).
I dati relativi ai parametri climatici, ambientali e di densità di flusso sono stati acquisiti ogni minuto e registrati ogni 15 minuti mediante datalogger (CR10X, Campbell Scientific Corp., Logan, UT) dotato di multiplexer (Campbell AM32B). L’alimentazione dei sensori di Granier e del datalogger è avvenuta mediante batteria da 12 V.
Le misure di potenziale idrico xilematico sono state eseguite con il metodo della camera a pressione (PMS Instruments, Corvallis, Oregon) nei giorni indicati in Tab. 1. Per ciascuna pianta, su 3 aghi di un anno prelevati,da differenti porzioni della chioma, sono state effettuate misure prima dell’alba e nel corso della giornata a cadenza regolare.
Tab. 1 - Date selezionate per le misure di potenziale idrico xilematico.
| Anno | Data | Giorno giuliano | T (°C) | Ur (%) |
|---|---|---|---|---|
| 2004 | 18 Giugno | 170 | 7 | 97 |
| 16 Luglio | 198 | 9 | 69 | |
| 28 Luglio | 210 | 7 | 99 | |
| 26 Agosto | 239 | 13 | 56 | |
| 24 Settembre | 268 | 9.4 | 74 | |
| 2005 | 13 Luglio | 194 | 7.6 | 94 |
| 29 Luglio | 210 | 18 | 45 | |
| 30 Agosto | 242 | 10 | 94 |
Mediante Infra Red Gas Analyser (CIRAS, PP System, HITCHKIN, UK) sono state costruite curve A/Q per valutare la risposta dell’assimilazione delle piante di P. leucodermis al variare della densità di flusso radiante, resa possibile grazie all’utilizzo di un’unità luce montata sulla cuvette dello strumento. All’interno della cuvette sono stati settati i valori di umidità relativa e di temperatura simili a quelli ambientali. Per ciascuna pianta, considerando aghi di un anno su rami ben esposti alla luce, sono state costruite 3 curve, secondo i seguenti valori di densità di flusso radiante: 500 - 300 - 100 - 20 - 500 - 800 - 1200 - 1800 - 2000 μmol m-2 s-1. I valori di assimilazione misurati sono stati rapportati alla superficie reale degli aghi, calcolata mediante il software Archicad su foto digitali scattate alla fine di ogni curva.
Misurazioni dendrocronologiche
La costruzione della master cronology è stata effettuata utilizzando 41 carote legnose prelevate da 15 piante mediante trivella di Pressler ad un’altezza da terra inferiore a un metro. Le carotine sono state opportunamente montate su supporti lignei ed accuratamente levigate fino a quando le tracheidi erano visibili al microscopio ottico 40X. Dopo il procedimento di visual cross-dating ([28]) l’ampiezza degli anelli è stata misurata con una precisione di 0.01 mm utilizzando la metodologia indicata da Aniol ([2]). La qualità delle serie misurata è stata verificata mediante il software Cofecha ([18]) mentre il processo di standardizzazione dei dati è stato effettuato utilizzando il software Arstan ([9], [10]). È stata sviluppata una cronologia “standard“ e “residuale”. I dati della cronologia ”residuale” sono stati utilizzati per valutare le relazioni tra l’accrescimento radiale e fattori climatici utilizzando le procedure di Cook et al. ([11]).
Le relazioni clima-ampiezza anulare sono state valutate analizzando il periodo compreso tra luglio del precedente anno e ottobre del corrente anno.
I dati di temperatura media e precipitazioni provengono rispettivamente dalle stazioni di Castrovillari (CS, 353 m s.l.m., 12.5 km distante dal sito di studio) e Campotenese (CS, 965 m s.l.m., 11 km distante dal sito di studio), sono a cadenza mensile e coprono il periodo 1925-2000.
I coefficienti di correlazione e le funzioni di risposta sono stati ottenuti utilizzando le metodologie indicate da Biondi & Waikul ([5]). Per maggiori dettagli sulla metodologia si rimanda a Todaro et al. ([26]).
Risultati e discussione
Variazioni stagionali di parametri ecofisiologici
La maggior parte delle giornate selezionate per le misure ecofisiologiche sono state caratterizzate da condizioni climatiche piuttosto instabili, elevata umidità relativa dell’aria, nubi basse e precipitazioni occulte (giorni giuliani 170, 198, 210, 268 nell’estate 2004 e 194 e 242 nell’estate 2005). Solo in due giornate di misure il clima è stato caratterizzato da condizioni stabili di cielo sereno e temperature relativamente elevate (giorni giuliani 239 e 210 durante l’estate 2004 e 2005, rispettivamente).
Nel 69% delle giornate (n = 264) in cui è avvenuta la misurazione in continuo dei parametri climatici, i valori di umidità relativa erano compresi tra 70% e 100%, mentre nel 74% dei casi sono stati misurati valori di temperatura media giornaliera compresa tra 6.5 e 12.5 °C. Durante la stagione vegetativa 2004 le piante hanno sperimentato un contenuto idrico del suolo (rswc) inferiore e per un periodo più prolungato rispetto all’estate 2005, quando si è verificata una sua ricarica idrica già a partire dal mese di agosto. I valori minimi misurati sono stati intorno a 0.3 m3 m-3, mentre quelli che più si avvicinano alla capacità di campo sono prossimi a 0.7 m3 m-3.
Il valore di Ψ degli aghi non differisce significativamente (p> 0.05) tra le piante misurate in nessuna delle giornate considerate (Tab. 2), sia nel 2004 che nel 2005, pertanto nelle successive elaborazioni è stato considerato il valore medio.
Tab. 2 - Risultati dell’analisi statistica (test di Kruskal-Wallis) condotta sui valori di potenziale idrico di base (Ψb), medio giornaliero (Ψd), e minimo (Ψmin) misurati tra i diversi alberi (n = 3) e giornate di misura. n.s. indica che il valore è il medesimo negli alberi e nei giorni di misura.
| Parametro | Ψb | Ψd | Ψmin |
|---|---|---|---|
| Alberi | n.s. | n.s. | n.s. |
| Mesi | n.s. | P < 0.001 | n.s. |
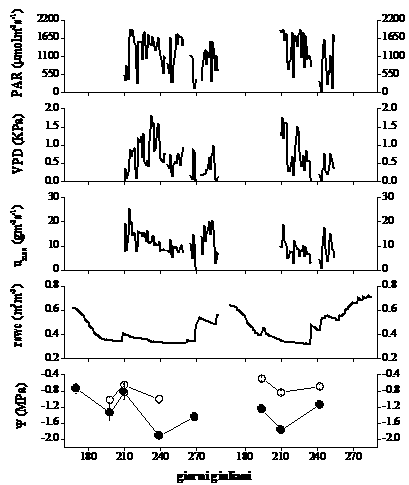
Come mostrato in Fig. 2, l’andamento del potenziale idrico di base e quello minimo giornaliero sono concordi con le variazioni stagionali del contenuto idrico (relativo) nel suolo. Nell’estate 2004, il valore meno negativo di Ψb (-0.65 MPa) è stato misurato alla fine di luglio (gg. 210), in coincidenza di una lieve ricarica idrica del suolo in seguito ad un evento piovoso. Il valore più basso di Ψmin (-2.0 MPa) è stato misurato a fine agosto, nell’unica giornata caratterizzata da valori elevati di VPD e PAR e in concomitanza di vento molto forte.
Fig. 2 - Andamento stagionale della variazione di densità massima di flusso xilematico giornaliero (umax), potenziale idrico di base (Ψb, cerchio vuoto) e minimo giornaliero (Ψmin, cerchio pieno) e del deficit di pressione di vapore in atmosfera (VPD), radiazione fotosinteticamente attiva (PAR) e contenuto idrico relativo del suolo (rswc) per l’estate 2004 (a sinistra) e 2005 (a destra). I valori di densità di flusso rappresentano la media dei tre valori più alti misurati nell’arco della giornata, mentre VPD e PAR sono stati calcolati come media giornaliera dei valori corrispondenti. Ψb e Ψmin rappresentano la media dei valori misurati per ciascun albero (n=3) ± 1ES.
Durante la stagione vegetativa 2005 il valore più alto di Ψb è stato misurato in una giornata con umidità relativa prossima alla saturazione, caratterizzata da precipitazioni occulte che condensavano sulle chiome degli alberi e che, in aggiunta, hanno reso impossibili le misure di scambi gassosi. Il potenziale idrico è culminato a fine luglio con un valore di -1.8 MPa, in coincidenza di una giornata a cielo sereno (gg 210).
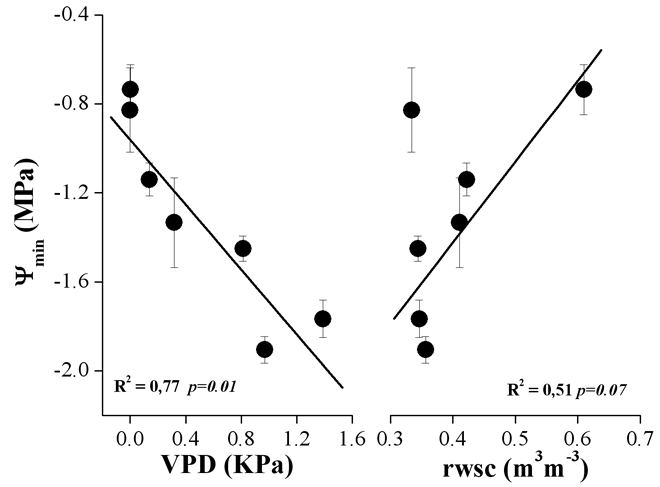
Come è possibile osservare in Fig. 3, le variazioni stagionali dei valori minimi giornalieri di potenziale idrico sono spiegate per il 77% e il 51% dalle variazioni di VPD e di rswc rispettivamente, secondo quanto indicato dai coefficienti di determinazione (R2). La relazione fra le variabili considerate è peraltro significativa (p < 0.05) solo nel caso della VPD.
Fig. 3 - Relazione tra potenziale idrico minimo giornaliero (media ± 1ES dei valori misurati per ciascuno dei tre alberi) e corrispondenti valori medi giornalieri di deficit di pressione di vapore (VPD) in atmosfera e contenuto idrico relativo del suolo (rswc).
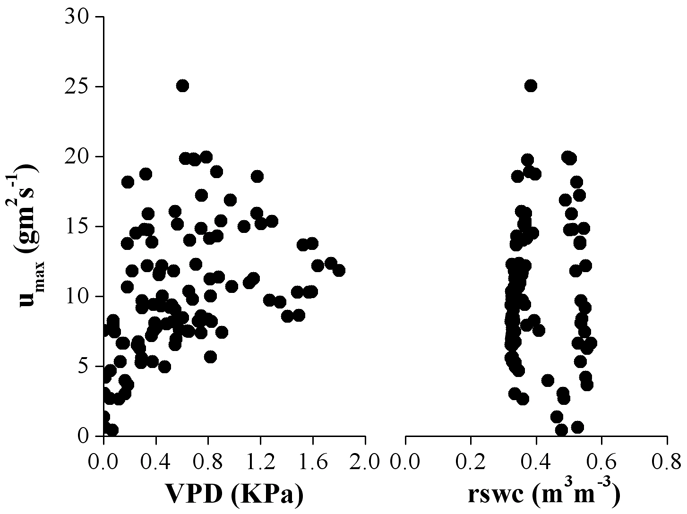
Anche le variazioni stagionali di densità di flusso sembrano dipendere in maggiore misura dalle variazioni di VPD piuttosto che dalla riduzione estiva del contenuto idrico relativo del suolo (Fig. 4), come documentato anche da Anfodillo et al. ([1]) per Larix decidua, Pinus cembra e Picea abies vegetanti alla treeline sulle Alpi meridionali. In particolare, in Fig. 4 si osserva un aumento lineare dei valori di massima densità di flusso giornaliera (umax) all’aumentare della VPD fino al range di valori compreso tra 0.8 e 1.1 KPa, oltre il quale si osservano ridotte variazioni di umax , indicando un controllo stomatico sull’attività traspirativa. I valori più elevati misurati sono stati dell’ordine di 25 g m-2 s-1 corrispondente ad un valore di VPD pari a 0.6 KPa e di 18.5 gm-2 s-1 con un valore di VPD pari a 1.1 KPa rispettivamente per l’estate 2004 e 2005.
Fig. 4 - Relazione tra valore massimo giornaliero di densità di flusso, calcolato come media dei tre valori massimi misurati durante la giornata, e corrispondenti valori di deficit di pressione di vapore (VPD) in atmosfera e contenuto idrico relativo del suolo (rswc) misurati nel corso delle stagioni vegetative 2004 e 2005.
I valori di massima densità di flusso sono significativamente correlati (p < 0.0001) con le variazioni di VPD (Fig. 4) e PAR (dato non mostrato), mentre non appaiono correlati con le variazioni di contenuto idrico del suolo. Questo ultimo dato potrebbe ricondursi alla circostanza che le piante non si approvvigionano solo dell’acqua presente nello strato di suolo superficiale ma, attraverso le fessure rocciose, attingerebbero anche in strati profondi. In condizioni limitanti di contenuto idrico del suolo, inoltre, il flusso traspirativo risulta attenuato dalla elevata umidità relativa, in particolare dalle nebbie e precipitazioni occulte che contribuiscono a migliorare e/o mantenere il bilancio idrico delle piante.
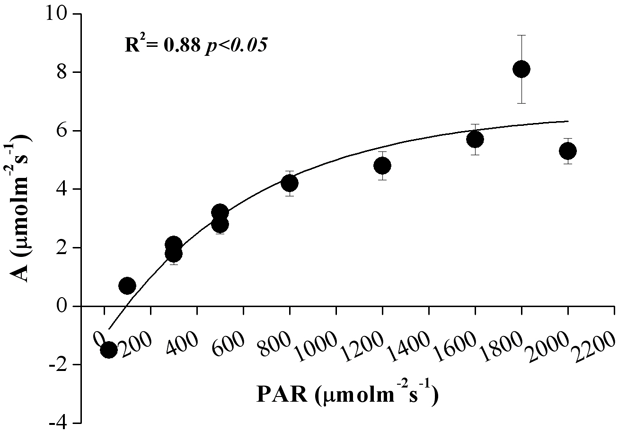
In Fig. 5 è mostrato l’andamento dei valori di assimilazione in relazione alla variazione di densità di flusso radiante nella PAR. Ciascun punto rappresentato deriva dalla media dei valori relativi alle curve (n=3) misurate per ciascuno dei tre alberi. Il punto di compensazione per la PAR è intorno a 80 μmol m-2 s-1. L’irradianza di saturazione si attesta intorno a 1600 μmol m-2 s-1 con un valore di assimilazione (A) di 6 μmol m-2 s-1. Tali valori sono superiori a quelli riportati da Oleksyn et al. ([20]), misurati su aghi di diverse classi di età di P. heldreichii allevati in arboreto il cui punto di compensazione risultava tra 40 e 58 μmol m-2 s-1 e quello di irradianza di saturazione tra 800 e 1000 μmol m-2 s-1 (a seconda della classe di età degli aghi). In misure condotte su piante di P. leucodermis di 10 anni, derivanti da semi raccolti in diversi siti lungo un gradiente altitudinale, Colom et al. ([12]) hanno messo in evidenza una maggiore capacità fotosintetica delle piante i cui semi erano stati prelevati a 2000 m. Le misure condotte in situ, su piante più vecchie, confermano la notevole attività assimilativa di questa specie all’aumentare della disponibilità di luce, in condizioni ottimali di PAR e temperatura. Nel nostro caso, tuttavia, è stato trovato un valore più elevato di irradianza di saturazione, con un valore di assimilazione pari a 6 μmol m-2 s-1, inferiore a quello riportato da Colom et al. ([12]). Le piante di P. leucodermis vegetanti ad alta quota nel nostro sito di studio mostrano, pertanto, una notevole acclimatazione all’elevata disponibilità di luce senza incorrere in fenomeni di fotoinibizione indotti da eccessi di flusso radiante.
Fig. 5 - Curva di risposta della fotosintesi alla variazione di densità di flusso radiante nell’ambito della PAR. Ciascun punto rappresenta la media dei valori relativi alle tre curve misurate per ogni albero (n = 3).
Variazioni di lungo periodo delle ampiezze anulari
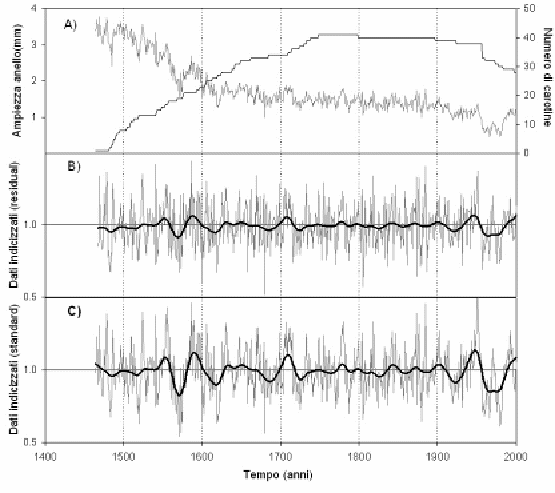
Una master chronology di 540 anni, con i relativi parametri statistici descrittivi, è riportata in Fig. 6 e Tab. 3. Analizzando la Fig. 6 è possibile fare due osservazioni relative al secolo più recente: nel periodo 1950 - 1985 si registra un progressivo declino della crescita radiale, mentre a partire da questo anno si assiste ad una ripresa della crescita. Secondo quanto riportato da Todaro et al. ([26]), il declino della crescita potrebbe essere attribuito ad un’eccessiva attività di pascolo e alle attività antropiche connesse che, però, hanno subito un marcato declino a partire dagli anni ’70 e sono state finalmente regolamentate a partire dagli anni ’90, con l’istituzione del Parco Nazionale del Pollino. La netta ripresa della crescita in età avanzata è, apparentemente, in controtendenza con il declino biologico delle piante legato all’età e non sembra essere riconducibile a deposizioni azotate (ICP Forest 2005). Per quanto concerne i cambiamenti climatici registrati nel sito di studio ([26]), gli andamenti di temperatura massima e minima su base annuale, hanno fatto registrare una marcata inversione di tendenza nel periodo 1925-1972 rispetto al periodo 1953-2000: in quello più recente si registra un trend divergente degli estremi termici e un incremento della temperatura media annua di 0.8 °C dal 1925 al 2000. La continentalizzazione del clima che le piante sperimentano a quote elevate potrebbe essere favorevole per P. leucodermis che colonizza spazi aperti mediante seme. Fagus sylvatica, invece, occupa lo spazio quasi esclusivamente mediante propaggini e, nelle aree rupestri più acclivi, è soggetto a filloptosi anticipate nelle estati più siccitose come quella verificatasi nel 2000. In ogni caso l’esame della cronosequenza degli aerofotogrammi relativi al sito di studio documentano una progressiva risalita della latifoglia a partire dagli anni ’50 del secolo scorso, che testimonia in modo inequivocabile la forte influenza antropica sulle dinamiche di regressione e progressione del limite superiore della vegetazione forestale.
Fig. 6 - Cronologia del pino loricato di Serra di Crispo. A) Ampiezza anello e corrispondente numero di campioni esaminati. B) Cronologia dei residui indicizzati. C) Cronologia dei valori standard indicizzati.
Tab. 3 - Principali parametri statistici descrittivi per la cronologia del pino loricato di Serra di Crispo.
| Periodo: 1464-2003 |
540 anni |
15 alberi |
41 carotine |
|---|---|---|---|
| Tipo di cronologia |
Standard | Residual | Arstan |
| Media | 0.9897 | 0.9976 | 0.9919 |
| Mediana | 0.9833 | 0.9944 | 0.9883 |
| Sensitività media | 0.1545 | 0.1691 | 0.1508 |
| Deviazione standard |
0.1679 | 0.1507 | 0.1645 |
| Skewness | 0.2234 | 0.0523 | 0.1767 |
| Kurtosis | 0.0209 | -0.1055 | -0.0301 |
| Autocorrelazione di I° ordine | 0.3391 | 0.0012 | 0.3334 |
| Autocorrelazione di II° ordine | 0.1782 | -0.0078 | 0.1162 |
| Varianza dovuta ad autocorrelazione | 15.70% | - | 13.30% |
| Errore di varianza | 0.001438 | - | 0.001168 |
L’analisi statistica (Tab. 3) fornisce un altro dato interessante legato alla sensitività media che si attesta su un valore che potremmo definire “medio-basso” (da 0.15 a 0.17, in funzione della cronologia considerata). La sensitività media nelle serie cronologiche è una stima delle variazioni di alta frequenza dovute principalmente ad oscillazioni interannuali di fattori ecologici.
Serre-Bachet ([25]) indica che solo eccezionalmente, nelle regioni mediterranee, il valore è superiore a 0.30; normalmente il valore medio è di circa 0.21. In ogni caso, i valori dei parametri statistici ottenuti nel presente lavoro sono simili a quelli riportati in letteratura per la stessa specie all’interno della medesima area di studio ([4]).
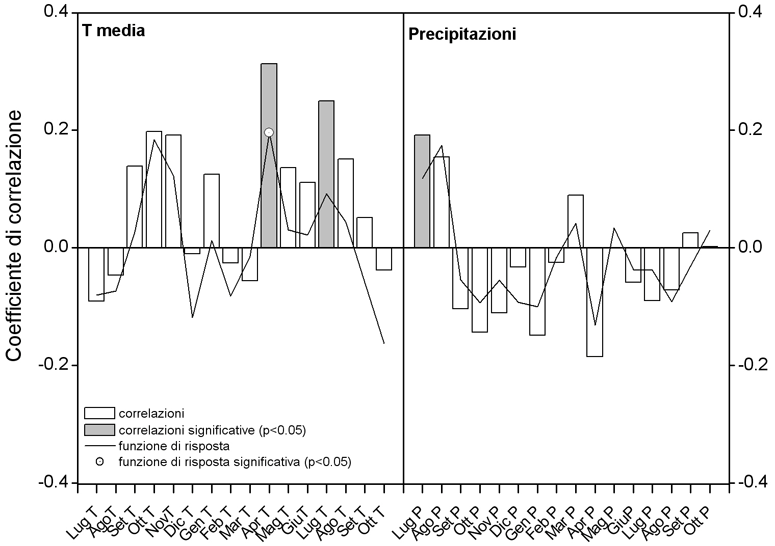
Le relazioni fra accrescimento radiale e fattori termopluviometrici, deducibili dalle correlazioni di Pearson (Fig. 7), mostrano un effetto positivo della temperatura media sull’accrescimento, con particolare riferimento a quelle di aprile e di luglio. La prima potrebbe avere un ruolo importante nella schiusura delle gemme e nell’inizio dell’attività cambiale e della divisione cellulare. In P. leucodermis, nel sito di studio la durata della xilogenesi (intesa come produzione di cellule xilematiche da parte del cambio) si protrae da metà maggio a fine luglio (Rossi, comunicazione personale), mentre la divisione cellulare culmina intorno al solstizio estivo ([23]).
Fig. 7 - Correlazione semplice di Pearson e coefficienti di funzione di risposta tra ampiezza anulare e temperatura media mensile e precipitazione per il periodo 1925-2000. La significatività e la stabilità dei coefficienti di regressione delle funzioni di risposta si basano sulla tecnica statistica bootstrap.
Riguardo alle precipitazioni, si evidenzia una correlazione positiva solo tra l’ampiezza anulare e le precipitazioni del mese di luglio della stagione vegetativa precedente a quella in cui l’anello si è formato, mentre dalla funzione di risposta (response function) non è stata trovata alcuna relazione significativa tra i due parametri. Sembrerebbe, dunque, che le esigenze di P. leucodermis durante il periodo vegetativo siano legate essenzialmente alle temperature, mentre risultano di scarsa importanza (se non addirittura negative quando in eccesso) le precipitazioni.
Le misure ecofisiologiche di breve periodo sembrano supportare questa ultima asserzione, sebbene si riferiscano ad un arco temporale piuttosto ristretto. In particolare, l’attività traspirativa degli alberi di P. leucodermis risulta limitata dalle frequenti condizioni di bassa VPD piuttosto che da riduzioni del contenuto idrico del suolo relativo e, quindi, delle precipitazioni nei mesi estivi.
Conclusioni
L’analisi dei dati di campagna fin qui elaborati suggerisce di approfondire l’ipotesi che l’attività traspirativa e biochimica di P. leucodermis ad alta quota sia modulata dalle ampie fluttuazioni giornaliere e stagionali dell’umidità atmosferica, oltre che dalla temperatura durante l’attività vegetativa, piuttosto che dalle restrizioni del contenuto idrico del suolo.
Sebbene si tratti di piante ultrasecolari, le misure di scambi gassosi hanno messo in evidenza una loro notevole potenzialità fotosintetica ad elevati livelli di flusso radiante. L’attività fotosintetica potrebbe essere limitata non solo dalle basse temperature, ma anche dall’elevata umidità atmosferica, frequente durante il periodo vegetativo, che riduce la densità di flusso radiante nell’ambito della PAR.
Le funzioni di risposta dell’analisi dendrocronologica confermano il ruolo decisivo della temperatura sull’accrescimento secondario, con particolare riferimento a quelle di Luglio, mentre le precipitazioni nell’arco della stagione vegetativa avrebbero una scarsa incidenza sulle dinamiche dell’accrescimento secondario. Questo risultato appare concorde con quanto osservato per le variazioni dei flussi traspirativi che risultano poco correlati con la riduzione della disponibilità idrica nel suolo durante il periodo vegetativo. Fra gli aspetti della ricerca che meritano un approfondimento vi è quello del ruolo svolto dalle condensazioni di nebbie e nubi basse in atmosfera, di provenienza tirrenica, che non solo rappresenterebbero una fonte alternativa di approvvigionamento idrico per le piante, come osservato per Sequoia sempervirens ([13], [8]), ma potrebbero svolgere un ruolo cruciale nella stimolazione dell’attività stomatica e/o fotosintetica e nel controllo delle perdite traspirative.
Ringraziamenti
La presente ricerca è stata svolta con fondi MIUR PRIN 2002 e 2005, intestati a AS. Si ringraziano: l’Ente Parco Nazionale del Pollino per aver consentito l’accesso all’area di studio, il Comune di San Severino Lucano e il Comando Stazione del Corpo Forestale di San Severino Lucano per il supporto logistico. Un sincero ringraziamento va al Prof. Marco Borghetti per il supporto scientifico e al Dr. Francesco Ripullone per l’assistenza in campo nelle misure di scambi gassosi.
References
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar