Soil carbon accumulation in a Populus spp. plantation supplied with high atmospheric CO2 and nitrogen fertilization
Forest@ - Journal of Silviculture and Forest Ecology, Volume 6, Pages 229-239 (2009)
doi: https://doi.org/10.3832/efor0588-006
Published: Jun 30, 2009 - Copyright © 2009 SISEF
Research Articles
Abstract
This work was carried out in the experimental area POPFACE (Tuscania, Viterbo), where a poplar short rotation forest (SRF) was treated with 550 ppm of atmospheric CO2 for six years. The experimental plots (Control and FACE) were divided in two halves, one of which was treated with nitrogen fertilization. The general aim of this research was to quantify the impact of the two rotation cycles, the CO2 enrichment and the nitrogen fertilization on: i) soil organic matter fractions more relevant for microbial metabolism; ii) microbial C mineralization activity and iii) the ecosystem capacity to store C in the soil. On soil samples collected from 2000 to 2004, the soil Organic C (TOC), the total extractable C (TEC) and several labile C fractions (MBC, WSC, ExC) were analysed. The microbial mineralization activity was also analysed. In comparison with the previous culture crop, the plantation increased the organic C storage in soil by about 23% in the second rotation cycle. Under elevated CO2, the increase of above- and belowground productivity supported a greater accumulation of labile C in soil, favouring a microbial C immobilization process. Fertilization treatment induced short-term changes in the soil C content, without overall modifications in the second rotation cycle.
Keywords
Populus spp., FACE, Nitrogen, Soil organic carbon, Microbial mineralization
Introduzione
Il destino del carbonio (C) fissato dalle piante e rilasciato nel suolo condiziona fortemente il ciclo del C degli ecosistemi terrestri ([9]). Infatti, se gli apporti vegetali vengono immagazzinati in frazioni di C labile con tempi di residenza bassi, il C potrà tornare in atmosfera nel giro di pochi anni sotto forma di CO2, mentre se vengono immagazzinati in frazioni stabili il C del suolo sarà caratterizzato da tempi di turnover di centinaia o migliaia di anni, determinando la capacità degli ecosistemi terrestri di accumulare C ([1], [40]). La ripartizione del C del suolo fra le le frazioni stabili e labili e quindi il suo turnover, può essere fortemente influenzata dall’incremento della concentrazione della CO2 atmosferica. L’aumento della produttività primaria netta (NPP) in elevata CO2 è stato ampiamente dimostrato in diversi ecosistemi ([16], [24]) e nella stazione sperimentale oggetto di questo studio ([19]). Nello stesso sito, Lukac et al. ([39]) hanno osservato un aumento della produttività e del turnover delle radici fini che possono aver determinato l’aumento di C labile nel suolo riportato per lo stesso sito da Hoosbeek et al. ([27]) e [37], [36]). In elevata CO2 sono state inoltre osservate modificazioni della qualità degli apporti organici al suolo come l’accumulo di carboidrati non strutturali e la diminuzione della concentrazione di N nei tessuti ([18], [15], [14], [48]), che possono condizionare il processo di decomposizione microbica.
L’incremento degli apporti di C può determinare: (1) una stimolazione dell’attività microbica di decomposizione della sostanza organica, in particolare in suoli con scarsa disponibilità di nutrienti (priming effect - [35]); (2) un rallentamento dei processi di mineralizzazione della sostanza organica nativa, in particolare in suoli con abbondante riserva di nutrienti, dovuto alla preferenza dei microrganismi per i substrati più facilmente decomponibili ([9]); (3) una diminuzione dell’attività di decomposizione in condizioni di scarsa disponibilità di nutrienti o un aumento della stessa in condizioni nutritive ottimali (ipotesi della competizione - [10]).
Lo status nutrizionale del suolo ha quindi una notevole influenza su tali processi, ed è stato ipotizzato che solo con un’adeguata disponibilità di nutrienti l’arricchimento della CO2 atmosferica potrà realmente stimolare la crescita vegetale, compresa la componente ipogea, e l’accumulo di C negli ecosistemi terrestri ([59], [63]). Inoltre, diversi studi hanno evidenziato un effetto negativo della fertilizzazione azotata sulla respirazione del suolo, sia per la componente autotrofa che eterotrofa ([7], [49]).
Il presente studio è stato effettuato nell’area sperimentale POPFACE (Tuscania, Viterbo), dove una piantagione di pioppo per produzioni di biomassa a ciclo breve (SRF) è stata esposta ad una concentrazione di CO2 atmosferica di 550 ppm per 2 cicli colturali della durata complessiva di 6 anni. A partire dal secondo ciclo colturale le parcelle sperimentali (FACE e Control) sono state suddivise in due metà di cui una sottoposta a fertirrigazione azotata, al fine di evidenziare eventuali interazioni tra la concentrazione di CO2 atmosferica e la disponibilità di azoto (N). Su tali parcelle sono state analizzate le variazioni temporali del C organico del suolo e di sue frazioni a diverso grado di labilità. Obiettivo generale del presente lavoro è stato quello di quantificare l’effetto dei diversi cicli colturali, dell’arricchimento della CO2 atmosferica e della fertilizzazione azotata su: i) le frazioni della sostanza organica del suolo più rilevanti per il metabolismo microbico; ii) l’attività microbica di mineralizzazione del C organico del suolo; iii) la capacità dell’ecosistema di accumulare C nel suolo.
Materiali e metodi
Descrizione del sito
L’impianto sperimentale POP-EUROFACE si trova in centro Italia, nel territorio del comune di Tuscania (provincia di Viterbo) ad una latitudine di 42° 22’ N, una longitudine di 11° 48’ E e un’altitudine di 150 metri sul livello del mare, a soli 15 chilometri dalla costa tirrenica. La piantagione estesa su circa 9 ettari è divisa in due grossi settori da una strada in terra. Il suolo ha una tessitura limoso/argillosa-limosa ed un profondo orizzonte A ed è stato classificato come Xeric Alfisol (USDA classification - [57]). Per ulteriori dettagli sulle caratteristiche pedologiche del sito si rimanda a Hoosbeek et al. ([28]). Il clima è tipicamente mediterraneo con estati calde e asciutte, inverni miti ed umidi ed una temperatura media annuale di 14 °C. Le precipitazioni annuali ammontano mediamente a 818 mm. Prima della piantagione il terreno è stato arato e poi sminuzzato due volte usando una fresatrice per rimuovere le erbe e per migliorare la struttura del suolo, precedentemente coltivato a grano. La piantagione è stata effettuata nel 1999 usando delle talee lunghe circa 25 cm di Populus x euramericana (Dode Guiner clone I-214), selezionate per dimensione, stato di germogliamento ed uniformità di vigore, ad una densità di piantagione di 5000 piante per ettaro (2x1 m). L’intero impianto è stato dotato di un sistema di irrigazione a goccia, che ha mediamente erogato 5-10 mm di acqua al giorno nel periodo maggio-settembre. All’interno, in sei plots sperimentali sono state piantate talee di tre diverse specie: una selezione italiana di Populus alba L. (clone 2AS-11), Populus nigra L. (clone Jean Pourtet) e il sopracitato P. x euramericana, ad una densità di diecimila alberi per ettaro (1x1 m). I sei plots di forma quadrata con lati di trenta metri di lunghezza, sono separati l’uno dall’altro da almeno centoventi metri, per evitare eventuali contaminazioni tra le zone fumigate con CO2 e quelle di controllo. Tre plots erano fumigati con tecnologia FACE ([45]) per ottenere una concentrazione desiderata di CO2 atmosferica di 550 ppm durante le ore diurne del periodo vegetativo, gli altri di controllo avevano condizioni di CO2 ambientale pari a circa 375 ppm. Ogni plot è stato suddiviso in due zone (fertilizzato e non fertilizzato) ed ognuna di queste in ulteriori tre settori corrispondenti alle tre specie. Le due metà di ogni plot sono state separate da una barriera in vetroresina, posta fino ad una profondità di un metro per evitare i movimenti di nutrienti tra le due tesi. Complessivamente erano quindi presenti 36 settori sperimentali (3 specie x 2 tesi di fertilizzazione x 2 tesi di CO2 x 3 repliche). L’azoto non è stato immesso nei primi tre anni del ciclo, ma solo a partire dal 2002, in concentrazioni di 212 kg ha-1 nel primo anno e 290 nel secondo e nel terzo. Prima della fertilizzazione (giugno 2002) il contenuto di N totale era pari a 0.13 % mentre quello inorganico era pari a circa 10 µg g-1 ([46]). Alcune pompe idrauliche (Ferti-injector Amiad, IMAGO s.r.l., Italia), distribuivano il fertilizzante attraverso il sistema di irrigazione: nel 2002 Navarsol 20.6.6 (N, P2O5, K2O + microelementi) dato in rapporto NH4+ /NO3- pari a 4:1; nel 2003 e 2004 nitrato di ammonio 34.0.0 (N, P2O5, K2O), dato in rapporto NH4+ /NO3- pari a 1:1. La fertilizzazione è stata effettuata una volta a settimana in quantità costante nel 2002 a partire dall’otto luglio per un periodo di 16 settimane; in dosi proporzionali alla crescita delle piante nel 2003 e 2004, a partire dal sei maggio per un periodo di 20 settimane (per ulteriori dettagli si rimanda a [46]). Nell’inverno 2001, tutti gli alberi, che ormai avevano raggiunto l’altezza di circa 9 metri ([41]), sono stati ceduati ad un altezza di 5-8 cm sopra il livello del terreno. Durante la seconda rotazione (2002-2004), le ceppaie hanno prodotto molti polloni che non sono stati diradati. L’altezza degli alberi era in media 1.4-1.8 m alla fine della prima stagione vegetativa, 6-7 m dopo la seconda e quasi 10 m dopo la terza. La biomassa al termine del II ciclo di rotazione era stimolata dall’elevata CO2 di circa il 21%per la parte epigea e di circa il 32% per la parte ipogea. Il trattamento di fertilizzazione non aveva prodotto effetti significativi sulla biomassa, né interazioni con il trattamento CO2 ([38]).
Campionamento
Dopo la rimozione dello strato superficiale di lettiera, per ogni settore sono stati prelevati due campioni di suolo nello strato minerale alla profondità di 0-20 cm, per un totale di 36 campioni nelle parcelle non fertilizzate nel 2001 e 72 campioni per ogni data di campionamento da giugno 2002 ad ottobre 2004. Nel giugno 2002 i campioni sono stati prelevati anche nelle parcelle fertilizzate sebbene la somministrazione sia cominciata il mese successivo, quindi i dati relativi a quel campionamento sono stati esclusi dal calcolo dell’effetto del trattamento di fertilizzazione. Dopo il campionamento, il suolo è stato setacciato a 2 mm e conservato a 4 °C prima delle analisi.
Analisi
Il C del suolo è stato analizzato come C Organico Totale (TOC), come frazione stabile estraibile (TEC), comprensiva di acidi umici e acidi fulvici, e come frazione labile (LC). LC rappresenta la frazione attiva della sostanza organica in quanto substrato direttamente utilizzabile dai microorganismi ([17]). All’interno di tale frazione sono state analizzate le variazioni: i) della biomassa microbica (MBC), responsabile della decomposizione dei residui ed allo stesso tempo substrato per gli altri micro- e macro-organismi del suolo; ii) del C estraibile in K2SO4 (ExC), che include composti a labilità intermedia; iii) del C solubile in acqua (WSC), che rappresenta la fonte di C più facilmente e velocemente decomponibile nel suolo ([64]) ed il principale fattore limitante per la respirazione microbica nel suolo ([11]).
Per le analisi biochimiche il suolo è stato condizionato al 60% della capacità di ritenzione idrica (WHC) 24 ore prima delle analisi. Il Carbonio Organico Totale (TOC) e il C Estraibile Totale (TEC) sono stati determinati mediante ossidazione con K2Cr2O7 2N e successiva titolazione con Fe(NH4)2SO4 0.4N seguendo il metodo descritto in Springer & Klee ([58]). Il TEC era stato precedentemente estratto in NaOH/Na4P2O7 0.1M. Il C della Biomassa Microbica (MBC) è stato determinato seguendo il metodo della Fumigazione Estrazione (FE): due porzioni di suolo sono state portate al 60% della capacità di ritenzione idrica (WHC). Di queste, la prima è stata immediatamente estratta con K2SO4 0.5M e successivamente filtrata con filtri Whatman n. 42; la seconda è stata fumigata per 24 h a 25 °C con CHCl3 e successivamente estratta come la prima. Il C organico negli estratti è stato determinato mediante ossidazione con K2Cr2O7 0.4 N e successiva titolazione. Il C microbico è stato calcolato come segue: MBC = EC: kEC, dove EC è la differenza tra il C estratto nei suoli fumigati e il C estratto dai suoli non fumigati e kEC = 0.38 ([62]). Il C estratto nei suoli non fumigati rappresenta la frazione ExC, e la somma MBC + ExC rappresenta la frazione labile complessiva (LC) in accordo con Dumontet et al. ([17]). Il C solubile in H2O (WSC) è stato determinato con estrazione in acqua deionizzata a temperatura ambiente, ossidazione con K2Cr2O7 0.4 N e successiva titolazione secondo il metodo di Burford & Bremner ([8]).
Per la determinazione della respirazione microbica il suolo è stato incubato a 28 °C in fiasche con tappo ermetico, al cui interno sono stati aggiunti 2 ml di NaOH 1 N. La CO2 evoluta durante l’incubazione, intrappolata nella soluzione di NaOH, è stata determinata mediante titolazione con HCl 0.1M dopo 1, 3, 7 e 10 giorni ([4]). La CO2 evoluta cumulativamente nei 10 giorni di incubazione è stata espressa come frazione di TOC mineralizzata durante l’incubazione (qM), calcolata come (eqn. 1 - [51]):
Considerando la variabilità spaziale del contenuto iniziale di C organico nella piantagione ([28]) tutte le frazioni precedentemente descritte sono state espresse come porzione percentuale del TOC. La variazione temporale del TOC (ΔTOC) è stata calcolata come differenza in g TOC kg-1 rispetto al contenuto di C dell’anno precedente e complessivamente nel secondo ciclo (giugno 2002 - ottobre 2004).
Analisi statistica
Per valutare la significatività statistica degli effetti dell’elevata CO2, della fertilizzazione, delle variazioni temporali e delle loro interazioni sui parametri esaminati è stata utilizzata l’analisi della varianza a più fattori (ANOVA). Si è scelto di considerare il tempo come fattore di variazione al fine di tener conto delle modificazioni indotte dalle variazioni temporali e della loro interazione con i trattamenti. Le differenze indotte dai diversi genotipi non sono risultate significative, di conseguenza i dati relativi ai tre cloni sono stati raggruppati. La normalità dei dati è stata analizzata mediante il test Shapiro-Wilk. È stato applicato un disegno a blocchi randomizzati mediante la procedura di General Linear Model con CO2, N e tempo come fattori di variazione, usando la parcella come unità di replica. Per l’analisi statistica è stato utilizzato il pacchetto Systat 11.0 (SPSS Inc.). La significatività dell’effetto FACE è stata determinata nelle parcelle non fertilizzate per il periodo 2001 - 2004 (n = 18) e in tutte le parcelle per il periodo 2002-2004 (n = 36). Le interazioni non significative sono state escluse dall’analisi. Gli effetti FACE e fertilizzazione, riportati come variazione percentuale rispetto al controllo, sono stati calcolati per ogni parametro sul valore medio del periodo 2001 - 2004 per il FACE e del periodo ottobre 2002 - ottobre 2004 per la fertilizzazione.
Risultati
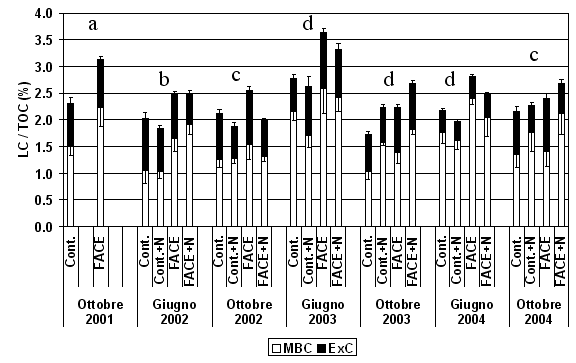
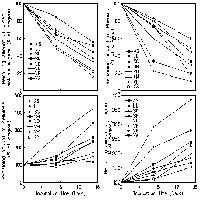
La frazione complessiva di C labile (LC) è variata nel corso delle stagioni e nei diversi anni, fra l’1.5% al 3.5% del TOC; i valori più elevati sono stati osservati a giugno 2003 (Fig. 1). L’elevata [CO2] ha aumentato significativamente (p<0.05) il contenuto di C labile nel suolo nei quattro anni di osservazione (Fig. 1, Tab. 1). L’aumento, mediamente pari al 24%, è stato osservato nei suoli fertilizzati e non fertilizzati e non sono state osservate interazioni significative tra i due trattamenti (Tab. 1). Diversamente, la fertilizzazione ha diminuito mediamente di circa il 4% la frazione labile di C nel suolo (p<0.01), principalmente a causa della riduzione dell’ExC (-19%; p<0.05; Tab. 1). Il peso relativo delle due componenti (MBC e ExC) sulla frazione labile complessiva non è stato modificato negli anni e non è stato influenzato dal trattamento FACE (Fig. 1). Diversamente, la fertilizzazione ha ridotto il peso relativo di ExC senza modificare quello di MBC.
Fig. 1 - C labile complessivo (C della biomassa microbica + C estraibile in K2SO4), espresso per unità di TOC. Sono riportati i valori nei suoli FACE e Controllo (Cont.) non fertilizzati per gli anni 2001-2004 e fertilizzati (+N) per gli anni 2002-2004. Lettere diverse identificano differenze significative tra gli anni (p<0.05).
Tab. 1 - Effetti medi percentuali dei trattamenti sul C estraibile totale (TEC), il C della biomassa microbica (MBC), il C estraibile in K2SO4 (ExC), il C labile complessivo (LC), il C solubile in H2O (WSC) ed il quoziente di mineralizzazione (qM). L’effetto FACE si riferisce ai suoli non fertilizzati per gli anni 2001-2004 e ai suoli fertilizzati (+N) per gli anni 2002-2004. L’effetto della fertilizzazione è riportato per i suoli FACE (F) e di Controllo (C). È riportata la significatività dei trattamenti, delle variazioni nel tempo e delle interazioni. Non sono riportati i valori per p>0.05.
| Tesi | TEC | MBC | ExC | LC | WSC | QM |
|---|---|---|---|---|---|---|
| FACE | -2% | +29% | +17% | +26% | +25% | +8% |
| FACE +N | +2% | +23% | +13% | +22% | +16% | -1% |
| Fertilizzazione [C] | +2% | +10% | -18% | -2% | -24% | -2% |
| Fertilizzazione [F] | +2% | +4% | -20% | -5% | -29% | -10% |
| Analisi della varianza | ||||||
| CO2 | n.s. | 0.004 | 0.012 | 0.019 | 0.020 | n.s. |
| Fertilizzazione | n.s. | n.s. | 0.012 | 0.001 | 0.010 | n.s. |
| var. temporale | n.s. | n.s. | n.s. | 0.000 | 0.000 | 0.000 |
| var. temp. x fert. | n.s. | n.s. | n.s. | 0.000 | n.s. | 0.031 |
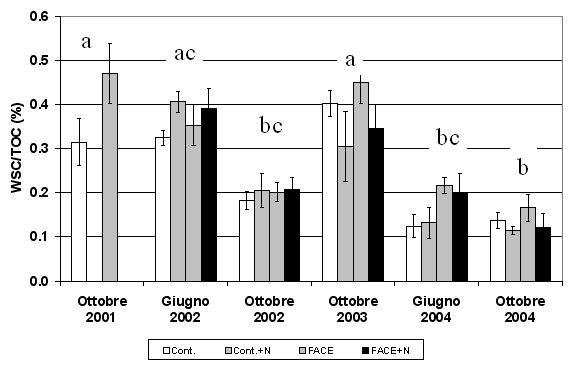
Anche la frazione di C labile solubile in acqua (WSC) ha mostrato significative variazioni fra le diverse date di campionamento, con valori compresi tra 0.1% e 0.5% del TOC (Fig. 2, Tab. 1). L’aumento a seguito dell’elevata CO2 è visibile in tutte le date di campionamento (Fig. 2) ed è stato in media pari al 13% (p<0.05 - Tab. 1). Diversamente, il WSC è diminuito a seguito del trattamento di fertilizzazione di circa l’8% (p<0.05 - Tab. 1), con effetti variabili fra le diverse date di campionamento (Fig. 2).
Fig. 2 - C solubile in acqua (WSC), espresso per unità di TOC. Sono riportati i valori nei suoli FACE e Controllo (Cont.) non fertilizzati per gli anni 2001-2004 e fertilizzati (+N) per gli anni 2002-2004. Lettere diverse identificano differenze significative tra gli anni (p<0.05).
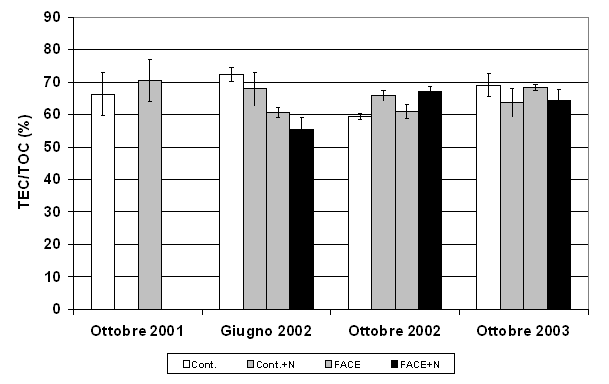
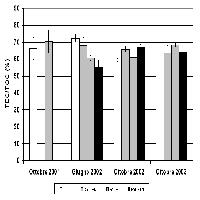
La frazione stabile del C organico estraibile (TEC), è rimasta costante negli anni, con valori intorno al 65% del TOC (Fig. 3). I trattamenti non hanno indotto modificazioni del contenuto di C estraibile (TEC - Tab. 1).
Fig. 3 - C estraibile totale (TEC), espresso per unità di TOC. Sono riportati i valori nei suoli FACE e Controllo (Cont.) non fertilizzati per gli anni 2001-2004 e fertilizzati (+N) per gli anni 2002-2003. Non sono state osservate differenze significative tra gli anni.
Diversamente, il contenuto di C organico totale (TOC) ha mostrato variazioni significative negli anni (Tab. 2). Ad eccezione di una riduzione verificatasi al termine della stagione vegetativa 2003, il C organico totale del suolo è aumentato in maniera significativa durante la prima (2001-2002) e terza stagione di crescita (2003-04), facendo registrare un aumento complessivo del 23% nel secondo ciclo colturale. L’elevata CO2 non ha modificato tale tendenza, mentre la fertilizzazione ha reso più marcata la riduzione osservata in tutti i trattamenti nel 2003 (Tab. 2).
Tab. 2 - Variazioni annuali dei valori di C organico totale e variazione complessiva nel secondo ciclo per i suoli FACE e di Controllo non fertilizzati e fertilizzati +N. È riportata la significatività dei trattamenti e delle variazioni nei diversi periodi. In parentesi è riportato l’errore standard.
| Tesi | Variazioni nel contenuto di C organico totale (g C kg-1) | |||
|---|---|---|---|---|
| Δ 2001-2002 |
Δ 2002-2003 |
Δ 2003-2004 |
Δ II ciclo |
|
| Controllo | +0.66 (0.65) | -0.37 (0.23) | +3.12 (0.45) | +2.53 (0.62) |
| FACE | +1.21 (0.22) | -0.38 (0.29) | +2.02 (0.87) | +1.96 (0.69) |
| Controllo +N | - | -1.42 (0.41) | +2.61 (1.10) | +2.41 (0.67) |
| FACE +N | - | -0.62 (0.19) | +3.10 (0.42) | +2.13 (0.41) |
| Analisi della varianza | ||||
| CO2 | n.s. | n.s. | n.s. | n.s. |
| Fertilizzazione | - | 0.049 | n.s. | n.s. |
| var. temporale | 0.000 | 0.000 | 0.000 | 0.000 |
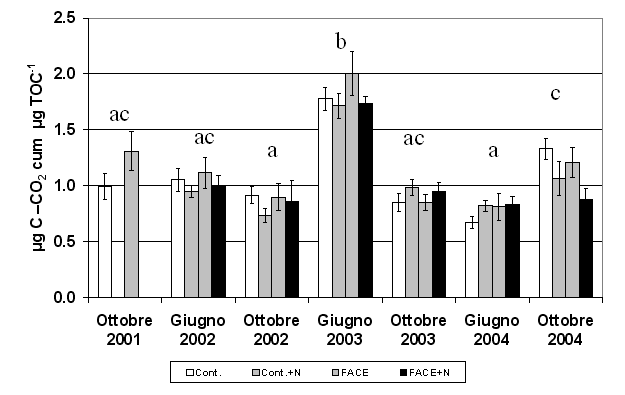
Il quoziente di mineralizzazione microbica (qM) è quasi raddoppiato nell’estate 2003 se confrontato con i valori medi determinati in tutte le altre date di campionamento (Fig. 4). L’elevata CO2 non ha determinato modificazioni significative dell’attività microbica, mentre la fertilizzazione ha avuto effetti opposti a seconda della data di campionamento (Fig. 4 e Tab. 1). In particolare nei plots fertilizzati si osservava una riduzione significativa (-23%, p<0.05) ad ottobre 2004 ed un incremento significativo (+13%, p<0.05) ad ottobre 2003.
Fig. 4 - Quoziente di mineralizzazione (qM), misurato come respirazione cumulativa in 10 giorni di incubazione espressa per unità di TOC. Sono riportati i valori nei suoli FACE e Controllo (Cont.) non fertilizzati per gli anni 2001-2004 e fertilizzati (+N) per gli anni 2002-2004. Lettere diverse identificano differenze significative tra gli anni (p<0.05).
Discussione
Variabilità temporale
La variabilità temporale del contenuto di C organico nella piantagione sembra essere strettamente legata all’attività di decomposizione microbica. Il picco di attività microbica registrato a giugno 2003 può essere infatti la causa della significativa riduzione del TOC osservata alla fine di quell’anno. Sebbene il picco di attività microbica e la successiva riduzione del TOC siano stati più pronunciati nel trattamento FACE non fertilizzato, l’effetto dell’elevata CO2 su tali parametri è risultato statisticamente non significativo. Pur tenendo conto che la respirazione microbica è stata misurata in condizioni potenziali di laboratorio, una possibile causa dell’incremento di attività microbica osservato nel giugno 2003 può essere legata al particolare andamento climatico di quell’anno. Nel 2003 sono state infatti registrate temperature primaverili-estive particolarmente elevate in tutta Europa ([42]) che, unite alla disponibilità idrica nella piantagione, possono aver favorito l’attività di decomposizione microbica del suolo ([33], [50]), confermando la perdita di C riscontrata su vasta scala da Ciais et al. ([12]) per quell’anno. Non si può escludere però anche un effetto “memoria” della ceduazione del 2002, legato all’accumulo di lettiera radicale disponibile quindi per una sostenuta attività di decomposizione. [61] hanno osservato un’analoga diminuzione di C organico dopo il taglio di ceduazione in una piantagione di P. deltoides, particolarmente evidente durante la successiva stagione di crescita. Si ritiene quindi che la concomitanza di fattori favorevoli per l’attività microbica (temperature elevate, disponibilità idrica e disponibilità di substrati) possa aver determinato la diminuzione del C organico osservata nell’anno 2003. La maggiore disponibilità di N nei suoli fertilizzati ha ulteriormente alimentato l’attività di decomposizione microbica, determinando maggiori perdite di C organico. Questo effetto positivo di breve termine della fertilizzazione azotata sulla mineralizzazione della sostanza organica è tuttavia in contrasto con l’effetto di segno negativo spesso osservato nel lungo termine ([7]).
In ogni caso, la riduzione del 2003 è stato un fenomeno temporaneo, e complessivamente la piantagione ha favorito l’accumulo di C organico nel suolo, con un incremento del 23% nel secondo ciclo colturale. Tale accumulo è stato indipendente dai trattamenti, evidenziando un ruolo positivo delle piantagioni forestali (anche a ciclo breve) sull’immagazzinamento di C, quando sono realizzate su suoli precedentemente destinati alle colture agrarie. Studi effettuati in diversi ambienti riportano aumenti percentuali nel contenuto di C organico nel terreno a seguito di interventi di afforestazione comparabili con i risultati ottenuti in questo studio ([52], [22], [55]). Cambiamenti di uso del suolo da colture agrarie a SRF riportano in genere aumenti del contenuto di C nel suolo estremamente variabili, in alcuni casi presentando una diminuzione iniziale nei primi anni dall’impianto ([21]), che tuttavia non è stata osservata nel presente studio. Aumenti più consistenti, comparabili con quelli riportati in questo studio, sono stati osservati nei primi 20 cm nel caso di valori di C iniziale relativamente bassi ([13]), o a seguito di pratiche irrigue o di fertilizzazione ([43]). Hansen ([25]) osservava incrementi simili, dell’ordine di 1-2 t ha-1 anno-1, in piantagioni di pioppi ibridi. Nella SRF oggetto di questo studio, l’elevata capacità di accumulare C anche nel breve termine è stata la diretta conseguenza dei rilevanti apporti di sostanza organica al suolo, derivanti dalla lettiera fogliare ([29]), dal turnover radicale e dalle micorrize ([20]).
Elevata CO2 atmosferica
L’elevata CO2 può aumentare gli apporti di C organico al suolo attraverso incrementi della produttività e del turnover delle radici fini ([26]). Nella stazione sperimentale POPFACE Lukac et al. ([39]) e Godbold et al. ([20]) hanno riportato significativi aumenti della produttività e del turnover delle radici fini a seguito dell’elevata CO2, a cui però non ha corrisposto una modificazione dell’attività microbica (questo studio).
Il legame tra le frazioni labili della sostanza organica, la produttività radicale e l’attività microbica è ben spiegato dal meccanismo del priming effect ([34]). [61] hanno osservato un aumento dei tassi di decomposizione e la conseguente diminuzione del C organico del suolo in elevata CO2, a seguito dell’incremento degli input carboniosi labili. Nella stazione sperimentale POPFACE Hoosbeek et al. ([28]), osservando la perdita di C organico nei primi 10 cm di suolo minerale, hanno ipotizzato un meccanismo priming in elevata CO2, che tuttavia si è esaurito nel primo ciclo colturale. Infatti, Hoosbeek et al. ([27]), Hoosbeek & Scarascia Mugnozza ([29]) hanno determinato nel secondo ciclo colturale un accumulo di C organico, che ha compensato la perdita osservata nel primo ciclo colturale. Hu et al. ([30]) hanno riportato cambiamenti temporali nelle modificazioni indotte dall’elevata CO2 sui processi microbici in seguito a cambiamenti della disponibilità di N nel suolo. Tuttavia, la fertilizzazione azotata non ha modificato l’accumulo di C nel suolo in elevata CO2, suggerendo che, oltre alla disponibilità di N, altri fattori possano aver contribuito a limitare i processi microbici nel suolo. Analizzando le modificazioni qualitative avvenute a carico di alcune frazioni della sostanza organica, si ritiene che il più elevato rapporto C/N della lettiera ([14]) e della sostanza organica labile ([37]), possano avere ridotto la capacità dei microrganismi di decomporre i substrati disponibili. L’effetto dell’elevata CO2 sul rapporto C/N delle frazioni labili del suolo è simile nei suoli fertilizzati e non fertilizzati e non sono state osservate interazioni tra i due trattamenti per nessuno dei parametri esaminati. In conseguenza della minore qualità dei substrati, il surplus di C labile in elevata CO2 sembra essere quindi stato accumulato nelle cellule microbiche, come dimostrato dall’aumento del C microbico. Il rapporto tra C microbico e TOC è considerato un indicatore precoce di modificazioni del contenuto di sostanza organica nel lungo termine ([3], [2]), più difficili da identificare nel breve termine a causa della grande quantità di C nel suolo ([54], [31], [56]). Dai nostri dati l’aumento di TOC conseguente all’impianto della SRF non è stato modificato dall’elevata CO2 dopo 6 anni di trattamento ma, ferme restando le condizioni nutritive del suolo e la qualità degli apporti organici, è possibile ipotizzare una tendenza all’accumulo di C in elevata CO2 in tali sistemi forestali.
Fertilizzazione azotata
La diminuzione del C delle frazioni labili a seguito della fertilizzazione può essere imputabile ad una riduzione della disponibilità di C per i microorganismi attraverso i) la condensazione con l’humus ([47]); ii) la repressione dell’attività dei funghi ligninolitici ([32]) e iii) la variazione della qualità della lettiera ([5]). Tuttavia, l’assenza di chiari effetti su biomassa e respirazione microbica (questo studio) fa supporre che nel nostro sito sperimentale la minore produttività radicale ([38]) possa aver ridotto gli apporti di sostanza organica e di conseguenza il contenuto di C labile nei suoli fertilizzati.
Per quanto riguarda la frazione stabile ed il TOC, studi riguardanti l’effetto della fertilizzazione indicano spesso un aumento del C organico nel suolo ([6], [44], [60]). Tuttavia, tale effetto può dipendere dal tipo di suolo ([23]) o dalle dosi e dal tipo di fertilizzante usato ([53]). Nel nostro studio sono state osservate variazioni temporali di breve termine a seguito della fertilizzazione sia nel contenuto di C organico, sia nell’attività di mineralizzazione microbica del suolo. Considerando i tre anni, tuttavia, l’effetto è stato statisticamente nullo ed il rapido aumento del C organico del suolo negli ultimi due anni del secondo ciclo colturale ha pienamente compensato la perdita osservata nel 2003.
In conclusione si può affermare che, indipendentemente dai trattamenti, la piantagione ha favorito negli anni l’accumulo di C organico nel suolo. L’elevata concentrazione di CO2 nell’atmosfera non ha modificato tale tendenza, ma ulteriori studi potrebbero evidenziare un effetto positivo nel lungo periodo, in conseguenza dei maggiori apporti di sostanza organica al suolo e della loro ridotta decomponibilità. Il trattamento di fertilizzazione, pur riducendo le frazioni labili, ha determinato variazioni di breve termine del contenuto di C organico del suolo, senza modificazioni complessive nel secondo ciclo colturale.
Ringraziamenti
Ricerca svolta grazie al progetto CE EUROFACE (EVR1-CT-2002-40027) e MIUR Centro di Eccellenza “Foreste & Clima”, coordinati dal Prof. Giuseppe Scarascia Mugnozza.
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar