Climate change in the Mediterranean basin: a case study on carbon cycle in a forest of southern Italy
Forest@ - Journal of Silviculture and Forest Ecology, Volume 2, Pages 52-65 (2005)
doi: https://doi.org/10.3832/efor0259-0020052
Published: Mar 10, 2005 - Copyright © 2005 SISEF
Research Articles
Guest Editors: Matera Meeting (2004)
« Climate change and pollution: effects on the southern Italian forests »
Collection/Special Issue: Elena Paoletti
Abstract
Climate change in the Mediterranean basin: a case study on carbon cycle in a forest of southern Italy. Since the industrial revolution, the increased burning of fossil fuels has caused large emissions of greenhouse gases in the atmosphere with, as a consequence, the increase of their atmospheric concentration, particularly in the case of carbon dioxide. This increase is proven by long-term atmospheric monitoring and it is related to relevant climate changes as increased mean temperatures and frequency of extreme events (flooding, heat waves, etc.). In this respect, the Mediterranean area is one of those that, according to forecasts and simulations, will suffer mostly from these changes. This will be particularly true for mountainous areas already subjected to significant pressures. The paper presents data on climate, net carbon exchange trends and their relationships measured during 15 months in a 35-years-old pine forest (Pinus laricio Poiret, Sila Greca, 1.175 m a.s.l., Longobucco, CS, Southern Italy). The experimental site is equipped with micrometeorological sensors and with the instrumentation to measure net carbon exchange at ecosystem level with the eddy covariance technique. The site has been established to study carbon and water cycle dynamics of this important Southern Italian ecosystem, in order to better understand ecosystem responses to environmental factors and climate change. Preliminary data point to the fact that the pine forest is a carbon sink practically all-year-round. Soil water availability and atmospheric evaporative demand proved to be important and concurrent factors in determining adaptative responses by the ecosystem. The study will continue in the coming years, in order to reach a better reliability of carbon balance monthly and annual sums particularly by improving the estimate of ecosystem respiration and its components (storage and advection terms, soil respiration) and to verify interannual and long-term responses to climate.
Keywords
Forest, Eddy covariance, Carbon balance, Pinus laricio, Southern Italy
Introduzione
A partire dalla rivoluzione industriale, la concentrazione atmosferica di anidride carbonica (CO2) ha cominciato un significativo trend di crescita: la sua concentrazione è passata da 280 ppm a circa 360-370 ppm negli ultimi 200 anni ([13], [25]). Le variazioni annuali della concentrazione di CO2 sono dovute allo squilibrio tra il tasso di emissione e di assorbimento dello stesso gas; la CO2 viene infatti emessa dai processi antropogenici di combustione di fonti fossili (petrolio, carbone, gas) e di deforestazione nelle fasce tropicali (quasi sempre realizzata tramite incendio) e dai processi naturali di respirazione delle piante (autotrofa) e degli organismi eterotrofi (soprattutto a livello del suolo), mentre viene assorbita dagli oceani e dalle piante mediante la fotosintesi.
Un aumento delle concentrazioni di CO2 può avere effetti negativi ma anche, in parte, positivi. Il principale effetto negativo è legato al ruolo dell’anidride carbonica come gas-serra: infatti il costante aumento della temperatura degli ultimi decenni è stato messo in relazione diretta, con sempre maggiore affidabilità, con il parallelo aumento della concentrazione di questo gas ([28]). D’altro canto, i potenziali benefici sono legati alla stimolazione dell’attività fotosintetica e a un miglioramento dell’efficienza dell’uso idrico delle piante ([16], [35], [21]; [23]). L’effetto fertilizzante dell’aumento di CO2 può essere peraltro ridotto o neutralizzato dall’eventuale presenza di fattori limitanti, quali la disponibilità di azoto nel suolo, o dal possibile incremento della respirazione, sia delle piante che del suolo, stimolata dall’aumento della temperatura dell’aria ([32], [33], [34]).
Una migliore conoscenza del ciclo del carbonio negli ecosistemi terrestri, sia a livello regionale che globale, è necessaria per poter meglio comprendere le sue risposte ai fattori climatici ed ecologici ed alle loro perturbazioni.
A livello globale, nell’ultimo decennio del XX secolo, delle circa 7 GtC emesse annualmente dalle attività antropiche, il 40 - 60 % è rimasto in atmosfera ([43], [13]), mentre evidenze sperimentali sempre maggiori indicano che la restante parte viene assorbita dagli oceani e dagli ecosistemi terrestri ma con notevole variabilità interannuale. Da questo punto di vista, è dibattuto il contributo relativo dei diversi biomi forestali quali accettori di carbonio ([24], [44], [15], [19], [11], [20], [42], [17], [37], [49]).
Le foreste svolgono un ruolo importante nel controllo della dinamica dei cambiamenti globali del clima, proprio per la parte che esse hanno nel ciclo del carbonio; d’altra parte la loro funzionalità e sopravvivenza è fortemente influenzata e minacciata da tali cambiamenti. Diversi studi, basati su simulazioni modellistiche, prevedono che l’impatto dei cambiamenti globali sarà maggiore nelle aree a già forte tensione, sia climatica (alte temperature, scarsa piovosità), che per pressioni antropiche: a tal proposito, per la situazione italiana, la parte meridionale del paese e le aree montane possono essere considerate maggiormente a rischio.
Per capire e quantificare meglio il ruolo delle foreste nel bilancio globale di carbonio è necessario svolgere studi di lungo periodo finalizzati alla stima dell’assorbimento netto di carbonio dell’ecosistema forestale. I classici metodi inventariali forniscono stime pluri-annuali della produzione primaria netta, basandosi su relazioni allometriche tra il diametro a petto d’uomo e la biomassa delle piante ([8], [12]). Le relazioni allometriche sono spesso limitate alla sola componente epigea, sono sviluppate per lo più per formazioni coetanee e monospecifiche e, per loro natura, non considerano le dinamiche del suolo che, insieme ai processi di produzione primaria, determinano il bilancio netto di ecosistema.
Negli ultimi anni la tecnica micrometeorologica della correlazione turbolenta (eddy covariance) si è affermata come metodo alternativo per la valutazione quantitativa degli scambi di carbonio a scala di ecosistema ([3], [6], [41], [9], [4], [46]). Il successo di questa tecnica è legato principalmente a tre fattori: i) la tecnica permette la stima diretta, non distruttiva, dello scambio netto di carbonio tra foresta e atmosfera: ciò significa che il flusso misurato rappresenta il bilancio netto tra l’assorbimento di CO2 per via fotosintetica e l’emissione dello stesso gas causata dai processi respiratori, sia autotrofi che eterotrofi; ii) il flusso misurato è relativo a un’area relativamente estesa (qualche ettaro) sopravento al punto di misura e, a ogni valore di flusso, si può associare una “footprint”, ovvero un’area che racchiude le sorgenti e gli assorbitori di CO2 che determinano il dato misurato; iii) la tecnica della correlazione turbolenta è capace di monitorare in continuo gli scambi di carbonio, offrendo la possibilità di ottenere un bilancio di carbonio su scala giornaliera, mensile, annuale e anche pluriannuale, consentendo di studiare dinamiche di lungo termine e l’eventuale impatto dei cambiamenti climatici e delle operazioni di gestione sul ciclo del carbonio di ecosistemi forestali.
Oltre a queste caratteristiche legate allo studio del bilancio di carbonio, questa tecnica micrometeorologica si è dimostrata particolarmente adatta allo studio dell’ecofisiologia dell’ecosistema. Infatti essa può essere impiegata per analizzare la risposta dei flussi di anidride carbonica alle variabili climatiche, quali temperatura, umidità e radiazione solare ([27], [29], [46]), e la variazione dell’assorbimento di carbonio con l’età del popolamento o a seguito di interventi selvicolturali ([29], [26]).
La regione mediterranea è una delle aree critiche del globo negli scenari dei futuri cambiamenti globali: nonostante ciò, le conoscenze sul bilancio del carbonio delle foreste mediterranee sono ancora piuttosto limitate ([48], [45], [39]). Attualmente, il numero di siti europei nei quali viene misurato lo scambio diretto di carbonio tramite la tecnica di correlazione turbolenta (eddy covariance) è maggiore di 100. Tuttavia, sebbene una delle prime applicazioni della tecnica in ecosistemi forestali sia stata fatta su una macchia mediterranea ([47]), attualmente sono molto pochi i siti mediterranei nei quali vengono effettuate misure di scambio di carbonio a scala di ecosistema.
La presente ricerca punta a migliorare la comprensione dei meccanismi che stanno alla base degli scambi di carbonio tra foresta e atmosfera. Si è scelto, come oggetto di questo studio, un ecosistema forestale molto importante per l’estrema area meridionale dell’Italia, ovvero le pinete di pino laricio. Per le loro caratteristiche (areale, esigenze pedo-climatiche), esse offrono la possibilità di aggiungere un prezioso tassello alla conoscenza del bilancio di carbonio nell’ambito delle fitocenosi mediterranee ([30]).
Materiali e Metodi
Area di studio
Le misure presentate in questo lavoro sono state svolte in una pineta di Pino laricio (Pinus laricio Poiret) ubicata in Sila Greca (località Cozzarella-Don Bruno, comune di Longobucco, Cosenza), nel bacino idrografico del torrente Bonis (39°28’40“N, 16°32’05” E, 1175 m s.l.m.). Si tratta di una pineta artificiale di circa 35 anni, impiantata su ex-pascoli e diradata nel 1986. La morfologia è leggermente ondulata. Il substrato geologico è costituito da rocce granitiche; i suoli rientrano nell’associazione Ultic Haploxeralfs, caratterizzati da un orizzonte argilloso con argilla illuviale concentrata, spesso, anche in lamelle ([14], [10]); non si riscontrano segni importanti di erosione. Dal punto di vista fitoclimatico l’area è ascrivibile al Fagetum sottozona calda ([36]); i dati climatici relativi alla vicina stazione di Cecita (Cs) (gestita dal Servizio Idrografico e Mareografico Italiano) indicano una precipitazione media annua di 1124 mm, una temperatura media del mese più freddo di 1°C e una temperatura del mese più caldo di 17.1°C; la temperatura media annua è di 8.7°C; sul piano fitosociologico, la pineta è riferibile all’associazione Hypochoerido-Pinetum laricionis, che può impiantarsi in ambienti scoperti formando consorzi che in generale risultano abbastanza radi. Nello strato arbustivo si rinvengono Cytisus scoparius, Rubus fruticosus e, talvolta, Erica arborea; tra le specie dello strato erbaceo si trovano Hypochoeris levigata, Euphorbia amygdaloides ssp. arbuscula, Anemone apennina, Lathyrus pratensis, Pteridium aquilinum, Dactylis glomerata, Pimpinella anysoides ([38]). All’interno di questa pineta è stata scelta un’area dell’estensione di 1600 m2 (40 x 40 m), all’interno della quale sono stati effettuati i rilievi dendrometrici che hanno fornito i seguenti risultati: 637 alberi per ettaro, con area basimetrica di 45.4 m2 ha-1, diametro medio di 29 cm e altezza media di 21.5 m; l’indice di area fogliare, misurato con il LAI-2000 (LiCor, Lincoln, Nebraska) è risultato di 6.6 ± 0.18 m2 m-2 (valori corretti considerando un rapporto foglie/getti di 1.6).
Misure micrometeorologiche
All’interno di quest’area di saggio, è stata installata una torre metallica alta 16 m. Alla sommitàè stato installato un palo telescopico in acciaio di 9 m per arrivare al di sopra della copertura. Sulla torre è stata installata la maggior parte della sensoristica micrometeorologica, mentre sul palo aggiuntivo è stato installato l’anemometro sonico e il tubo di campionamento dell’aria per la misura delle concentrazioni in aria di anidride carbonica e vapor acqueo.
La strumentazione installata consiste in:
- 5 pannelli solari, di cui 2 da 110 W e 2 da 70 W situati a 16 m di altezza;
- 4 batterie 6 V x 240 Ah collegate a due a due in serie, e poi in parallelo;
- strumentazione per la misura degli scambi di CO2e vapore acqueo composta da: (i) Analizzatore di gas “closed path” a risposta veloce LiCor 7000 (LiCor, Lincoln, Nebraska - USA); (ii) Anemometro sonico CSAT-3 (Campbell Scientific, Logan, Utah, USA); (iii) Pompa “brushless” da 11 l min-l (KNF Neuberger GmbH, Germany); (iv) Data-logger CR 5000 della Campbell (Campbell Scientific) utilizzato sia per la raccolta dei dati ad alta frequenza (20 Hz) per la misura della turbolenza e dei flussi, sia per la raccolta dei dati micrometeorologici.
- Sensori micrometeorologici per la misura di: (i) Radiazione netta (sensore Middleton, Brunswick, Victoria, Australia); (ii) Radiazione solare globale incidente e riflessa (sensore CM5, Kipp&Zonen, Delft, The Netherlands); (iii) Radiazione fotosinteticamente attiva (sensore PAR, LiCor, Lincoln, Nebraska - USA); (iv) Temperatura e umidità dell’aria al di sopra delle chiome e temperatura del suolo fra 5 e 20 cm di profondità (sensori MICROS Srl, Treviso, Italy); (v) Flusso di calore del suolo (sensore REBS, Campbell); (vi) Contenuto idrico del suolo 0-30 cm (sensore CS615, Seattle, Washington, USA); (vii) Pluviometro a bascula (sensore MICROS, Italia);
La strumentazione per le misure micrometeorologiche e per la misura dello scambio di carbonio e di vapore acqueo è stata installata a fine Maggio 2003 e ha cominciato a raccogliere dati dal 1° giugno 2003. Il 1° Novembre 2003, in seguito ad una bufera di vento e pioggia, l’anemometro sonico è stato seriamente danneggiato, rendendo necessario il suo invio per riparazione alla casa costruttrice. La stazione ha proseguito il monitoraggio microclimatico, mentre la piena funzionalitàè stata riacquisita ai primi di marzo del 2004, quando è stato installato nuovamente l’anemometro sonico.
Fondamenti della tecnica eddy covariance
La misura dello scambio di carbonio a livello di copertura è condotta con la tecnica eddy covariance (EC), che a sua volta si basa sulla teoria della dinamica dei fluidi ed è stata applicata a sistemi forestali a partire dalla fine degli anni ’80 ([3]).
L’equazione di conservazione di uno scalare (eqn. 1) è la base teorica della tecnica EC (v. [1]):
Quest’equazione ci dice che la variazione temporale della concentrazione di uno scalare C in un dato punto dello spazio (termine I) e l’advezione locale (termine II) sono bilanciate dalla divergenza (o dalla convergenza) media orizzontale e verticale del flusso turbolento (termine III), dalla diffusione molecolare (termine IV) e da un termine che rappresenta i processi di formazione (o di distruzione) delle molecole dello scalare considerato (termine V). Quanto detto si traduce nella formulazione matematica di derivate parziali riportata dall’eq. 1, che è valida per un volume d’aria di dimensioni infinitesime, dove C è il rapporto di mescolanza del generico scalare, u, v e w sono le tre componenti della velocità del vento, rispettivamente nelle due direzione spaziali orizzontali x, y e in quella verticale z. Il termine D rappresenta il processo di diffusione molecolare, mentre Sc è il termine che riassume i processi di formazione/distruzione delle molecole di scalare. La barra verticale riportata sulle diverse variabili indica la loro media temporale, mentre l’apice riportato per le variabili del termine III dell’equazione denota la fluttuazione istantanea del valore attorno al valore medio; il valore medio del prodotto tra le fluttuazioni istantanee di due variabili rappresenta la covarianza statistica. Le covarianze tra le tre componenti della velocità del vento e la concentrazione dello scalare rappresentano i flussi turbolenti lungo le tre direzioni dello spazio x, y e z.
Il rapporto di mescolanza di uno scalare in un volume di aria rimane invariato nel tempo se il flusso entrante di molecole dello scalare eguaglia quello in uscita; il volume di aria ad ogni istante sarà interessato da un flusso advettivo medio e dalla divergenza/convergenza del flusso turbolento. L’advezione è presente se il gradiente spaziale medio del rapporto di mescolanza non è nullo; la convergenza del flusso turbolento si verifica quando il flusso tridimensionale entrante nella particella è minore di quello uscente, mentre la divergenza ha luogo se il flusso uscente è maggiore di quello entrante. La diffusione molecolare e i gradienti laterali lungo la direzione orizzontale y sono generalmente trascurabili rispetto agli altri termini dell’eq. 1 ([7], [22]). Il termine Sc esprime il bilancio tra la produzione e la distruzione (trasformazione) dello scalare operate dalle sorgenti e dagli assorbitori biologici presenti nel volume di aria.
Ipotizzando che il gradiente orizzontale (lungo x ed y) del flusso turbolento sia nullo e integrando l’eq. 1 lungo la verticale z, otteniamo l’eqn. 2:
dove il termine I rappresenta lo scambio netto di ecosistema del generico scalare relativo al volume di aria la cui altezza è zm, e risultante dal bilancio netto tra i processi di formazione e quelli di distruzione (trasformazione); il termine II è il flusso verticale turbolento misurato alla quota zm che corrisponde alla quota in cui sono posizionati gli strumenti di misura richiesti dalla tecnica EC. Il termine III rappresenta l’accumulo (storage) dello scalare sotto la quota zm: questo termine rappresenta la variazione nel tempo della concentrazione dello scalare nella colonna d’aria al di sotto di zm. Gli ultimi due termini dell’eq. 2 sono i flussi advettivi nella direzione orizzontale x e in quella verticale z. Ipotizzando di trovarsi in condizioni di omogeneità orizzontale (assenza di gradienti orizzontali di concentrazione) e di stazionarietà atmosferica dall’eq. 2 si ottiene l’eqn. 3:
dove il termine a destra è una covarianza misurabile direttamente dai sistemi EC attualmente disponibili, i quali sono costituiti da un anemometro ultrasonico e da un analizzatore per la determinazione della concentrazione di uno o più scalari di interesse ecologico. Sia l’anemometro che l’analizzatore devono avere tempi di risposta molto rapidi, in modo tale da misurare anche le piccole fluttuazioni di concentrazione e di velocità del vento che avvengono su una scala temporale dell’ordine dei decimi di secondo. La necessità di avere strumenti a risposta veloce è strettamente legata alla natura del trasporto turbolento in atmosfera. I vortici di aria che percorrono la parte più bassa della troposfera sono masse d’aria animate da un moto turbolento; il carattere turbolento del loro moto determina in un dato punto dello spazio delle fluttuazioni stocastiche sia nella concentrazione di un particolare scalare che nella velocità del vento. Queste fluttuazioni altro non sono che i termini che compaiono nell’eq. 3 e che costituiscono il flusso turbolento verticale; da un punto di vista statistico maggiore è il numero di fluttuazioni misurate in dato intervallo temporale e maggiore sarà la rappresentatività statistica della stima di flusso.
Le ipotesi impiegate per dedurre l’eqn. 3 partendo dall’equazione completa del bilancio di massa sono essenzialmente due: omogeneità orizzontale del sito in cui vengono fatte le misure e stazionarietà atmosferica. L’ipotesi di omogeneità si riferisce alla disposizione spaziale delle sorgenti e degli assorbitori dello scalare, e alle caratteristiche orografiche e di rugosità dell’ecosistema studiato. In particolare secondo questa ipotesi le sorgenti e gli assorbitori devono essere distribuiti uniformemente nel piano orizzontale, così come gli elementi fisici (ad esempio le piante in un ecosistema forestale) che determinano la rugosità del sito. Inoltre il terreno deve essere pianeggiante.
Oltre all’ipotesi di omogeneità c’è quella di stazionarietà dell’atmosfera, ovvero il valore medio delle variabili fisiche che descrivono lo stato dell’atmosfera non deve cambiare nel tempo. Quest’ipotesi è vera se si considerano finestre temporali inferiori a 60 minuti ([22], [18]) e generalmente i flussi stimati con la tecnica EC si riferiscono a intervalli di 30 minuti.
L’ipotesi di stazionarietàè generalmente rispettata nella realtà, mentre per quella di omogeneitàè necessario scegliere il sito di misura rispettando specifici criteri. Tuttavia l’esigenza di studiare ecosistemi vegetali localizzati in zone ad orografia complessa ha spinto i ricercatori a sviluppare metodi per correggere le misure ottenute dalla tecnica EC ([1], [5], [31], [2]). Generalmente queste correzioni vengono implementate nei periodi notturni in cui il rimescolamento turbolento dell’atmosfera è fortemente ridotto; in questi casi infatti i termini III, IV e V in eqn. 2 non possono essere più considerati trascurabili rispetto al termine II. Le procedure di correzione adottate sono di due tipi: sostituire il dato misurato con il flusso stimato tramite una parametrizzazione empirica, o misurare direttamente tutti i termini dell’eq. 2. La sostituzione dei dati di flusso misurati in periodi di bassa turbolenza si basa sull’uso di funzioni empiriche che esprimono la dipendenza del flusso da specifiche variabili climatiche. Queste funzioni vengono costruite mediante una regressione statistica tra i flussi misurati in condizioni di elevata turbolenza e i corrispondenti valori delle variabili climatiche.
Risultati e discussione
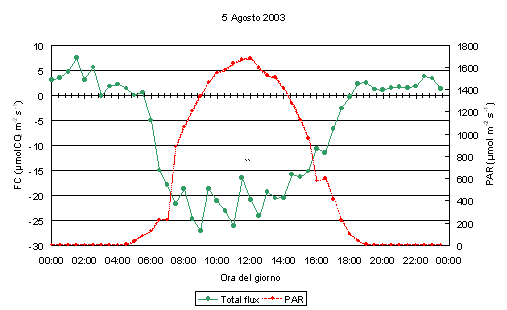
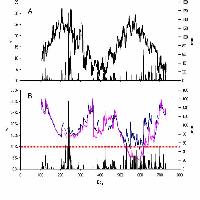
L’andamento dei flussi di CO2 durante una giornata estiva (5 agosto 2003) è riportato in Fig. 1; è ben visibile come in fase notturna i flussi presentino valori positivi, indicando attività respirativa (emissione di CO2 verso l’atmosfera), mentre risultano negativi, indicando assorbimento netto di carbonio, fra le ore 6 e le 19, con valori più elevati di assorbimento tra le 9 e le 13.
Fig. 1 - Andamento giornaliero degli scambi di CO2 con la tecnica eddy covariance in una pineta di pino laricio sulla Sila Greca. I valori di scambio netto di CO2 (FC, in verde, μmol CO2 m-2 s-1) sono riportati sull’asse delle ordinate di sinistra, mentre i valori di radiazione fotosinteticamente attiva (PAR, in rosso, μmol fotoni m-2 s-1) sull’asse di destra.
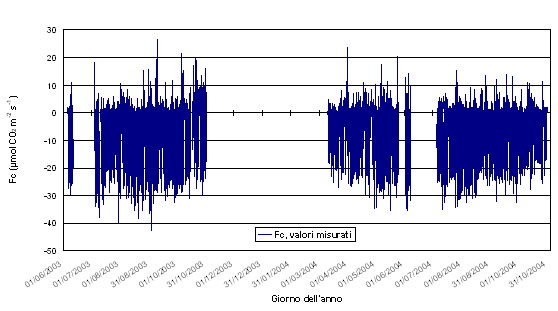
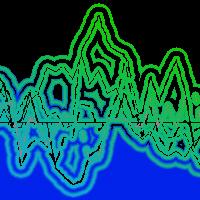
I dati riportati in Fig. 2 rappresentano i valori di scambio netto di CO2 (FC) misurati nel periodo tra giugno 2003 e ottobre 2004, comprensivi della componente di accumulo di CO2 all’interno della copertura. È possibile valutare il range dei valori assoluti minimi e massimi nell’arco dei 16 mesi: per quanto riguarda i valori massimi giornalieri di assorbimento netto, sono compresi fra 10-14 (in ottobre e marzo) e 30-40 μmol CO2 m-2 s-1 (estate 2003), mentre la respirazione notturna varia da 1 fino a 10-25 μmol CO2 m-2 s-1.
Fig. 2 - Serie dei valori (medie su 30 minuti) di flusso di CO2 (Fc, μmol CO2 m-2 s-1) misurati da giugno 2003 a ottobre 2004.
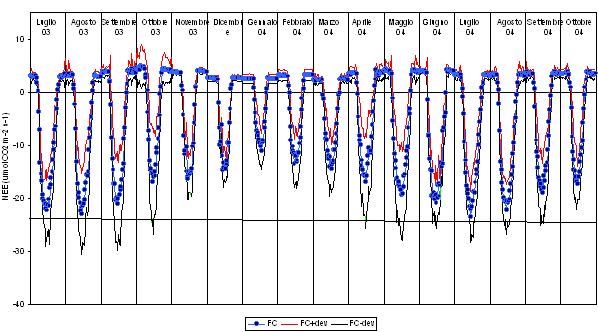
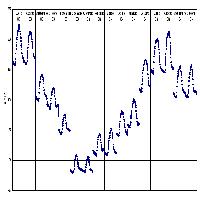
A partire dai valori medi mensili (stimati, in caso di mancanza di dati, con tecniche di gap filling che utilizzano relazioni funzionali tra parametri climatici e scambio di carbonio) e dai flussi giornalieri misurati in un arco temporale di 15 mesi, sono stati anche ricostruiti gli andamenti giornalieri di NEE (Fig. 3).
Fig. 3 - Andamento giornaliero dello scambio netto di carbonio dell’ecosistema (NEE, in μmol CO2 m-2 s-1) nel periodo luglio 2003 - ottobre 2004, ricostruito sulla base delle medie mensili dei dati misurati ogni 30 minuti. La linea azzurra indica i valori di NEE, quella rossa NEE più la deviazione standard, quella nera NEE meno la deviazione standard.
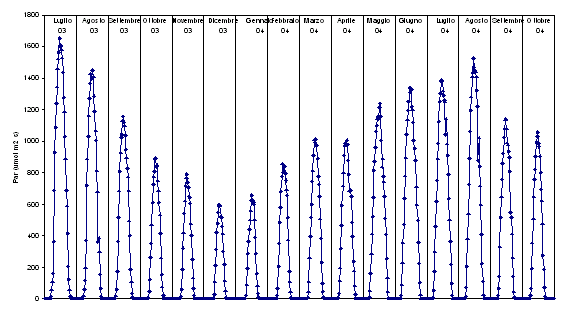
Nelle Fig. 4, 5, 6 e 7 si riportano gli andamenti giornalieri della variabili ambientali, utili per meglio interpretare le variazioni temporali dei flussi.
Fig. 4 - Andamento medio giornaliero della radiazione fotosinteticamente attiva (PAR, μmol m-2 s-1) calcolato in base alle medie mensili dei dati misurati ogni 30 minuti.
È possibile fare alcune considerazioni sulla stagionalità dei flussi dal punto di vista orario e quantitativo. Nel periodo estivo l’attività fotosintetica ha inizio intorno alle ore 5.30 (ora solare), presentando picchi di assorbimento tra le 9.30 e le 11; dopo le 13, la fase di assorbimento decresce e si registrano valori decrescenti di NEE; intorno alle 18.30 si registra il passaggio dalla fase di assorbimento a quella di rilascio di CO2 e dalle ore 19 inizia la vera e propria respirazione, evidenziata dai valori positivi dei flussi. In autunno l’inizio della fotosintesi è traslato di circa 60-90 minuti rispetto all’estate; in gennaio la fotosintesi inizia intorno alle 8 e termina alle 16.30. Man mano che si allunga il fotoperiodo, in primavera, la fase di assorbimento inizia prima e finisce dopo. Per quanto concerne gli aspetti quantitativi della CO2 assorbita e respirata nel corso delle stagioni, dalla Fig. 3 è ben visibile che è l’estate il periodo in cui l’ecosistema è in grado di assorbire una maggiore quantità di anidride carbonica (media dei valori massimi compresa tra 22 e 23 μmol CO2 m-2 s-1); quantità che va riducendosi progressivamente in autunno ed inverno. In autunno la quantità di anidride carbonica assorbita assume valori compresi tra 21 e 16 μmol CO2 m-2 s-1, rispettivamente a settembre e a novembre; gennaio è il mese in cui l’ecosistema assorbe di meno. A partire da febbraio l’aliquota fotosintetica dei flussi inizia nuovamente ad aumentare, fino all’estate successiva, con valori che vanno dalle 14, in marzo, alle 21-24 μmol CO2 m-2 s-1 in giugno-luglio.
Per quanto riguarda la respirazione, si mantiene costante a luglio e agosto, con valori di 3 -4 μmol CO2 m-2 s-1; in autunno si registrano valori più elevati, per le piogge che fanno aumentare l’umidità del suolo. Fra settembre e novembre 2003 sono stati registrati flussi respirativi tra 4 e 5 μmol CO2 m-2 s-1, che nei mesi invernali scendono a 2.5-3.5 μmol CO2 m-2 s-1. Da marzo in poi, con la ripresa dell’attività vegetativa, si verifica un progressivo aumento della respirazione (valori compresi tra 3.5 e 5 μmol CO2 m-2 s-1), per via di eventi piovosi frequenti e di un aumento delle temperature dell’aria, che favoriscono sia la respirazione del suolo che quella autotrofa. Durante l’estate 2004 la respirazione torna ai livelli di quella 2003 ma, a differenza dell’anno precedente, non si osserva una risalita autunnale a causa dei valori di umidità del suolo sensibilmente più bassi rispetto all’annata precedente (Fig. 6), sebbene le temperature si siano mantenute abbastanza elevate per il periodo (Fig. 5).
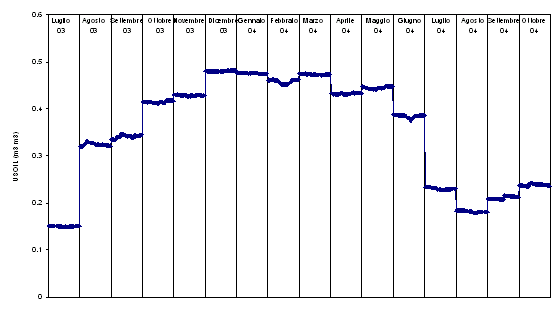
Fig. 6 - Andamento medio giornaliero dell’umidità del suolo (Usoil, m3 acqua m-3 suolo) calcolato in base alle medie mensili dei dati misurati ogni 30 minuti.
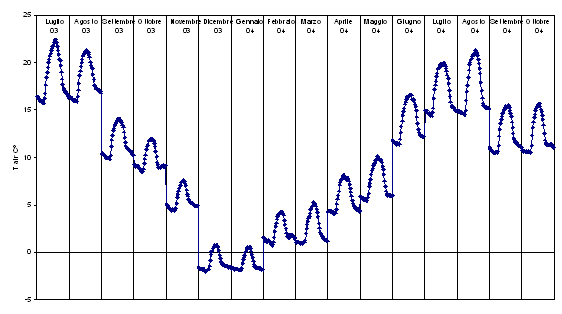
Fig. 5 - Andamento medio giornaliero della temperatura dell’aria (Tair, °C) calcolato in base alle medie mensili dei dati misurati ogni 30 minuti.
I valori termici più elevati, anche se di poco, di luglio 2003, sono associati a valori di umidità del suolo piuttosto bassi, intorno a 0.15 m3 (acqua) m-3 (suolo) contro 0.31 m3 m-3 di agosto del medesimo anno (Fig. 6). Nel 2004, in estate, l’umidità del suolo si mantiene bassa da luglio fino ad ottobre, a causa dell’assenza di piogge estive; questo ha determinato gli effetti sui flussi che si possono apprezzare in Fig. 3. L’osservazione suggerisce quindi che in estate il bilancio del carbonio è condizionato dall’azione sinergica di temperatura dell’aria e umidità del suolo. Infatti, nel momento in cui quest’ultima diventa fattore limitante scendendo a valori bassi, in concomitanza di temperature elevate, si determina una reazione “conservatrice” delle piante, che comporta la chiusura degli stomi. La funzione è quella di ottimizzare l’uso della quantità di acqua a disposizione, limitando il più possibile le perdite per traspirazione.
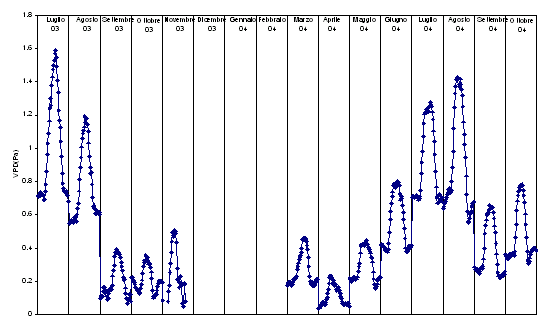
Insieme con la radiazione, la temperatura e l’umidità del suolo, un altro parametro che gioca un ruolo molto importante nei fenomeni traspirativi del bosco, è il deficit di pressione di vapore (VPD). L’aumento di VPD può determinare effetti sullo scambio di carbonio stimolando le foglie a chiudere gli stomi per limitare la traspirazione. Nella Fig. 7 si riportano gli andamenti giornalieri medi mensili per il VPD. Si nota come i valori medi massimi più elevati si registrino nel periodo estivo, in modo particolare nel luglio 2003. A luglio 2004, invece, i valori di VPD sono stati più contenuti rispetto all’anno precedente (1.3 kPa), mentre ad agosto 2004 la richiesta evapotraspirativa dell’atmosfera è risultata maggiore (1.4 kPa) rispetto allo stesso mese del 2003. Tali valori si riflettono sullo scambio di carbonio che, nei mesi estivi, subisce limitazioni soprattutto nella seconda parte della giornata. Un altro confronto significativo è quello tra il VPD di fine estate 2003 rispetto allo stesso periodo 2004. Tra settembre e ottobre 2003 sono stati registrati valori di VPD praticamente ottimali, non limitanti rispetto alla fotosintesi (0.35-0.39 kPa), mentre, nel 2004 i valori sono risultati relativamente elevati (media dei massimi pari a 0.64 kPa a settembre e 0.78 kPa in ottobre). Dal momento che NEE di settembre 2004 è minore rispetto allo stesso mese 2003 (Fig. 3) e osservando che nel 2004 la respirazione non aumenta dopo i mesi estivi, si suggerisce un effetto sinergico di VPD e contenuto idrico del suolo sull’assimilazione (Fig. 6).
Fig. 7 - Andamento medio giornaliero del deficit di pressione di vapore (VPD, kPa) calcolato in base alle medie mensili dei dati misurati ogni 30 minuti.
I flussi notturni sono determinati esclusivamente dai processi respirativi, sia autotrofi che eterotrofi. Per valutare come le variabili climatiche determinino gli andamenti e le variazioni della respirazione dell’ecosistema, i valori notturni misurati in buone condizioni di turbolenza sono stati studiati rispetto a temperatura dell’aria e umidità del suolo. La turbolenza è stata valutata tramite un parametro, la velocità di frizione (u*), che è un buon indicatore del livello di turbolenza; nel nostro caso si sono considerati come attendibili i valori di flusso notturno misurati con u* > 0.4 m s-1.
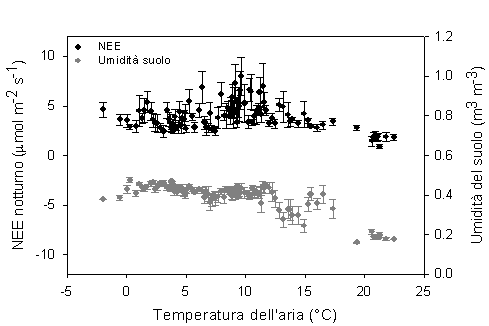
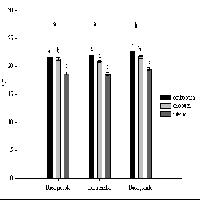
La respirazione ecosistemica, essendo determinata dalla biomassa vegetale presente e dalla decomposizione della sostanza organica a livello del suolo, dovrebbe risultare ben correlata con la temperatura dell’aria, che influenza la respirazione epigea, e con la temperatura e l’umidità del suolo, che influenza la decomposizione e la respirazione radicale. Da una prima analisi, i dati misurati nella pineta sono apparsi meglio correlati con la temperatura dell’aria e con l’umidità del suolo, mentre la temperatura del suolo superficiale è risultata meno determinante (dati non riportati). Nella Fig. 8 sono presentati i valori di respirazione di ecosistema (NEE notturno) e di umidità del suolo rispetto alla temperatura dell’aria.
Fig. 8 - Variazione della NEE notturna (respirazione, cechi neri) e dell’ umidità del suolo (cerchi grigi) al variare della temperatura dell’aria.
Come si può vedere, la respirazione tende ad aumentare fino ad una temperatura dell’aria di 10-12 °C mentre successivamente tende a diminuire, fino a raggiungere il minimo per temperature dell’aria intorno a 20-22 °C. La diminuzione di respirazione per temperature più alte, che sembrerebbe inaspettata considerando la nota relazione esponenziale tra temperatura e respirazione, risulta spiegata dalla diminuzione di contenuto idrico del suolo che, per temperature al di sopra di 12 °C tende a diminuire (deficit idrico estivo); si tratta di osservazioni che confermano altri risultati ottenuti in ambiente mediterraneo ([40]).
Avendo a disposizione circa 15 mesi di dati - anche se per i mesi invernali e per qualche altro breve periodo si hanno esclusivamente valori stimati con il gap-filling e quindi il dato è accompagnato da un certo grado di incertezza ([4]) - si è tentata una stima del bilancio mensile e annuale del carbonio. In Fig. 9 si riporta l’andamento dello scambio di carbonio per il periodo luglio 2003 - ottobre 2004, mettendo a confronto due differenti metodi per la stima dei valori medi mensili in caso di dati mancanti (il metodo dell’interpolazione e quello del giorno “medio”).
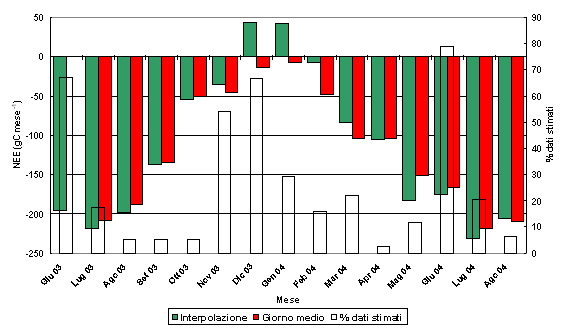
Fig. 9 - Valori cumulati mensili di scambio netto di carbonio (NEE, in gC mese-1) per il periodo giugno 2003 - ottobre 2004. Barre verdi: dati provenienti da interpolazione semplice; barre rosse: dati calcolati con il metodo del giorno “medio”; barre bianche-vuote: percentuale di dati stimati.
In base al metodo utilizzato per ottenere il totale, la stima dello scambio mensile di carbonio si presenta leggermente diversa, particolarmente nei mesi invernali, tra dicembre 2003 e febbraio 2004. Utilizzando l’interpolazione semplice, che consiste nella somma dei dati misurati riportata al mese, si ottiene un totale mensile di emissione di CO2 che indica che nel periodo invernale la pineta si comporta da source di carbonio. Con il metodo del giorno medio, che moltiplica per tutti i giorni del mese i valori di NEE totale del giorno medio, si hanno invece dei flussi che mostrano un leggero assorbimento di carbonio anche per dicembre 2003 e gennaio 2004. In Fig. 9, le barre chiare rappresentano una stima preliminare dell’incertezza, relativa alla percentuale di dati che sono stati stimati senza il supporto di variabili meteorologiche; come si può vedere, l’incertezza è maggiore per quei mesi in cui mancano più dati; in ogni caso, i valori che risultano maggiormente incerti, sono quelli invernali. Comunque, nonostante ci sia un forte grado di incertezza nelle stime fatte con entrambi i metodi, si può sicuramente affermare che la pineta studiata è un assorbitore (sink) significativo di carbonio con massimi estivi e minimi invernali, per un totale annuo di 1130 gC m-2 (valore stimato con il metodo dell’interpolazione) e 1230 gC m-2 (valore stimato con il metodo del giorno medio).
Conclusioni
La pineta studiata si è dimostrata un deciso assorbitore (sink) di anidride carbonica atmosferica. Per quanto concerne gli aspetti ecofisiologici, la pineta di laricio mostra una netta stagionalità dei flussi, in relazione all’andamento dei principali fattori climatici. L’influenza della temperatura estiva sul bilancio del carbonio risulta modulata in modo evidente dalla disponibilità idrica nel suolo e dall’umidità dell’aria. I valori minimi di assorbimento (comunque non nulli) si sono osservati nel periodo invernale, con un rapido aumento nel momento in cui le condizioni ambientali ritornano favorevoli. I valori positivi di assorbimento in inverno vanno messi in relazione con il clima della zona, in cui anche d’inverno, con forte insolazione, le temperature dell’aria permettono l’attività fotosintetica. Per quanto concerne la respirazione, essa risulta proporzionale alla temperature fino ad una certa soglia, oltre la quale si assiste a un sensibile decremento; tale soglia è determinata dall’umidità del suolo. Dunque, così come la fase di assorbimento, anche quella respirativa ha andamento crescente con le temperature fintanto che l’umidità del suolo non diventa fattore limitante, dopodiché si ha una netta inversione di tendenza. La disponibilità di quasi due anni di dati ha consentito di verificare differenti risposte da un anno all’altro; risulta pertanto importante proseguire il monitoraggio nel tempo. I risultati ottenuti - e in particolare il confronto fra le estati 2003 e 2004 - suggeriscono comunque che un innalzamento delle temperature e una contemporanea diminuzione delle precipitazioni durante il periodo estivo possono determinare una diminuzione della capacità di sink della foresta.
Ringraziamenti
Il sito sperimentale è stato allestito nell’ambito del progetto “Ricerca ecologica, monitoraggio e risposta ai cambiamenti ambientali in ecosistemi montani dell’Appennino centro meridionale” del Centro di Eccellenza “Foreste e Clima” dell’Università degli Studi della Tuscia di Viterbo, con la partecipazione della Sezione di Cosenza dell’Istituto per i Sistemi Agricoli e Forestali del Mediterraneo del Consiglio Nazionale delle Ricerche (CNR - ISAFoM) e dell’Istituto di Biologia Agroambientale e Forestale (IBAF) dello stesso CNR. Il progetto è stato finanziato dall’Istituto di Ricerca sulla Montagna (IMONT). Gli autori ringraziano il prof. Francesco Iovino per l’incoraggiamento, il dott. Giovanni Callegari per la cooperazione e Giuseppe Santarelli per la preziosa collaborazione.
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar