Fungal endophytes and epiphytes in needles of Picea abies (L.) Karst. from natural and urban areas in northern Italy
Forest@ - Journal of Silviculture and Forest Ecology, Volume 3, Pages 426-436 (2006)
doi: https://doi.org/10.3832/efor0386-0030426
Published: Sep 20, 2006 - Copyright © 2006 SISEF
Research Articles
Guest Editors: 5° SISEF Congress (Grugliasco, TO - 2005)
« Forests and Society - Changes, Conflicts, Sinergies »
Collection/Special Issue: E. Lingua, R. Marzano, G. Minotta, R. Motta, A. Nosenzo, G. Bovio
Abstract
The foliar fungal endophytes community inhabiting needles of Picea abies (Norway spruce) has not been well documented. In this study, carried out in Northern Italy, needles were collected in the years 2003 - 2004 in Bagni di Masino and Passo S. Marco (natural locations) and in Milano and Pavia (urban areas). Needles were plated and scored for hyphal outgrowth of endophytes to observe composition and distribution pattern. Both colonization percentage and number of taxa were higher in needles collected in natural locations. There was a large difference in the infection levels between natural and urban areas, portion of the needle (the distal portion showing the largest number of colonies) and among the different needle age classes, with the youngest needles being virtually endophytes free and the 5 and 6 age classes being the most colonized. Thus Norway spruce foliar endophytes population appears to be influenced by age and portion of the needle and location. In the year 2003 fungal epiphytes were also investigated to compare the two different populations. Results analisys show a different distribution of endophytic and ephyphitic taxa, some species being mostly isolated in the natural locations others in the urban ones, thus indicating the presence of different clusters. Zythiostroma pinastri and Tiarosporella parca were the most frequent endophytes in natural locations while Sphaeropsis sapinea was common in urban areas. Among the epiphytes Alternaria alternata, Aureobasidium, and Cladosporium were ubiquitous taxa, Phomopsis was mostly isolated in natural locations.
Keywords
Fungi, Norway spruce, Conifers, Needles, Endophytes, Epiphytes, Pollution
Introduzione
L’endofitismo è un rapporto asintomatico di endobiosi che si instaura, generalmente, tra batteri e/o funghi ed un gran numero di ospiti vegetali ([56]). Nelle piante legnose, tuttavia, in presenza di condizioni fisiologiche anomale, tale rapporto può variare trasformandosi in parassitismo, con conseguenze sullo stato di salute del vegetale ([49]).
In contrapposizione ai funghi epifiti, il gruppo ecologico degli endofiti è oggetto di indagine da un tempo relativamente breve ([7], [13], [45]) e le ricerche sino ad ora effettuate hanno chiarito solo in parte le problematiche ad esso connesse ([8]). La distribuzione delle comunità endofitiche nel tempo e nello spazio è fortemente influenzata dal tipo di pianta, dalla porzione vegetale interessata, dall’altitudine, dall’altezza e dalla densità della chioma, dall’omogeneità della stessa, dall’umidità ambientale e dall’esposizione ai venti, dai livelli di umidità relativa e di piovosità, dall’età del vegetale e dalla temperatura dell’aria ([45], [30], [57]). Gli endofiti delle piante arboree comprendono un elevato numero di generi appartenenti principalmente al gruppo degli ascomiceti e loro anamorfi ([55], [50]). Siebert ([51]) in uno studio su aghi di Picea ha individuato un centinaio di specie fungine endofitiche. Sebbene il ruolo ecologico degli endofiti sia ancora parzialmente sconosciuto, secondo Wilson ([59]) l’endofita potrebbe accelerare nella pianta l’assorbimento di nutrienti che si trovano sulla superficie fogliare. Ricerche da lui condotte, mediante sostanze nutrienti marcate radioattivamente, hanno permesso, infatti, di ottenere risultati positivi in tal senso in piante colonizzate da endofiti. È da tempo noto che i nutrienti fogliari, in misura diversa in base al tipo, possano penetrare attraverso la cuticola fogliare della pianta riducendo sintomi di carenza nutritiva ([3], [35], [10], [31]). Secondo Ragazzi ([48]) nelle piante forestali, così come in quelle erbacee, il ruolo dominante degli endofiti sarebbe quello protettivo nei confronti di insetti, funghi e sostanze allelopatiche. Il ruolo dell’endofita è per sua natura non patogeno e la relazione che stabilisce con la pianta è neutrale o mutualistica. Tuttavia, fin dall’inizio degli anni 1980, molti ricercatori, di fronte ad eziologie complesse come l’Oak decline, comparsa in quel periodo in Europa, USA e Giappone, cominciarono a considerare la possibilità che un endofita fungino, in qualche particolare momento del proprio ciclo vitale ed in presenza di particolari condizioni ambientali, potesse cessare di comportarsi da neutrale o mutualista e diventare la causa dei danni e sintomi osservati sulle piante ([32], [34], [19], [2], [23]). Anche, secondo Ragazzi ([48]), tra i numerosi endofiti che colonizzano i vegetali, alcuni possono esprimersi come patogeni nel momento in cui la pianta si trova in condizioni di stress fisiologico di vario tipo e contribuiscono alla morte della stessa. Ciò accade con Apiognomonia quercina ed il suo anamorfo Discula quercina, Diplodia mutila, Biscogniauxia mediterranea e Phomopsis quercina. Questi funghi iniziano il loro ciclo vitale come endofiti nelle piante sane, ma nel momento in cui le difese della pianta si abbassano, a causa di fattori abiotici, diventano fortemente patogeni ed uccidono la pianta. Le stesse condizioni di stress influenti sulla pianta, tra cui l’inquinamento atmosferico, la siccità e gli squilibri nutrizionali, possono incidere negativamente anche sulla popolazione endofitica alterandola quantitativamente e qualitativamente ([28]). La letteratura riguardante la colonizzazione endofitica delle conifere risulta ancora scarsa in Italia se paragonata a quella riguardante i funghi epifiti. In questo contesto è stato effettuato uno studio finalizzato al censimento delle popolazioni fungine endofitiche ed epifitiche degli aghi di Picea abies (L.) Karsten in ambiente naturale ed in ambiente soggetto a disturbo antropico, per verificare se e in quale misura tali popolazioni possano essere influenzate dall’antropizzazione.
Materiali e metodi
I campionamenti sono stati effettuati in 3 siti urbani localizzati nei comuni di Milano (2 siti) e Pavia e in 2 siti naturali localizzati a Passo S. Marco (Bergamo) e Bagni di Masino (Sondrio). I campioni di aghi sono stati raccolti in tre diversi periodi dell’anno (primavera, estate, autunno), per due anni consecutivi (2003-2004). Nei siti urbani sono state campionate 6 piante/sito mentre in quelli naturali 12 piante/sito, per un totale di 18 e 24 esemplari rispettivamente. Rami sono stati tagliati mediante cesoie sterilizzate alla fiamma dai palchi più bassi della pianta, e separati in diverse classi di età. Il trasporto è avvenuto in buste di carta, sterili, per limitare lo sviluppo dei funghi epifiti ([39], [8]).
Per l’isolamento del micelio endofitico gli aghi sono stati sterilizzati in superficie seguendo la metodologia proposta da Petrini & Carroll ([45]), successivamente modificata ([33]). Il protocollo ha previsto un primo lavaggio con etanolo (96%) per 1 minuto, un secondo lavaggio con ipoclorito di sodio (3.5% di cloro attivo) per 5 minuti ed un terzo lavaggio con etanolo (96%) per 30 secondi. Sono stati analizzati 5 aghi per ogni classe di età rinvenuta su ciascuna pianta. I campioni così trattati sono stati, successivamente, suddivisi in due frammenti (apicale e basale) e apposti sterilmente in capsule Petri su terreno colturale Corn Meal Agar ([33]). Le capsule sono state osservate con frequenza bisettimanale sino ad un periodo di due mesi ed i miceli sviluppati sono stati trasferiti e conservati in provette contenenti Malt Extract Agar (MEA). L’identificazione, quando possibile, è avvenuta utilizzando le apposite monografie ([20], [21], [18], [58]).
Per l’isolamento dei funghi epifiti gli aghi sono stati lavati sotto getto di acqua corrente ([17]) per 1 minuto ed apposti sterilmente su terreno colturale Corn Meal Agar. Sono stati analizzati 20 aghi per ciascun albero campionato, di cui 10 con meno di 1 anno di età (giovani) e 10 con più di 1 anno di età (vecchi). Le capsule sono state osservate settimanalmente sino ad un periodo di un mese; i miceli cresciuti sono stati isolati e conservati in provette contenenti Potato Dextrose Agar (PDA) ed identificati utilizzando le apposite monografie. I dati ottenuti sono schematizzati in Tab. 1 e Tab. 2, in cui sono riportati i taxa isolati e la loro frequenza sui campioni, calcolata come numero di aghi colonizzati da un determinato taxon, rispetto alla totalità dei campioni analizzati. È stato, inoltre, preso in considerazione il numero di taxa isolati da ciascun campione. Il numero dei taxa e la loro frequenza di colonizzazione sono stati confrontati al fine di individuare differenze tra epifiti/endofiti, località, età degli aghi, porzioni di ago, stagioni. Le percentuali di colonizzazione sono state confrontate mediante il test del chi-quadrato per valutare la significatività delle differenze tra località cittadine e montane.
Tab. 1 - Taxa fungini endofitici isolati, nel biennio 2003-2004, in ciascun sito di campionamento e loro frequenza di colonizzazione. PV: Pavia; MiGP: Milano Giardini Pubblici; MiSS: Milano S. Siro; BdM: Bagni di Masino; PSM: Passo S. Marco.
| Specie | PV % |
MiGP % |
MiSS % |
BdM % |
PSM % |
|---|---|---|---|---|---|
| Alternaria alternata (Fries) Keissler | 1.46 | 0.12 | 0.78 | 0.22 | 0.03 |
| Aspergillus flavus Link | 0.06 | - | 0.07 | - | 0.32 |
| Aspergillus niger Tieghem | 0.06 | - | 0.26 | 0.03 | - |
| Aureobasidium pullulans (de Bary) G. Arnaud | 0.45 | - | - | 0.76 | 0.4 |
| Chaetomium madrasense Natarajan | 0.64 | - | - | - | - |
| Cladosporium cladosporioides (Fresenius) G.A. de Vries | 1.02 | - | 0.13 | 0.06 | 0.19 |
| Cladosporium sp. | 0.51 | - | - | 0.17 | - |
| Diaphorte sp. | 0.51 | - | - | - | - |
| Diplodia mutila (Fries) Montagne | - | 0.47 | 0.07 | - | 0.03 |
| Lievito | 1.02 | 0.06 | 0.07 | 0.06 | - |
| Micelia without fructifications | 3.05 | 1.06 | 1.44 | 6.55 | 4.19 |
| Microsphaeropsis olivacea (Bonorden) Höhnel | 0.06 | - | 0.26 | 0.08 | - |
| Penicillium purpurogenum Stoll | 1.78 | 0.06 | - | 0.2 | 1.34 |
| Penicillium sp. | - | - | 0.07 | 0.17 | - |
| Phoma sp. | 0.51 | 0.29 | 0.39 | 1.85 | 0.19 |
| Phomopsis sp. | 1.46 | 0.47 | 0.78 | 0.17 | 0.03 |
| Readeriella sp. | - | 0.24 | - | - | - |
| Rhizopus sp. | - | - | 0.2 | - | - |
| Sirococcus sp. | - | - | - | - | 0.56 |
| Sphaeropsis sapinea (Fries) Dyko & B. Sutton | 0.19 | 2.53 | 0.07 | - | - |
| Tiarosporella parca (Berkeley & Broome) H.S. Whitney. J. Reid & Pirozynski | - | - | - | 4.31 | 4.19 |
| Trimmatostroma sp. | 0.25 | - | - | - | - |
| Tritirachium sp. | - | - | - | 0.34 | - |
| Trullula sp. | - | 0.06 | 0.2 | - | - |
| Zythiostroma pinastri (P. Karsten) Höhnel | - | 0.06 | 0.07 | 12.84 | 5.93 |
| Altri taxa fungini endofitici frequenza di colonizzazione inferiore allo 0.1% | |||||
| Località cittadine | Acremonium fusidioides (Nicot) W. Gams, Actinocladium rhodosporum Ehrenberg, Aspergillus sp., Beauveria bassiana (Balsamo) Vuillemin, Bipolaris cynodontis Wallwork et al., Cladosporium oxysporum Berkeley & M.A. Curtis, Fusarium sp., Fusarium subglutinans (Wollenweber & Reinking) P.E. Nelson, Toussoun & Marasas, Nigrospora sphaerica (Saccardo) E.W. Mason, Penicillium citreonigrum Dierckx, Penicillium olsonii Bainier & Sartory, Zygosporium gibbum (Saccardo, M. Rousseau & E. Bommer) S. Hughes | ||||
| Località montane | Acremonium sclerotigenum (Moreau & V. Moreau) ex Valenta, Amerosporiopsis gaubae Petrak, Aspergillus versicolor (Vuillemin) Tiraboschi, Cladosporium herbarum (Persoon) Link, Cryptosporiopsis abietina (Rostrup) Nannfeldt, Disculina vulgaris (Fries) B. Sutton, Fusamen sp., Fusarium verticillioides (Saccardo) Nirenberg, Haplosphaeria sp., Helhonia sp., Heteroconium chaetospira (Grove) M.B. Ellis, Hormonema sp., Myrothecium verrucaria (Albertini & Schweinitz: Fries) Ditmar, Paecilomyces marquandii (Massee) S. Hughes, Penicillium expansum Link, Penicillium griseoroseum Dierckx, Penicillium mirabile Beliakova & Milko, Perisporium arundinis Desmazières ex Fries, Phialophora bubakii (Laxa) Schol-Schwarz, Phoma leveillei Boerema & G.J. Bollen, Septoriella sp., Thysanophora canadensis Stolk & Hennebert, Tripospermum sp | ||||
| Entrambe le tipologie di località | Acremonium luzulae (Fuckel) W. Gams, Aspergillus fumigatus Fresenius, Cladosporium sphaerospermum Penzig, Epicoccum nigrum Link, Geniculosporium sp., Leptostroma sp., Penicillium minioluteum Dierckx | ||||
Tab. 2 - Taxa fungini epifitici isolati, nel 2003, in ciascun sito di campionamento e loro frequenza di colonizzazione. PV: Pavia; MiGP: Milano Giardini Pubblici; MiSS: Milano S. Siro; BdM: Bagni di Masino; PSM: Passo S. Marco.
| Specie | PV % |
MiGP % |
MiSS % |
BdM % |
PSM % |
|---|---|---|---|---|---|
| Acremoniella atra Saccardo | - | - | 2.5 | - | - |
| Alternaria alternata (Fries) Keissler | 43.1 | 43.6 | 56.4 | 25.8 | 23.3 |
| Aspergillus flavus Link | - | - | 1.9 | 2.8 | 1.3 |
| Aspergillus melleus Yukawa | 2.2 | 1.7 | - | 0.3 | - |
| Aspergillus niger Tieghem | 0.3 | 5 | 1.9 | 1.9 | 1.3 |
| Aspergillus sp. | 5.3 | 3.6 | 5 | 3.6 | 0.8 |
| Asteroma padi Greville | 12.2 | 16.7 | 11.1 | 7.8 | 6.5 |
| Aureobasidium pullulans (de Bary) G. Arnaud | 20.3 | 14.2 | 10.6 | 5.4 | 21.9 |
| Botrytis cinerea Persoon | - | 0.3 | - | 1.8 | 1 |
| Chaetomium globosum Kunze ex Fries | 1.9 | - | - | - | - |
| Cladosporium cladosporioides (Fresenius) G.A. de Vries | 22.8 | 4.2 | 21.1 | 24.6 | 6.7 |
| Cladosporium cucumerinum Ellis & Arthur | - | - | - | - | 2.6 |
| Cladosporium musae E.W. Mason | - | - | - | 2.6 | 5.4 |
| Cladosporium oxysporum Berkeley & M.A. Curtis | 14.4 | 7.8 | 6.1 | 0.4 | 7.4 |
| Cladosporium sphaerospermum Penzig | - | 29.4 | 0.8 | 3.8 | 1 |
| Cladosporium sp. | 19.4 | 12.8 | 22.5 | 0.4 | 8.3 |
| Epicoccum nigrum Link | 2.2 | 4.4 | 8.6 | 5.3 | 3.3 |
| Fusarium equiseti (Corda) Saccardo | - | 2.8 | 1.4 | - | - |
| Fusarium verticillioides (Saccardo) Nirenberg | - | 0.6 | - | 1.8 | 0.3 |
| Fusarium sp. | 0.6 | 4.2 | 4.4 | 0.7 | - |
| Gimnoascus sp. | - | - | - | 1.7 | - |
| Lievito | 4.7 | - | 0.8 | 0.4 | 2.2 |
| Melanospora zamiae Corda | - | - | 2.8 | - | - |
| Micelia without fructifications | 3.3 | 4.2 | 5.8 | 4.3 | 7.2 |
| Monochaetia karstenii (Saccardo & P. Sydow) B. Sutton | - | 16.7 | - | - | - |
| Mortierella sp. | 2.5 | - | - | - | - |
| Nigrospora oryzae (Berkeley & Broome) Petch | 14.2 | - | 8.6 | 0.1 | 1 |
| Nigrospora sphaerica (Saccardo) E.W. Mason | 6.7 | 3.9 | - | 0.1 | 0.3 |
| Paecilomyces sp. | 1.4 | 1.7 | 0.6 | 1.3 | 1.3 |
| Penicillium glabrum (Wehmer) Westling | - | 2.5 | 4.4 | - | - |
| Penicillium sp. | 5 | 5 | 4.4 | 2.5 | 1.3 |
| Phoma sp. | 10.3 | 6.1 | 11.7 | 6.5 | 1.5 |
| Pithomyces chartarum (Berkeley & M.A. Curtis) M.B. Ellis | 0.8 | 1.7 | 0.8 | 0.7 | - |
| Rhizopus stolonifer (Ehrenberg) Vuillemin | - | 2.2 | - | - | - |
| Rhizosphaera kalkhoffii Bubák | 2.2 | - | - | 1.5 | 3.9 |
| Sordaria fimicola (Roberge ex Desmazières) Cesati & De Notaris | 3.6 | 4.7 | 0.6 | - | - |
| Stigmina glomerulosa (Saccardo) S. Hughes | 3.3 | - | - | - | - |
| Thysanophora penicillioides (Roumeguère) W.B. Kendrick | - | - | - | 4.2 | 1.4 |
| Trichoderma viride Persoon | 9.7 | 5 | 0.3 | - | 3.6 |
| Trichoderma sp. | - | 1.1 | - | 11.1 | 1.4 |
| Tripospermum sp. | 1.7 | 0.6 | 0.3 | 2.4 | - |
| Trullula sp. | 0.6 | - | 3.9 | - | - |
| Ulocladium atrum Preuss | - | 1.9 | 0.8 | - | - |
| Ulocladium consortiale (Thümen) E.G. Simmons | - | - | - | 0.3 | 2.6 |
| Altri taxa fungini epifitici frequenza di colonizzazione inferiore all’1% | |||||
| Località cittadine | Aspergillus flavus var. columnaris Raper & Fennell, Botritys sp., Chaetomium aterrimum Ellis & Everhart, Chaetomium elatum Kunze & J.C. Schmidt: Fries, Cladosporium herbarum (Persoon) Link, Curvularia affinis Boedijn, Dictyotrichiella mansonii Schol-Schwarz, Dipsacomyces sp., Gelasinospora retispora Cain, Gliocladium sp., Gliomastix sp., Penicillium citreonigrum Dierckx, Penicillium corylophilum Dierckx, Penicillium dierckxii Biourge, Penicillium italicum Wehmer, Penicillium janthinellum Biourge, Penicillium olsonii Bainier & Sartory, Pestalotia stevensonii Peck, Phoma medicaginis Malbranche & Roumeguère, Rhizopus sp., Sporobolomyces roseus Kluyver & C.B. Niel, Torula herbarum (Persoon) Link, Ulocladium oudemansii E.G. | ||||
| Località montane | Acremonium sp., Aspergillus versicolor (Vuillemin) Tiraboschi, Beauveria sp., Bipolaris sorokiniana (Saccardo) Shoemaker, Endofragmia sp., Fusarium graminearum Schwabe, Fusarium oxysporum Schlechtendal, Hormonema sp., Leptosphaeria sp., Monodictys putredinis (Wallroth) S. Hughes, Mortierella claussenii Linnemann, Mucor sp., Myrothecium roridum Tode, Oidiodendron griseum Robak, Penicillium brevicompactum Dierckx, Penicillium chrysogenum Thom, Penicillium miczynskii K.M. Zalessky, Phoma glomerata (Corda) Wollenweber & Hochapfel, Phomopsis sp., Sclerotium sp., Scolicosporium fusarioides (Saccardo) B. Sutton, Scytalidium sp., Stachybotrys chartarum (Ehrenberg) S. Hughes, Taeniolella stilbospora (Corda) S. Hughes, Thielaviopsis sp., Trichoderma harzianum Rifai, Verticillium sp. | ||||
| Entrambe le tipologie di località | Aspergillus fumigatus Fresenius, Bipolaris cynodontis Wallwork et al., Bipolaris spicifera (Bainier) Subramanian, Chaetomium bostrychodes Zopf, Chaetomium sp., Hialodendron sp., Mucor hiemalis Wehmer, Penicillium oxalicum Currie & Thom. | ||||
Dati annuali relativi ai parametri meteoclimatici ed alle concentrazioni dei principali inquinanti per i 5 anni antecedenti i campionamenti sono stati forniti da enti dotati di reti di monitoraggio permanente quali l’Archivio Dati della Rete di Monitoraggio della Regione Lombardia e il Ministero per le Politiche Agricole e Forestali, Corpo Forestale dello Stato (Servizio CON.ECO.FOR.), Programma Nazionale per il Controllo degli Ecosistemi Forestali (CON.ECO. FOR.), co-finanziato dalla Commissione Europea.
Risultati
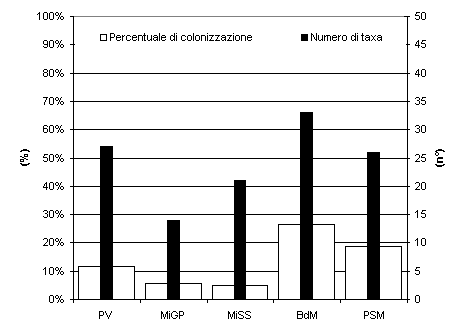
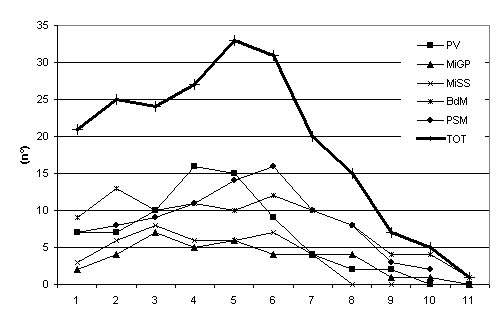
Lo studio della comunità endofitica degli aghi di Picea abies ha permesso l’isolamento di 67 taxa fungini (tab. I) di cui 57 nel 2003 e 24 nel 2004. Nella stazione Bagni di Masino sono stati isolati 33 taxa, anche a Pavia e a Passo S. Marco il numero di taxa era elevato, 27 e 26 taxa rispettivamente (Fig. 1). In tutti i siti di campionamento il maggior numero di taxa è stato riscontrato negli aghi di 5-6 anni (Fig. 2), in particolare sul frammento apicale (Fig. 3), ed è gradualmente diminuito con l’età negli aghi più vecchi. La colonizzazione di entrambi i frammenti è aumentata fino al 6° anno di vita, poi, gradualmente, è diminuita; solo il frammento apicale ha mostrato un secondo incremento al 10° anno. La percentuale complessiva di colonizzazione degli aghi è risultata del 17% con differenze notevoli tra siti naturali e antropizzati: mentre a Bagni di Masino e Passo S. Marco si è riscontrata una frequenza di colonizzazione del 26% e 19%, rispettivamente, i siti urbani hanno evidenziato una frequenza di colonizzazione inferiore al 15% (Fig. 1).
Fig. 1 - Numero di taxa fungini endofitici e frequenza di colonizzazione degli aghi nei cinque siti di campionamento. PV: Pavia; MiGP: Milano Giardini Pubblici; MiSS: Milano S. Siro; BdM: Bagni di Masino; PSM: Passo S. Marco.
Fig. 2 - Numero di taxa fungini endofitici degli aghi di diverse classi di età. PV: Pavia; MiGP: Milano Giardini Pubblici; MiSS: Milano S. Siro; BdM: Bagni di Masino; PSM: Passo S. Marco, TOT: numero di taxa riscontrati nella totalità dei campioni di ciascuna classe di età.
Fig. 3 - Numero di taxa fungini endofitici e frequenza di colonizzazione dei due frammenti, apicale (A) e basale (P), in cui è stato suddiviso l’ago per l’analisi.
La percentuale di colonizzazione degli aghi è diminuita nel mese di agosto 2003 ed è rimasta pressoché stabile nel successivo autunno, per subire un costante incremento a partire dalla primavera 2004. Il numero dei taxa è aumentato nel mese di agosto 2003, è rimasto pressoché stabile nell’autunno e per tutto il 2004.
L’analisi dei risultati ha permesso di evidenziare una diversa distribuzione delle specie endofitiche nelle due tipologie ambientali indagate: alcune risultano più frequenti nei siti naturali, altre in quelli cittadini, altre ancora si trovano in entrambi, individuando in tal modo la presenza di cinque principali raggruppamenti. Mediante l’applicazione del test del chi-quadrato è stato possibile verificare l’omogeneità di comportamento dei taxa fungini endofitici presenti all’interno di ciascuno dei 5 cluster. L’analisi statistica ha evidenziato un’alta attendibilità dei risultati per il cluster che include i taxa: Acremonium sclerotigenum, Amerosporiopsis gaubae, Aspergillus versicolor, Cladosporium herbarum, Cryptosporiopsis abetina, Disculina vulgaris, Fusamen sp., Fusarium verticillioides, Haplosphaeria sp., Helhonia sp., Heteroconium chaetospira, Hormonema sp., Myrothecium verrucaria, Paecilomyces maquandii, Penicillium expansum, Penicillium griseoroseum, Penicillium mirabile, Perisporium arundinis, Phialophora bubakii, Phoma levellei, Septoriella sp., Sirococcus sp., Thysanophora canadensis, Tiarosporella parca, Tripospermum sp., Tritirachium sp. e Zythiostroma pinastri (χ2/n = 0.0444; p<0.001) che risultano caratterizzare significativamente i siti naturali. Analogamente, i taxa: Acremonium fusidioides, Actinocladium rhodosporium, Aspergillus sp.,Beauveria bassiana, Bipolaris cynodontis, Chaetomium madrasense, Cladosporium oxysporum, Diaphorte sp., Diplodia mutila, Fusarium sp., Fusarium subglutinans, Nigrospora sphaerica, Penicillium citreonigrum, Penicillium olsonii, Readeriella sp., Rhizopus sp., Sphaeropsis sapinea, Trimmatostroma sp., Trullula sp., Zigosporium gibbum caratterizzerebbero i siti urbani (χ2/n = 0.4995; p<0.003).
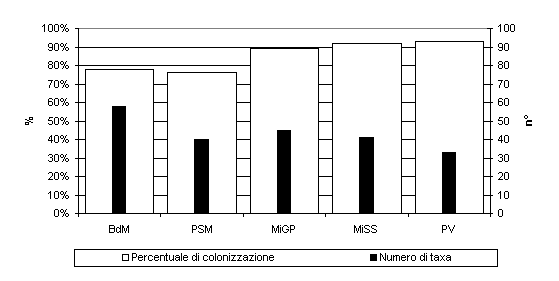
Per quanto riguarda l’indagine condotta sugli epifiti fungini, sono stati isolati 106 taxa (Tab. 2), di cui il maggior numero è stato riscontrato a Bagni di Masino (58), e il minore a Pavia (33 - Fig. 4). L’86% degli aghi indagati è risultato colonizzato da micelio fungino e il valore di colonizzazione massimo è stato rilevato nella stazione di Pavia (93% - Fig. 4). L’analisi dei risultati ha evidenziato una diversa distribuzione delle specie nelle due tipologie ambientali indagate: anche in questo caso alcune risultano più frequenti nei siti naturali, altre in quelli cittadini e sono stati individuati sei principali raggruppamenti. Uno dei sei raggruppamenti, che rappresenta il 3.55% del totale, è costituito da taxa isolati esclusivamente nel sito cittadino: Acremoniella atra, Fusarium equiseti, Melanospora zamiae, Mortierella sp., Penicillium glabrum, Rhizopus stolonifer, Sordaria fimicola, Stigmina glomerulosa, Trullula sp., Ulocladium atrum. Mediante l’applicazione del test del Chi-quadrato è stato ulteriormente possibile verificare l’omogeneità di comportamento dei taxa fungini epifitici presenti all’interno di ciascuno degli altri cluster. L’analisi statistica ha evidenziato un’alta attendibilità dei risultati per il cluster che include i taxa: Acremonium sp., Aspergillus versicolor, Beauveria sp., Bipolaris sorokiniana, Botritys cinerea, Cladosporium cucumerinum, Cladosporium musae, Endofragmia sp., Fusarium graminearum, Fusarium oxysporum, Fusarium verticillioides, Gimnoascus sp., Hormonema sp., Leptosphaeria sp., Monodictys putredinis, Mortierella claussenii, Mucor sp., Myrothecium roridum, Oidiodendron griseum, Penicillium brevicompactum, Penicillium chrysogenum, Penicillium miczynskii, Phoma glomerata, Phomopsis sp., Sclerotium sp., Scolicosporium fusarioides, Scytalidium sp., Stachybotrys chartarum, Teniolella stilbospora, Thielaviopsis sp., Thysanophora penicillioides, Trichoderma sp., Tricoderma harzianum, Ulocladium consortiale, Verticillium sp. (χ2/n = 0.4622; p<0.003) che caratterizzano, in tal modo, i siti naturali.
Fig. 4 - Percentuale di colonizzazione e numero di taxa fungini epifitici degli aghi nelle diverse stazioni di campionamento. PV: Pavia; MiGP: Milano Giardini Pubblici; MiSS: Milano S. Siro; BdM: Bagni di Masino; PSM: Passo S. Marco.
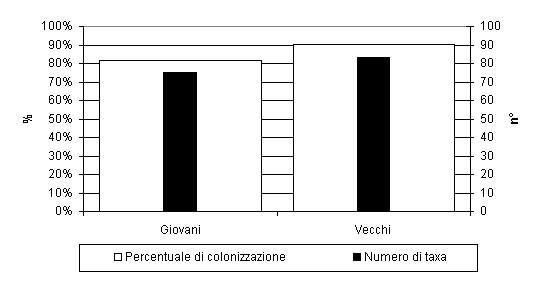
Gli aghi con età superiore ad un anno erano maggiormente ricchi in taxa rispetto a quelli con età inferiore (83 vs. 75); la stessa osservazione è riferibile alla percentuale di colonizzazione (90% per quelli con età superiore all’anno, 82% per quelli con età inferiore) (Fig. 5). La percentuale di colonizzazione è aumentata nel mese di agosto ed è, successivamente, diminuita nell’autunno. Il numero di taxa fungini è diminuito gradualmente dai campionamenti primaverili a quelli autunnali e ciò è stato evidenziato sugli aghi di tutte le età.
Fig. 5 - Percentuale di colonizzazione e numero di taxa fungini epifitici degli aghi con età superiore (vecchi) ed inferiore (giovani) ad un anno
Discussione
Rari sono, in letteratura, i lavori in cui si confronti la comunità endofitica di essenze arboree in siti naturali rispetto a siti urbani ([16]), nonostante siano reperibili dati relativi a studi di comunità endofitiche di diverse essenze forestali ([45], [30], [46], [49]). Nel corso del presente lavoro diversi livelli di infezione endofitica sono stati rinvenuti in Picea abies al variare della località cittadina o naturale, della porzione dell’ago (apicale o basale) e dell’età dello stesso. Relativamente al primo punto è utile sottolineare come il maggior numero di taxa e la maggior percentuale di colonizzazione sono stati rinvenuti, in generale, nei siti naturali ed in particolare, a Bagni di Masino, sede di monitoraggio CON.ECO.FOR. Il calcolo del chi-quadrato ha, inoltre, evidenziato come alcuni dei taxa rinvenuti presentino una significativa predilezione per l’ambiente montano rispetto a quello cittadino e indirizzino approfondimenti futuri nei loro riguardi quali indicatori della naturalità ambientale. Il confronto dei dati termici degli anni 1998-2003 ha evidenziato la presenza, nei siti naturali, di un clima più freddo di 5-10°C rispetto a quello delle località cittadine con valori invernali che scendono spesso sotto lo zero e che non superano mai i 20°C in estate. Picea abies è resistente alle basse temperature, può essere inclusa nel gruppo delle specie microterme ([24]) e, nonostante le sua buona adattabilità a differenti condizioni climatiche, potrebbe essere soggetta, in città, a stress termici, in particolare nei periodi estivi. Anche l’analisi dei dati pluviometrici rilevati negli anni 1998-2003 nelle stazioni naturali ed urbane ha evidenziato la presenza di una maggiore piovosità nelle stazioni naturali, rispetto a quelle cittadine. Picea abies è esigente in fatto di umidità atmosferica ed edafica, richiede perciò piogge frequenti nel periodo vegetativo ([47]). Stanosz et al. ([54]) dimostrarono infatti, che la patologia causata da Sphaeropsis sapinea, rilevata nel corso del presente lavoro esclusivamente nei siti cittadini, è stata spesso associata a periodi di siccità ed alla sua capacità di persistere in fase di quiescenza nella pianta. L’eterogeneità della distribuzione degli endofiti fungini tra siti naturali e cittadini, già evidenziata su Pinus strobus da Deckert & Peterson ([16]), potrebbe trovare ulteriore spiegazione nella diversa situazione ambientale riscontrabile nelle due tipologie campionate. Le località di Pavia e Milano (siti cittadini) sono caratterizzate da scarsa qualità dell’aria ([4]): è possibile che gli inquinanti legati all’attività umana possano ostacolare la trasmissione ed il successo di infezione dei propaguli fungini endofitici come precedentemente dimostrato da Heliovaara et al. ([29]) e Asai et al. ([5]).
I principali taxa endofitici isolati (Zythiostroma pinastri, Tiarosporella parca, Sirococcus), a comportamento generalmente saprotrofo o debolmente patogeno sembrano particolarmente legati ai siti naturali, eccezion fatta per rari riscontri di Zythiostroma pinastri a Milano. Il genere Zythiostroma era già noto quale colonizzatore della lettiera di pino ([40], [41]) e la specie Z. pinastri è segnalata patogena delle conifere delle foreste siberiane ([26]).
La specie Tiarosporella parca è stata precedentemente riscontrata su aghi sofferenti o di lettiera di Picea abies ([51]) e, recentemente, quale endofita in aghi verdi di abete rosso. È particolarmente frequente nelle peccete svizzere ([27]) ed è stata trovata frequentemente anche su aghi vecchi in Austria ([14]). La sua presenza non è limitata all’Europa essendo stata rinvenuta anche in Canada su Picea spp. ([58]). In Inghilterra, Germania, Norvegia, Svezia e Finlandia sembra essere più comune Lophodermium piceae ([58]; [53]).
Il genere Sirococcus annovera tra le proprie specie S. conigenus, agente causale dello “Shoot Blight Disease” ([26]). S. conigenus causa danni a molte conifere nelle zone temperate e boreali del nord Europa ed America ([52]); Picea abies è colpita sia allo stadio di germinello sia di pianta adulta. In Austria la malattia è diffusa fin dal 1980 ([44], [25]), in Trentino può essere grave, ma è limitata a singoli esemplari ([37]). Questo taxon può comportarsi da patogeno ma, talvolta, può colonizzare asintomaticamente e può essere isolato da rametti, germogli ed aghi apparentemente sani ([11], [44], [25]). Secondo Anglberger et al. ([1]) la presenza di squilibri nutrizionali, principalmente di Ca, Mg e N può rendere la pianta più suscettibile al patogeno.
Nell’ambito dell’indagine sulla distribuzione degli endofiti in Picea abies un altro dato da evidenziare è la distribuzione dell’endofita all’interno dell’ago. La suddivisione dei singoli aghi in frammenti ha permesso non solo di isolare un maggior numero di endofiti, ma anche di individuare nella porzione apicale dell’ago quella maggiormente colonizzata. La morfologia della porzione vegetale studiata sembra, infatti, influenzare la frequenza di colonizzazione delle diverse porzioni di tessuto ([12]). Studi condotti su conifere hanno evidenziato sia una maggiore incidenza della colonizzazione endofitica della porzione basale dell’ago ([7]), che una maggiore colonizzazione di quella apicale ([16]). Come ipotizzato da Cannon & Simmons ([12]) la morfologia dell’ago di Picea abies potrebbe influenzare il flusso delle gocce di umidità o pioggia in una direzione preferenziale sull’ago indirizzando il movimento delle spore fungine verso l’apice e facilitando il loro sviluppo.
La colonizzazione endofitica delle conifere può essere influenzata, non solo dalla morfologia ma anche dall’età dell’ago ([7], [13], [45], [6], [22], [56], [55]). Ciò è in accordo con quanto da noi riscontrato essendo stato evidenziato un aumento del numero di taxa e della percentuale di aghi colonizzati al progredire dell’età degli aghi sino al 5° - 6° anno di vita.
La valutazione della comunità fungina epifitica rilevata esclusivamente nel corso del 2003 ha permesso di evidenziare la presenza di un maggior numero di taxa (106) rispetto a quella endofitica (57): tale differenza risulta rilevante in tutte le stazioni. Inoltre, mediante l’utilizzo del test del chi-quadrato, è stato possibile evidenziare il riscontro significativo di un comportamento omogeneo di alcuni taxa fungini in una tipologia di località indagata, mentre altri hanno significativamente colonizzato l’altra, indicando una capacità di discriminazione tra siti urbani e siti naturali. La percentuale di colonizzazione degli aghi, nelle due comunità differisce enormemente: l’86% degli aghi sono risultati colonizzati da fungi epifiti mentre solo il 18% è stato interessato da colonizzazione endofitica. La ricca e diversificata comunità fungina epifitica riscontrata è costituita da numerosi generi fungini noti quali colonizzatori della superficie fogliare delle conifere ([40], [42], [41]). Essa è caratterizzata da un piccolo numero di taxa ad elevata frequenza di colonizzazione e da un nutrito gruppo di taxa che, a differenza del precedente, evidenzia bassa frequenza di colonizzazione, in accordo con quanto riportato da Christensen ([15]) e Bills & Polishook ([9]).
Il maggior numero di taxa è stato individuato nei siti naturali, in particolare a Bagni di Masino; la maggior percentuale di colonizzazione è stata invece rilevata a Pavia ed, in generale, nei siti urbani. In riferimento a ciò è stato precedentemente ipotizzato che l’inquinamento possa alterare il processo di colonizzazione del tessuto fogliare da parte dei microrganismi ([38]) e che le polveri, provenienti dall’atmosfera e deposte sulla superficie fogliare, possano avere un forte effetto stimolante sul numero delle colonie fungine presenti sul filloplano, ma non sul numero delle specie ([36]). Il maggior numero di taxa fungini e la maggior percentuale di colonizzazione si sono riscontrati negli aghi con più di 12 mesi di età; Mishra & Dickinson ([43]) hanno evidenziato, infatti, la presenza di ripetute ondate di colonizzazione durante lo sviluppo fogliare. Questo processo è ciclico sulle foglie che, come quelle della maggior parte delle conifere, rimangono vitali sulla pianta per più anni e conduce ad una diminuzione della popolazione in inverno e in primavera ed a un incremento in estate ed in autunno.
Ringraziamenti
Si ringrazia l’Archivio Dati della Rete di Monitoraggio della Regione Lombardia (⇒ http://www.ambiente.regione.lombardia.it/webqa/aria/Archivio.htm) ed il Ministero per le Politiche Agricole e Forestali (Corpo Forestale dello Stato, Servizio CON.ECO.FOR.) per averci fornito i dati meteoclimatici e le concentrazioni dei principali inquinanti dei siti oggetto di indagine.
References
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar