Problems in the inventory of the belowground forest biomass carbon stocks
Forest@ - Journal of Silviculture and Forest Ecology, Volume 3, Pages 542-554 (2006)
doi: https://doi.org/10.3832/efor0415-0030542
Published: Dec 18, 2006 - Copyright © 2006 SISEF
Review Papers
Guest Editors: 5° SISEF Congress (Grugliasco, TO - 2005)
« Forests and Society - Changes, Conflicts, Sinergies »
Collection/Special Issue: E. Lingua, R. Marzano, G. Minotta, R. Motta, A. Nosenzo, G. Bovio
Abstract
Signatory countries of Kyoto Protocol are engaged in carrying out national inventories to quantify greenhouse gas emission and potentiality of C sinks. Forests represent the terrestrial ecosystem with the highest C sequestration capacity taking up CO2 from the atmosphere and fixing it in vegetal biomass through photosynthesis process; C stocks can be divided in aboveground and belowground ones. In inventorial processes, root biomass is empirically extrapolated from aboveground biomass using a 0.2 factor, which underestimate the real value. Some authors suggest that total underground C allocation can be assessed from the difference between annual respiration rate and litter fall. Belowground biomass can be divided in permanent biomass (structural roots) and temporary one (fine roots). Models allow a valuation of structural roots biomass from stand dendrometrical characteristics. Literature reveals that underground biomass, as fine roots than structural ones, highly varies with local conditions. The development of models that take into account these station parameters and therefore able to reproduce this variability seems to be obligatory to deal with inventory processes with an acceptable precision.
Keywords
Carbon cycle, Forests, Forest inventory, Root production, Soil
Introduzione
L’effetto serra è un fenomeno naturale che permette la vita sulla Terra, conservando una temperatura idonea sulla superficie del pianeta. Questo fenomeno è causato dalla presenza di numerosi gas nell’atmosfera tra cui il principale è l’anidride carbonica (CO2). È stato osservato, negli anni ’50-’60, che la concentrazione nell’atmosfera di alcuni di questi gas era in aumento, in conseguenza dell’intensificazione delle attività umane, e continua ad aumentare anche nel nuovo millennio principalmente a causa della combustione di carburanti fossili, della produzione di cemento e del disboscamento globale. L’aumento della concentrazione dei gas serra nell’atmosfera, sin dalla rivoluzione industriale nel XIX secolo, sembra essere, in buona parte, la causa di un incremento della temperatura globale della Terra ([58]). I cambiamenti globali, indotti dalla rapida crescita della popolazione umana e dal risultante elevato consumo di risorse, sono fenomeni "ecologici" che alterano la struttura e le funzioni del sistema Terra ([58]). Il Comitato Intergovernativo sui Cambiamenti Climatici (Intergovernmental Panel on Climate Change, IPCC) ritiene che la temperatura media del pianeta sia aumentata di circa 0.6 °C dal 1861. Sulla base delle tendenze attuali d’emissione dei gas serra, si stima un ulteriore aumento della temperatura terrestre tra 1.4 e 5.8 °C nel periodo 1990-2100. Da quando, durante la Conferenza delle Nazioni Unite sull’ambiente e lo sviluppo a Rio di Janeiro, gli scienziati hanno reso pubblico questo legame tra l’aumento della concentrazione dei gas serra ed il riscaldamento globale del pianeta, la limitazione delle emissioni ed il sequestro della CO2 in eccesso sono diventati una preoccupazione mondiale. La presa di coscienza dei dirigenti politici ha permesso l’adozione e poi la ratifica della Convenzione Quadro sui cambiamenti climatici delle Nazione Unite nel 1994. I firmatari si sono impegnati ad effettuare inventari nazionali, che quantifichino le emissioni di gas serra e le potenzialità dei “serbatoi” per l’immagazzinamento di carbonio (C). Nel 1997, durante la terza Conferenza tenuta a Kyoto, i firmatari del Protocollo presero l’impegno di ridurre le emissioni di gas ad effetto serra tra 2008 e 2012 di almeno il 5% rispetto ai livelli del 1990 anche tramite l’aumento della capacità d’assorbimento di C. Gli ecosistemi forestali rivestono un’importanza sostanziale nel partecipare a quest’impegno. Da una parte, la diminuzione progressiva della copertura forestale risulta una delle cause principali dell’aumento della concentrazione di gas serra; dall’altra, le foreste rappresentano gli ecosistemi terrestri con la maggiore capacità di sequestro di C, ed il legno, almeno in parte, rappresenta un’alternativa all’utilizzo di combustibili fossili. L’impegno necessita, dunque, una fase conoscitiva a livello planetario di tutti i serbatoi di C, in particolare quelli forestali, ed una fase successiva di riflessione sulle opzioni per incrementare la quantità di questi serbatoi o per aumentare la loro capacità di sequestro di C, contemporaneamente all’incremento dell’utilizzo di fonti energetiche alternative, come le biomasse legnose. Le riserve di C degli ecosistemi terrestri possono essere genericamente suddivise in epigee ed ipogee. Vaste quantità di C in forma di radici e sostanza organica decomposta sono immagazzinate nel suolo, ed i processi fisici, chimici e biologici nel terreno influenzano il bilancio fra lo stoccaggio di C organico ed il rilascio di CO2 (o di altri gas serra) nell’atmosfera. In questo lavoro vengono discusse le capacità d’incidere nei processi di sequestro del C da parte degli apparati radicali, e le difficoltà di misura e di stima della biomassa ipogea; in particolare, saranno esaminate le possibili applicazioni per stimare la quantità di C imprigionata negli apparati radicali dei soprassuoli forestali negli inventari nazionali. In effetti, le strutture ipogee sono invisibili ed il loro studio rappresenta una sfida, sebbene i progressi scientifici e tecnologici migliorino continuamente la capacità di comprendere i processi sotto la superficie del suolo ([29]).
Bilancio globale del carbonio
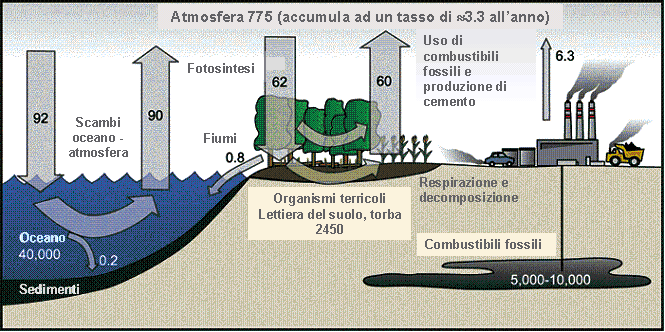
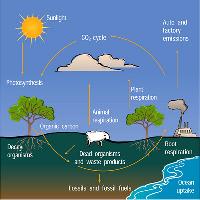
Il C è costantemente in circolazione tra quattro grandi forme di serbatoi: la litosfera, l’idrosfera, la biosfera e l’atmosfera. Per caratterizzare gli scambi tra questi serbatoi, e quindi per potere effettuare una stima del bilancio del C, è stata definita la nozione di serbatoio (pool) che diventa fonte o pozzo in relazione alla direzione che assumono i flussi di scambio con l’atmosfera. Una fonte aumenterà la quantità di C nell’atmosfera (emissioni di CO2), mentre un pozzo catturerà a lungo termine il C del serbatoio atmosferico (sequestro di CO2). Una parte della CO2 emessa nell’atmosfera (circa la metà), per responsabilità antropica, è assorbita negli ambienti marini e nella biosfera terrestre. Il bilancio del C è rappresentato dunque dalla quantità di C emessa nell’atmosfera rispetto alle quantità immagazzinate negli oceani, nel suolo e nei vegetali. I suoli in particolare sono i maggiori serbatoi di C terrestre. La quantità di C immagazzinata nel suolo è molto rilevante, potendo contenere circa tre volte il C della vegetazione ed il doppio di quello contenuto nell’atmosfera ([3]).
Bilancio del carbonio negli ecosistemi forestali
Il bilancio del C è influenzato da una serie di numerose variabili ed è noto che le foreste sono gli ecosistemi in grado di immagazzinarne il maggior quantitativo per unità di superficie, prendendo CO2 dall’atmosfera e fissandola in biomassa vegetale attraverso la fotosintesi ([57]), in biomassa animale attraverso le catene trofiche ed infine nella sostanza organica contenuta nel suolo. Tale biomassa si trasforma continuamente per nascita, crescita, morte e decomposizione degli organismi mantenendo tuttavia negli ecosistemi evoluti, e particolarmente nelle foreste, elevati livelli quantitativi garantiti da complesse (e delicate) dinamiche evolutive, determinate soprattutto dai fenomeni di mutualismo e di concorrenza inter- e intra-specifica ([2]). Le principali componenti del bilancio e dell’allocazione del C in una foresta in crescita sono rappresentate dalla quantità e dall’andamento temporale della produzione primaria netta (NPP), dalla sua allocazione nelle varie componenti, dalla longevità delle radici, dai tassi di decomposizione radicale e dall’ingresso di C attraverso la lettiera epigea e i suoi relativi tassi di decomposizione. Si stima che gli ecosistemi forestali fissano più di 90% del C terrestre mondiale ([25]): le foreste tropicali sono i più importanti serbatoi e costituiscono una riserva di circa 220 tonnellate di C ad ettaro. Le foreste temperate contribuiscono con una riserva di 150 tonnellate di C ad ettaro, quelle boreali con 90 tonnellate di C ad ettaro, le praterie e le savane con 15 tonnellate di C ad ettaro, ed infine i terreni agricoli con 5 tonnellate di C ad ettaro ([9]). In ogni caso, le tecniche attuali per la misura della densità volumetrica del suolo sono approssimate con il 10-20% d’errore, e ciò significa un’incertezza negli stocks globali di C nel suolo di 150-400 gigatonnellate ([29]). Un accurato calcolo dei flussi derivati dalle radici nei pools di C nel suolo richiede la comprensione approfondita d’alcuni principi base d’ecologia delle radici, come il ciclo e la morte delle radici fini.
Per una piena comprensione e quantificazione del bilancio del C a scala globale e d’ecosistema è consigliabile integrare diversi approcci di studio, assemblando dati esistenti (cambiamenti d’uso del suolo, ricostituzione dei boschi percorsi da incendio), raccogliendo misure in campo (biomassa, flussi gassosi, LAI, misura d’isotopi stabili), analizzando dati telerilevati multispettrali (NDVI), sviluppando modelli meccanicistici, e costruendo una struttura analitica integrata. Il primo gradino dello sviluppo di un modello è, ovviamente, quello di identificare e capire i processi di controllo, secondo ricerche documentate e sperimentali. A tale scopo, studi su larga scala e di lungo periodo sono auspicabili per definire il destino della lettiera o dei detriti vegetali, ed il loro ruolo nel determinare la sostanza organica del suolo ed il ciclo dei nutrienti a lungo termine ([41]).
Flussi di carbonio negli ecosistemi forestali
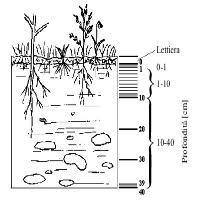
Durante il processo d’assimilazione fotosintetica, la pianta utilizza una parte del C per aumentare la biomassa totale radicale mentre una piccola quantità di C è anche persa attraverso la respirazione e la decomposizione delle radici fini. Circa il 75% del C terrestre totale è immagazzinato nel suolo ([23]). In particolare, i suoli forestali trattengono circa il 40% del totale (suolo, lettiera e radici - [15]); quindi anche cambiamenti di scarsa entità che influenzano gli accumuli di C in questi suoli possono avere un effetto significativo sul ciclo globale (Fig. 1). La tendenza all’emissione e al sequestro di C nei suoli meno evoluti sono maggiori nei terreni fertili dell’emisfero settentrionale, rispetto ai suoli antichi e poco fertili dell’emisfero meridionale. Per tale motivo, le foreste temperate e le praterie sono probabilmente i più importanti sink di C, ed i suoli delle foreste pluviali, della tundra, e delle paludi sono meno rilevanti anche se più delicati considerata la più chiara separazione fisica tra orizzonti organici superficiali di accumulo e orizzonti minerali.
Al livello europeo ed italiano sono in corso diverse iniziative tra cui il COST E43, il COST E38, il recentemente concluso COST E21 e l’Inventario Nazionale delle Foreste e dei serbatoi di Carbonio, rivolti a migliorare la conoscenza dei processi di sequestro del carbonio nelle foreste e ad incrementare l’accuratezza dei dati inventariali (⇒ ./showPaper.php?action=html(0.415.15)).
Allocazione ipogea di carbonio negli ecosistemi forestali
Un ecosistema forestale comprensivo di vegetazione (arborea e sottobosco), lettiera e suolo, contiene una quantità di C variabile. La NPP di un ecosistema esprime la quantità di C, al netto della respirazione autotrofa, da questo sottratta annualmente all’ambiente e fissata sottoforma di biomassa, misurata in tonnellate ad ettaro di sostanza secca. Le relazioni tra sostanza secca e contenuto di C sono variabili, ma in genere si usa assumere ([12]) che (eqn. 1):
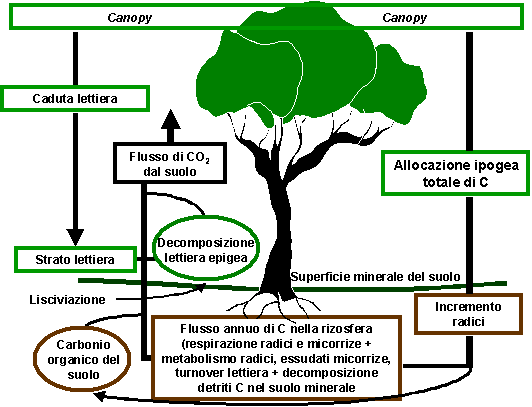
Le riserve di C “non vivente” nel suolo sono in equilibrio costante con l’input di lettiera, ramaglia e radici e l’output di CO2 evoluto durante la decomposizione microbica sebbene Schulze et al. ([52]) evidenziano che codesta assunzione non è sempre vera, anche in foreste europee. Il flusso di CO2 dal suolo consiste in C rilasciato per respirazione da radici, micorrize ed organismi che abitano la rizosfera ed il volume di suolo esplorato dagli apparati radicali (Fig. 2). L’allocazione di C verso le strutture ipogee delle piante è uno dei principali flussi di C negli ecosistemi terrestri, sebbene ancora non ben quantificato. Raich & Nadelhoffer ([49]), riesaminando lavori sperimentali su numerosi ecosistemi forestali, hanno suggerito che l’allocazione ipogea totale di C può essere stimata dalla differenza fra tassi annuali di respirazione del suolo e caduta di lettiera epigea. In seguito, queste conclusioni sono state confermate da un’estensione delle analisi per foreste mature da Davidson et al. ([13]), sebbene Gower et al. ([19]) abbiano osservato che l’uso di modelli per la stima del C totale allocato alle radici e per la costruzione di bilanci del C non può essere considerato un metodo accettabile, a scala di singolo sito, per sostituire la misura dei flussi di C del suolo. Tognetti & Marchetti ([54]) hanno aggiornato i precedenti lavori sulle relazioni fra misure di respirazione del suolo e di caduta di lettiera, includendo nell’analisi a scala globale sia foreste mature sia giovani piantagioni. I risultati ottenuti nei 3 lavori di compilazione - Raich & Nadelhoffer ([49]), Davidson et al. ([13]) e Tognetti & Marchetti ([54]) - concordano piuttosto bene, confermando che la produzione epigea e quella ipogea sono controllate dagli stessi fattori. Considerando un gradiente di C da lettiera oscillante fra 52 a 530 g m-2 anno-1, codesto porterebbe ad un aumento dell’allocazione totale ipogea di C compreso tra circa 90 a 1800 g m-2 anno-1 ([54]).
Fig. 2 - Sommario dell’approccio del bilancio di massa utilizzato per esaminare i flussi di C ipogeo, che contribuiscono al flusso di CO2 superficiale, e loro origine nell’allocazione ipogea totale del C e caduta di lettiera epigea.
L’allocazione totale ipogea di C (Pb) è stata stimata usando il C da lettiera epigea come predittore (Pa - eqn. 2):
(r2 = 0.38, P < 0.0001, n = 132) . Queste relazioni permettono la realizzazione di semplici bilanci del C, utilizzabili per porre dei limiti entro cui stimare in maniera più attendibile la produzione di radici in ecosistemi forestali. La determinazione accurata dei tassi di respirazione radicale (radici vive) in ecosistemi forestali potrebbe ulteriormente restringere il range dei tassi di produzione radicale ipotizzabile. Ciò costituirebbe una verifica dell’ipotesi che l’allocazione totale di C alle radici aumenta con la NPP del soprassuolo, e che la relazione è influenzata dal gradiente di disponibilità delle risorse. L’allocazione di C in radici e foglie può variare sostanzialmente fra le specie, in funzione della tolleranza a basse intensità luminose, dell’ambiente di crescita o dello stato successionale ([59]) e l’età del popolamento.
Per una valutazione precisa dei flussi di C devono essere migliorati sia i metodi utilizzati per quantificare la biomassa radicale complessiva (radici fini e radici strutturali) che quelli adottati per indagare sulla dinamica dei processi vitali (crescita, durata di vita e morte) delle radici.
Un’assunzione critica per l’uso della tecnica del bilancio del C è che il C del suolo forestale sia in stato stabile (respirazione eterotrofa = produzione di detriti ipogei ed epigei). Disturbi naturali ed antropici possono influenzare l’accumulo di C nel suolo forestale ([28]), rendendo poco accurata l’applicazione del metodo per esempio su giovani piantagioni. Inoltre, l’omissione dei detriti legnosi grossolani tra quelli epigei può risultare in stime erronee d’allocazione totale ipogea di C ([19]). I detriti legnosi grossolani sono molto variabili nello spazio e nel tempo, cosicché sono necessarie aree di saggio permanenti e/o cronosequenze omogenee per ottenere stime attendibili su quantità, distribuzione e grado di decomposizione di questo importante input di C nel suolo ([55]). Nelle foreste temperate, i rapporti fra detriti legnosi grossolani e quelli totali epigei possono variare fra 0.15 e 0.25 ([21]), aumentando sistematicamente con l’invecchiamento del soprassuolo ([35]).
Misura diretta della biomassa radicale
Le radici hanno un importante ruolo nel ciclo del C per il trasferimento di una considerabile quantità di C verso il suolo, dove questo può essere stoccato per periodi relativamente lunghi. Alcune radici possono estendersi a gran profondità, ma la maggior parte delle biomassa radicale totale si trova nei primi 30 cm della superficie del suolo ([6], [27]). La perdita o l’accumulo di C nel suolo è dunque intenso nei primi strati del profilo del suolo (0-20 cm), soprattutto gli orizzonti organici ed i primi orizzonti minerali.
Esistono diversi metodi per effettuare misurazioni dirette della biomassa radicale utilizzati sopratutto in ricerche nel campo ecologico, pedologico ed agronomico:
- carotaggio del suolo
- campionamento di monoliti di suolo
- scavo e messa a nudo degli interi apparati radicali in trincee
In genere ([36]) il campionamento tramite trivella e le misurazioni delle radici mediante monoliti sono economicamente più fattibili dello scavo. La scelta del metodo dipende dalle condizioni specifiche del sito ed include considerazioni su: accessibilità; precisione richiesta; disponibilità di dati sulla distribuzione delle radici attesa per la specie indagata; profondità e tessitura del suolo; pietrosità. Il campionamento di carote di suolo per determinare la biomassa radicale è abitualmente spinto fino ad una profondità standard di 50 cm. Il campionamento di monoliti è impiegato per determinare la distribuzione relativa delle radici ad una profondità anche superiore a 50 cm. Il metodo del carotaggio usa tubi cilindrici che rimuovono un volume conosciuto di suolo in un profilo di profondità nota. Una carota di 50-80 mm di diametro è considerata sufficiente. La trivella può essere introdotta manualmente o meccanicamente. L’inserzione manuale non è comoda per profondità maggiori di 30 cm od in caso di pietrosità rilevante. Dopo l’estrazione delle radici dalla carota, queste sono lavate, esaminate e pesate. Il metodo dei monoliti richiede di tagliare un monolito di suolo dal quale le radici sono estratte per lavaggio. Questo metodo è frequentemente utilizzato per determinazioni quantitative di tutte le radici. Le dimensioni del monolito dipendono dalla specie investigata. Generalmente, il volume del monolito varia tra 1 e 50 dm3; il metodo è molto simile a quello del carotatore per volumi tra 1 e 2 dm3 Il campione, dopo lavaggio, è essiccato e pesato. Si ottiene un risultato espresso in massa secca per unita di volume di suolo. Le radici possono essere classificate secondo le dimensioni, in fini o strutturali, il limite è preso generalmente tra 1 e 2 mm di diametro. Le radici con diametro maggiore di 10 mm non sono campionate col metodo della trivella, al contrario di quel che accade utilizzando il metodo dei monoliti. In soprassuoli misti, la separazione delle radici secondo la specie è difficile. La variabilità dell’architettura del sistema radicale impone numerosi campionamenti, richiesti per stimare con maggiore precisione il peso complessivo delle radici e dell’apparato radicale. Con il metodo dello scavo, l’apparato radicale viene estratto completamente dal suolo manualmente, per conservare intatte tutte le radici, oppure con uno scavatore, avendo ben presente la perdita di informazione e dunque di precisione dovute al danneggiamento provocato alle radici. Quando il tipo di suolo lo permette, ad esempio molto sabbioso, si può anche velocizzare lo scavo utilizzando una pistola ad aria compressa (Fig. 3). L’apparato radicale è successivamente pulito, essiccato e pesato. In sostanza, emerge che lo scavo è un metodo molto dispendioso, per i costi economici, lo sforzo lavorativo ed il tempo necessario, ma risulta di gran lunga il più preciso dei 3 metodi segnalati (Fig. 4). Gli altri due metodi, trivella e monoliti, al contrario sono meno distruttivi e costosi, sebbene per aumentare la scarsa precisione della singola misura diventano necessari molti prelievi, aumentando conseguentemente i costi. Per questi motivi, la quantità di dati disponibili in letteratura da misure dirette degli apparati radicali è molto limitata. Ad ogni modo, la scelta del metodo di misura della massa radicale deve rappresentare un compromesso tra la precisione desiderata, il costo e la fattibilità della misura stessa ([4]).
Fig. 3 - Scavo di Picea abies L. con la pistola ad aria compressa ([42]).
Fig. 4 - Scavo di un apparato radicale di Quercus Pubescens Willd. ([14]).
Processi inventariali
Nella fase inventariale in corso in Italia, il calcolo della quantità di C fissata nelle foreste, si basa su dati relativi alla provvigione legnosa, su stime sulla distribuzione della biomassa fra fusto, rami, foglie e radici, come pure su dati riguardanti la densità del legname ed il suo tenore di C. Dai dati di provvigione legnosa, tramite i fattori di espansione di biomassa (BEF), si calcola una stima della biomassa totale epigea. La maggiore incertezza legata a tale estrapolazione è data dalla difficoltà di rilevare la biomassa ipogea. Per realizzare la stima della biomassa radicale, e dunque della quantità di C fissata sotto la superficie del terreno, viene applicata una correlazione empirica che fissa il rapporto tra biomassa ipogea ed epigea ad un valore intorno al 20% ([37]).
Stima della biomassa radicale
Dalle misure di biomassa radicale, sono stati formulati diversi modelli di stima della biomassa ipogea totale, e dunque della quantità di C fissata sottosuolo in modo "permanente" nell’apparato radicale. Basandosi su dati misurati e di letteratura, Santantonio et al. ([50]) hanno proposto che la biomassa radicale venga considerata intorno al 20% della biomassa totale aerea, indicando che la maggiore parte della biomassa ipogea nelle foreste è contenuta nelle grosse radici - generalmente definite come quelle sopra i 2 mm di diametro. Anche secondo MacDicken ([36]), il rapporto tra biomassa ipogea ed epigea è vicino a 0.2, con variabilità dipendente dalla specie. Confronti delle stime di produzione di radici fini tramite minirizotrone e dei flussi di CO2 dal suolo indicano che, in foreste dominate da Pinus spp. nel sud est degli USA, approssimativamente il 22-25% di C allocato sottosuolo è legato a componenti strutturali ([24]). Il database compilato da Li et al. ([32]) che include 443 riferimenti per foreste temperate e boreali di conifere e latifoglie risulta in un rapporto fra biomassa totale ipogea ed epigea di circa 0.26.
Per di più, variazioni di biomassa in relazione con la specie, la fertilità o l’età complica ulteriormente la stima della biomassa delle radici strutturali, specialmente in foreste miste o di età o di specie che generalmente si riscontrano in natura.
Le radici di alberi vecchi devono essere estese per fornire risorse e molto grosse per sopportare un’imponente parte aerea. Per esempio, Nepstad et al. ([43]) dimostro che le radici strutturali possono estendersi anche di più di 7 metri nel suolo in una stagione in un foresta tropicale. In maniera simile, studi in foreste ripariali hanno mostrato che le radici di alcuni alberi (i.e., Populus fremontii) possono estendersi di parecchi metri nel suolo per catturare le acque fluttuante ([39]).
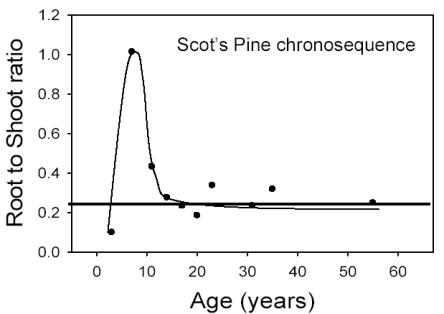
La variazione del rapporto root/shoot messo in relazione con l’età del popolamento può essere dinamica (Fig. 5), ma i modelli usano generalmente un valore fisso del rapporto. Per conseguenza, questi modelli sottostimano grandemente la biomassa radicale dei popolamenti giovani.
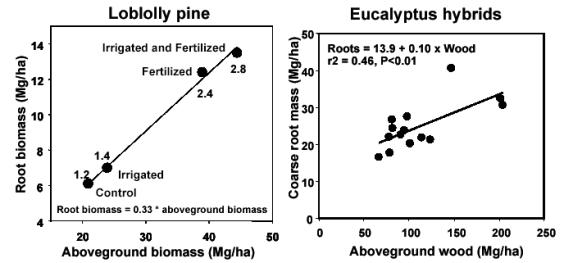
Litton et al. ([34]) hanno riportato che la biomassa radicale, come proporzione della biomassa totale, diminuisce con l’aumento della biomassa forestale totale [radici/biomassa totale = 0.558 - 0.041 ln(biomassatotale); r 2= 0.35; n= 45; P< 0.01]. Questa diminuzione è per lo meno collegata all’età ed alle dimensioni degli alberi, poiché i valori maggiori di radici/biomassa totale sono stati trovati per foreste giovani di conifere (< 25 anni). La diminuzione del rapporto radici/biomassa totale rappresenta del resto la riduzione dell’importanza delle radici strutturali in confronto alla biomassa totale, considerando che la maggiore parte della biomassa è nelle radici strutturali. Questi risultati confermano altri studi che suggeriscono come piante giovani abbiano valori maggiori di radici/biomassa totale ([16], [38], [33]). Albaugh et al. ([1]) hanno dimostrato che il rapporto root/shoot di Pinus Taeda non cambia con l’apporto d’acqua o di fertilizzanti. Al contrario, Stape et al. ([53]) hanno osservato che in piantagioni di Eucalyptus il rapporto root/shoot diminuisce da 0.32 a 0.16 con l’aumento di fertilità del sito (Fig. 6).
Lavori recenti ([32]; [7]) dimostrano differenze di questo rapporto tra conifere e latifoglie.
Per quanto riguarda i boschi governati a ceduo esistono pochi lavori che portano sullo studio dell’apparato radicale. In letteratura, si assume generalmente che l’apparato radicale è molto sviluppato rimanendo per diversi turni. Per conseguenza, diversi autori avanzano l’ipotesi che il rapporto biomassa radicale su biomassa ipogea dovrebbe essere più alto rispetto ai valori per i boschi ad alto fusto.
Quando attendibili dati inventariali di diametro (DBH) e volume della parte aerea delle piante sono disponibili, queste informazioni possono essere utilizzate per derivare una stima della biomassa radicale. La precisione di queste stime dipende molto dal numero e dalla selezione del campione, come suggerito da Kittredge ([30]) e Satoo ([51]), i quali proposero l’uso d’equazioni di regressione allometriche della massa di una certa parte dell’albero in funzione del DBH, sotto la seguente forma (eqn. 3):
dove W rappresenta la massa secca di una certa parte dell’albero, DBH il diametro a petto d’uomo, mentre a e b sono i coefficienti della regressione. Bolte et al. ([7]) hanno utilizzato lo stesso tipo di regressione, ed osservato un’ottima correlazione tra biomassa radicale delle radici strutturali e DBH per i boschi studiati. Ma questi autori hanno rilevato che le relazioni da loro trovate sono molto diverse da quelle riportate in letteratura, ed hanno concluso che diversi fattori, come ad esempio la stazione o la competizione tra alberi, influenzano grandemente l’allocazione di biomassa nelle radici.
Mentre questo tipo di regressione ha dimostrato la sua utilità in numerosi tipi di foreste ([48], [44], [46]), una stima più esatta può essere fatta utilizzando il prodotto DBH2 h, dove h è l’altezza dell’albero ([45]). Tuttavia, Bunce ([8]) ha dimostrato che l’inclusione dell’altezza nell’equazione migliora solo marginalmente la stima del peso degli elementi dell’albero.
La conoscenza del peso del fusto può generalmente aumentare la precisione della stima considerando la correlazione con la biomassa radicale ([45]). Numerosi modelli sono stati formulati correlando l’allocazione relativa di massa secca tra radici e parte aerea ([10], [18], [31], [40]). Questi modelli hanno prodotto delle stime molto variabili di biomassa radicale e produzione di radici, principalmente per la mancanza d’informazioni sulle dimensioni ed il numero delle radici, sulle differenze specifiche, sul metodo di campionamento e sull’interazione di queste variabili con le diverse condizioni pedoclimatiche.
Generalmente le incertezze sul valore di biomassa delle radici strutturali hanno delle grandi conseguenze per i bilanci globali di C. Per esempio, dei 60PgC allocati sottosuolo dalle piante alle radici e le mycorrize, almeno la metà viene assimilata negli ecosistemi legnosi ([20]). Nonostante le conoscenze limitate sulla distribuzione del C sottosuolo ([17]), si può dire che approssimativamente il 10% del C allocato sottosuolo negli ecosistemi legnosi è diretto verso le radici strutturali (3PgC). Se i metodi correnti di stima della biomassa radicale producono una sottostima media del 20%, globalmente 0.6PgC della NPP delle radici strutturali in ecosistemi forestali vengono omessi. Quest’ultima cifra rappresenta approssimativamente il 10% delle emissioni annuali globali dovute ai combustibili fossili.
Influenza della forma di governo sul sequestro di carbonio
Il bilancio della fissazione di CO2 in ambiente forestale è di complessa determinazione. Il ciclo del C è anche soggetto a repentine variazioni che dipendono soprattutto dagli interventi antropici cui la foresta è sottoposta. Nonostante che nelle foreste ad equilibrio naturale stabile la quantità di C sia elevata negli organismi vegetali ed animali come nel suolo, nei boschi in equilibrio colturale o artificiale (per esempio nei boschi cedui) una forte crescita è periodicamente stimolata (ceduazione cui segue l’emissione dei nuovi polloni) ma di regola solo per periodi limitati; la massa ipogea e soprattutto il suolo, esposto a rapide mineralizzazioni ed a frequenti fenomeni d’erosione superficiale, tendono così a ridurre fortemente la loro capacità d’accumulo di C. I cicli lunghi caratteristici delle foreste e dei boschi d’alto fusto sono, quindi, preferibili a quelli brevi dei boschi cedui per ciò che riguarda la fissazione di C e la quantità stoccabile di quest’elemento; ciò, peraltro, comporta una conservazione duratura del C fissato nell’ecosistema, ovvero, in seguito ad utilizzazione, nei prodotti legnosi da opera, mentre il prodotto dei cedui, prevalentemente destinato alla combustione, finisce per restituire in atmosfera, in breve tempo, tutto il C fissato azzerandone l’accumulo e, temporaneamente, anche l’assorbimento.
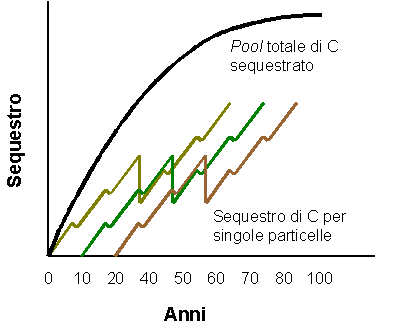
Altre importante categorie di copertura del suolo, accanto a foreste e boschi più o meno razionalmente gestiti od in abbandono, che fissano C in quantità diversificate sono gli ex coltivi e i pascoli abbandonati invasi da vegetazione spontanea e gli impianti per l’arboricoltura da legno a ciclo medio-lungo, come pioppeti, noceti ed altre latifoglie nobili (10-60 anni) od a ciclo breve per produzione di biomassa legnosa (Short Rotation Forestry), come pioppeti, saliceti e robinieti (1-5 anni). Va tenuto presente che il rapido accumulo di C immagazzinato in piantagioni a rapido accrescimento (con turni di 4-20 anni) non può essere sostenuto a lungo ([58]). La NPP di queste piantagioni può, infatti, rimanere alta, ma la respirazione della biomassa accumulata provoca la rapida diminuzione del C assorbito. Il mantenimento di un forte carattere di sink per la CO2 atmosferica in queste formazioni forestali richiede la loro stessa utilizzazione; ma è il destino degli assortimenti legnosi ricavabili a determinare se le piantagioni possano rappresentare un sink di lungo termine o meno. Piantagioni sottoposte a rapida rotazione crescono velocemente per 4-5 anni, ed alla fine del ciclo sono tagliate ed usate interamente come combustibile d’alimentazione per piccole centrali a biomassa. In questo caso, durante il periodo di crescita, la rimozione netta di CO2 dall’atmosfera è effimera, poiché la CO2 torna nell’atmosfera medesima alla fine della rotazione. A meno che la biomassa prodotta in queste piantagioni non rimpiazzi l’equivalente combustibile fossile che sarebbe consumato altrimenti, queste foreste potranno indurre solo un ritardo momentaneo dell’accumulo di CO2 nell’atmosfera. In un bosco (anche ceduo) con turno superiore ai 20 anni, gran parte del C accumulato risiede invece sottosuolo e quello del soprassuolo potrebbe costituire legno da opera permanente. In questo caso il C fissato dalla foresta rimane in forma organica per più decadi, e l’incremento legnoso del turno successivo aggiunge ulteriore C a quello immagazzinato. L’IPCC esige che ogni raccolta di prodotti forestali sia trattata come un’emissione di CO2 nell’atmosfera. La combinazione di una serie di soprassuoli forestali tra loro limitrofi in un unico pool di C potrebbe livellare, nel tempo, lo stock di C. Per esempio, un’unità di gestione programmata per un periodo di rotazione con classi d’età bilanciate sequestrerà C durante la prima rotazione, per poi stabilizzarsi (Fig. 7).
Fig. 7 - Andamento dell’accumulo di C sequestrato da un bosco nel tempo. Una sequenza di classi d’età del soprassuolo può essere gestita sia per la produzione legnosa sia per il sequestro di C.
Inoltre la forma di governo di una foresta influenzerà l’input di C nel suolo (attraverso la produttività delle piante), i tassi di decomposizione della lettiera (per mezzo delle condizioni climatiche, e della quantità e qualità dei residui sopraggiunti), e quindi il C del suolo. Nel breve periodo, la distanza fra le piante (sesto d’impianto, densità delle ceppaie o dei fusti) influisce sulla temperatura, l’umidità e la quantità di lettiera, e determina anche il tempo richiesto per raggiungere la chiusura delle chiome. Questi fattori influenzano fortemente i tassi di decomposizione. Nel lungo periodo, la distanza pianificata fra le piante ha poco effetto sul tasso di crescita della foresta; ad elevate densità, gli alberi possono arrestare lo sviluppo, riducendo l’input di C al suolo. Binkley & Resh ([5]) hanno trovato che la variazione di C nel suolo non era in relazione con la distanza fra le piante. L’intensità di tagli e diradamenti può influenzare il ritorno del C al suolo attraverso residui epigei e per decomposizione delle radici. In ogni caso la rimozione di piante vive espone il suolo ad una più intensa insolazione e maggiori temperature, e di conseguenza velocizza la decomposizione della sostanza organica; quindi, a meno che la rimozione dei detriti legnosi non diminuisca i nutrienti, i cambiamenti del C nel suolo dipenderanno dall’intensità del taglio e potrebbero essere poco significativi a lungo termine ([23]).
La ceduazione influenza l’input dei residui radicali al suolo. Le radici rimangono vive in un bosco governato a ceduo, riducendo la quantità di C potenzialmente fissabile. A controbilanciare ciò è il più rapido accumulo di biomassa, cosicché il bilancio del C dell’ecosistema può essere simile fra boschi cedui e d’alto fusto. In piantagioni a rapido accrescimento, gli alberi sono piantati a densità elevate con turni brevi, senza diradamenti intermedi. Nei cedui tradizionali e nei boschi d’alto fusto le rotazioni sono spesso superiori ai 25 anni e le densità più basse, ed i tagli intermedi sono più o meno frequenti. Il turno ha un forte impatto sul C nel suolo per gli effetti sulla frequenza dei disturbi durante le operazioni di taglio. Rotazioni brevi senza modifiche sostanziali allo stato nutrizionale porteranno a maggiori perdite di C del suolo ([56]), risultando nel lungo periodo in un declino del C immagazzinato nel suolo ([22]).
Conclusioni
A livello globale, le foreste sono attualmente considerate come sink per la CO2 atmosferica ([26]), a significare che il C utilizzato nella crescita della vegetazione su tutto il globo terrestre eccede ancora leggermente le emissioni per deforestazione o tagli. La protezione delle foreste primarie, la ricostituzione d’ecosistemi forestali degradati e la gestione sostenibile dei boschi produttivi, quindi, sono argomenti chiave per le politiche dei Paesi industrializzati che hanno ratificato il Protocollo di Kyoto e le convenzioni per proteggere la biodiversità e per combattere la desertificazione. Dalle foreste e dalle modalità di gestione cui queste vengono sottoposte, dipende la concreta possibilità di sottrarre efficacemente CO2 dall’atmosfera, nonché di mantenerla fissata evitando che si accumuli e permanga nell’ambiente allo stato gassoso. Al fine di perseguire gli obiettivi di riduzione della concentrazione di CO2 atmosferica sottoscritti nel protocollo di Kyoto, è indispensabile affermare subito che non possono essere estranei alle azioni attivate nei riguardi delle foreste anche i fondamentali passaggi successivi della filiera “foresta, legno, industria-artigianato”, che attengono ad altri comparti collegati (trasporto, commercio ed attività di trasformazione con impiego di materiali rinnovabili). Il ruolo delle foreste è peraltro complementare a quello d’altre azioni previste dal Protocollo di Kyoto volte a ridurre l’impiego dei combustibili fossili: le foreste assumono sempre più decisamente non solo la funzione di polmone per l’accumulo della CO2 atmosferica, ma anche di serbatoio di biomasse da destinare alla produzione d’energia pulita e rinnovabile. Queste due funzioni possono essere armonizzate e mantenute nel tempo in modo equilibrato, attraverso l’adozione pianificata di sistemi colturali razionali e la promozione sul territorio di destinazioni d’uso sostenibili - in pratica tecnologicamente efficienti ed affiancate dalla contemporanea riduzione del consumo di combustibili fossili - delle biomasse utilizzate. In pratica un ritorno acritico alla forma di governo a ceduo in modo generalizzato su ampi territori montani, grazie alla continua crescita del relativo mercato della legna da ardere, avrebbe si il pregio di sostituire parzialmente i combustibili fossili con biomasse rinnovabili a scala territoriale dove la filiera sia mantenuta corta, ma comporterebbe comunque aspetti critici anche d’ordine idrogeologico, paesistico e naturalistico. A livello regionale, nazionale ed internazionale, sono state attivate diverse azioni inventariali delle risorse forestali con la finalità di ottenere una stima precisa delle riserve e della capacità d’assorbimento di C negli ecosistemi forestali. In queste azioni, la biomassa radicale viene estrapolata empiricamente dai valori di biomassa epigea; in genere, il valore di biomassa ipogea è considerato uguale a circa 0.20 il valore di biomassa epigea spesso sottostimando il valore reale di biomassa radicale complessivo. In questo lavoro, sono stati illustrati i metodi più comuni di misura diretta della biomassa radicale rilevandone le numerose difficoltà. La biomassa ipogea si può suddividere in biomassa permanente (radici strutturali) e biomassa a ciclo veloce (radici fini). Sono stati elencati diversi modelli che permettono una stima della biomassa delle radici strutturali, che rappresentano la componente principale di biomassa, in funzione di caratteristiche dendrometriche a scala di popolamento. Dalla letteratura si evince come la biomassa radicale, sia come produzione di radici fini che come allocazione verso le radici strutturali, varia grandemente con le condizioni stazionali per una stessa specie legnosa, aggiungendosi alla variabilità all’interno del popolamento. Questa variabilità risulta in incertezze nelle stime della biomassa radicale che possono portare ad errori notevoli nelle azioni inventariali. Lo sviluppo di modelli capaci di prendere in considerazione i parametri stazionali, e dunque capaci di riprodurre questa variabilità, appare indispensabile per affrontare le diverse fasi inventariali con una precisione accettabile.
Box 1
Progetti di ricerca al livello europeo
L’Unione Europea (UE) ha recentemente promosso, tra le altre, l’Azione COST E43 (⇒ http://www.metla.fi/eu/cost/e43/) “Harmonisation of National Forest Inventories in Europe: Techniques for Common Reporting”per migliorare ed armonizzare gli Inventari Forestali Nazionali in Europa, e sostenere la realizzazione di nuovi inventari per andare incontro alle necessità a livello nazionale, europeo e globale d’aggiornamento degli stessi ([11]). L’obiettivo è anche quello di massimizzare la sinergia tra Inventari Forestali Nazionali e processi e politiche a livello europeo e globale che necessitano di informazioni sugli ecosistemi forestali. Perplessità nell’inventariare il C sono determinate dalla difficoltà di quantificare il flusso di C nel e dal suolo, in relazione alle attività umane (cambiamenti d’uso del suolo, gestione del territorio, etc.) ed ai cambiamenti ambientali (variabilità climatica, incendi boschivi, etc.).
References
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar