The effects of ozone on Mediterranen forests
Forest@ - Journal of Silviculture and Forest Ecology, Volume 4, Pages 478-487 (2007)
doi: https://doi.org/10.3832/efor0490-0040478
Published: Dec 20, 2007 - Copyright © 2007 SISEF
Research Articles
Guest Editors: Joint Session SITE-SISEF (Viterbo 2006)
« Forests and Climate: 10 years of Research in Italy »
Collection/Special Issue: Paolo De Angelis, Riccardo Valentini
Abstract
Tropospheric ozone (O3) is the most important air pollutant because of its effects on forests and relationships with climate change. Results obtained by IPP-CNR in recent years suggest Mediterranean forests are less O3 sensitive than they were thought before. This does not imply that Mediterranean forests are free of any O3 damage. Visible foliar injury, stomatal alterations (increased night-time transpiration, delayed closure in response to water and light variations), increased susceptibility to other stressors (drought, weak parasites) as well as background O3 levels exceeding European standards, confirm O3 pollution as a serious concern to Italian forests. To protect forests from O3 effects, Europe uses one only exposure index, i.e. AOT40, for the entire continent. Researchers now know that O3 exposure does not summarize the real potential of O3 injury to vegetation. A new concept of “flux” has been developing and includes avoidance through stomatal closure and tolerance through detoxification and damage repair. Validating the O3 flux approach implies a great deal of scientific effort. Meanwhile, different AOT40 thresholds on a geographic or plant-type basis may be tested.
Keywords
Ozone, Flux, Stomatal conductance, Avoidance, Detoxification, Flux, Tolerance
Introduzione
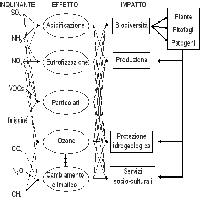
L’inquinante più interessante per i suoi effetti negativi sulle foreste e le sue relazioni col cambiamento climatico è l’ozono (O3) troposferico ([1], [43]). I cambiamenti climatici, soprattutto l’aumento della temperatura e della radiazione, promuovono l’aumento delle concentrazioni atmosferiche di O3, in presenza dei precursori. A sua volta, un elevato livello di base di O3 influenza il clima sia direttamente, in quanto l’O3 è esso stesso un potente gas serra, sia indirettamente, in quanto l’O3 va ad influenzare la concentrazione di altri gas serra come il metano. In Europa, il bacino del Mediterraneo, e l’Italia in particolare, sono considerati a maggior rischio di O3 a causa delle condizioni climatiche prevalenti ([30]). Inoltre, per la sua posizione intermedia tra il clima tropicale e subtropicale africano e il clima temperato delle medie latitudini europee, il bacino del Mediterraneo è anche considerato come l’area europea a maggior rischio di conseguenze ad opera del cambiamento climatico ([18]).
L’Italia è uno dei Paesi mediterranei più attivi nello studio degli effetti dell’O3 sulle foreste. Questo lavoro riassume i principali risultati raggiunti sul tema ozono e foreste dal gruppo di ricerca dell’IPP-CNR, inquadrandoli nel contesto generale e delineando le prospettive per future ricerche.
L’inquinamento da ozono
L’inquinamento da O3 è un problema per tutte le foreste dei paesi industrializzati e in via di industrializzazione ([20]). Contrariamente a quello che alcuni pensano, le concentrazioni di O3 sono sempre più elevate nelle aree rurali che in quelle cittadine ([30]). Essendo un inquinante secondario prodotto da un complesso di reazioni che coinvolgono principalmente composti organici volatili e ossidi di azoto in presenza di luce, l’O3 può formarsi anche a grande distanza dalle fonti dei precursori. Inoltre, mentre l’elevato inquinamento urbano (soprattutto da monossido di azoto) ne favorisce la degradazione, i composti organici volatili emessi dalla vegetazione ne favoriscono la formazione, essendo anche più reattivi degli idrocarburi antropogenici ([27]). Come riassunto da Paoletti et al. ([30], [38]), l’O3 e i suoi precursori sono stabili nell’alta circolazione atmosferica e possono quindi essere trasportati da un continente ad un altro, contribuendo a mantenere elevati livelli di base di O3 anche in aree remote, nonostante una generalizzata riduzione dei picchi (dovuta al progresso tecnologico e a limitazioni normative), tanto che si stima che nel 2100 la metà delle foreste mondiali sarà esposta a concentrazioni potenzialmente tossiche. I Paesi mediterranei costituiscono l’area europea con le concentrazioni di O3 più alte; per es., in Italia si registrano livelli che sono in media 3 volte superiori a quelli svedesi ([10]).
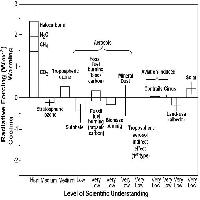
Negli anni, i ricercatori hanno sviluppato una serie di indici di esposizione all’O3, fra i quali il più rilevante per la vegetazione europea è l’AOT40, il quale presume che la vegetazione non subisca danni con concentrazioni inferiori a 40 ppb ed integra tutte le concentrazioni orarie eccedenti tale soglia durante le ore di luce, con l’assunto che al buio gli stomi siano chiusi e l’O3 non possa entrare a danneggiare le piante. Sulla base dell’AOT40, l’Europa ha stabilito i suoi livelli critici per l’O3, oggi definiti come quei livelli sopra cui ci si aspettano effetti negativi sulla crescita della vegetazione sensibile (per una rassegna, vedi [14]). I livelli normativi variano da 3, 5, 6 ppm h AOT40 per i vari tipi di recettori (specie agrarie, forestali, orticole) per le nazioni che aderiscono all’UNECE (Italia inclusa), fino a 9 ppm h AOT40 per tutti i tipi di vegetazione, secondo la così detta Direttiva figlia (2002/03/CE) che entrerà in vigore dal 2010, vincolando tutti gli Stati membri dell’Unione.
L’Italia, purtroppo, si trova a fronteggiare una carenza di dati per le stazioni remote, rappresentative dei livelli di O3 in foresta, dato che la maggior parte delle centraline di rilevamento automatico è collocata in città ([30]). Esaminando i dati di 14 stazioni remote distribuite da nord a sud Italia nel periodo 2000-2004, si evince che i livelli di O3 superano ampiamente e regolarmente gli standard europei e nord-americani ([36]). In media, i valori di AOT40 per le specie agrarie, orticole e forestali superano di 4, 2.5 e 5.4 volte i livelli critici UNECE, mentre l’AOT40 per tutti i tipi di vegetazione è 1.76 volte superiore al valore bersaglio indicato dalla Direttiva 2002/03/CE (Tab. 1). La media dei picchi settimanali supera del 45% la soglia delle 40 ppb. La media giornaliera oscilla tra 22 e 40 ppb. La distribuzione dei picchi eccedenti le 90, 100 e 120 ppb (corrispondenti rispettivamente al valore bersaglio e alle soglie di informazione e di allarme definiti dalla Direttiva 2002/03/CE) varia a seconda della stazione. Del resto, i cicli di O3 dipendono fortemente dalla topografia della stazione considerata e possono mostrare notevoli differenze anche a distanza di poche decine di chilometri, suggerendo che la rete italiana di centraline di monitoraggio dovrebbe essere implementata. Il superamento delle soglie proposte dalla CE dovrebbe incoraggiare l’Italia a prendere le misure appropriate per ridurre il rischio da O3 su tutto il proprio territorio.
Effetti dell’ozono sulle foreste mediterranee
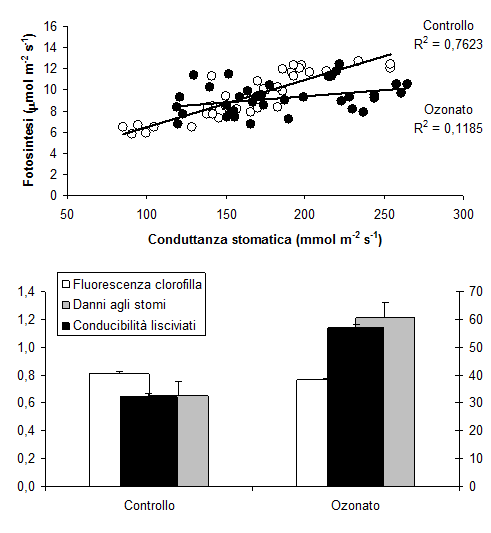
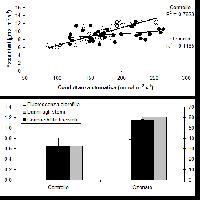
Visti i superamenti del livello critico, ci aspetteremmo forti danni da O3 alle nostre foreste, perché tutti gli studi in condizioni controllate mostrano effetti negativi evidenti su fisiologia, biochimica, morfo-anatomia delle specie investigate. Per esempio, un ampio studio su cloni di Faggio (Fagus sylvatica L.), esposti a 150 ppb O3, corrispondenti a 1.35 x i picchi orari nell’Italia rurale, ha dimostrato il danneggiamento degli scambi gassosi, con disaccoppiamento tra fotosintesi e conduttanza stomatica, l’aumento della perossidazione lipidica delle membrane, e l’alterazione della struttura degli stomi osservata al microscopio elettronico a scansione (Fig. 1 - [38]). Comunque, le limitazioni non-stomatiche indotte dall’O3 alla fotosintesi prevalevano su quelle stomatiche, e le reazioni luminose della fotosintesi (p.e., il tasso di trasporto elettronico) rispondevano all’O3 più precocemente di quelle della fase oscura (p.e. il massimo tasso di carbossilazione - [22]). Tre latifoglie sempreverdi mediterranee, Phillyrea latifolia L. (Fillirea), Arbutus unedo L. (Corbezzolo), Laurus nobilis L. (Alloro), esposte a 110 ppb O3, dopo 90 giorni mostravano una riduzione del contenuto idrico fogliare e un aumento della conducibilità elettrica dei lisciviati fogliari, ad indicare una condizione di stress idrico (nonostante la regolare irrigazione) ed un’alterazione della capacità di ritenzione delle membrane ([29]). La riduzione della fotosintesi era dovuta alla chiusura degli stomi. Comunque, l’effetto principale era l’aumento della traspirazione, più che la riduzione della fotosintesi, portando ad ipotizzare la perdita di controllo idrico come meccanismo principale del danno da O3 in queste specie ([28]). Analizzando la fluorescenza della clorofilla a, si è notato che l’esposizione a livelli di O3 doppi rispetto a quelli ambientali provoca la riduzione della densità e l’aumento dell’attività dei centri di reazione nelle sezioni trasversali del Fotosistema II ([26]). In pratica, l’O3 altera la funzionalità del Fotosistema II modificandone la struttura: i centri di reazione sono meno frequenti, ma sono più attivi nell’assorbire, intrappolare, circolare e dissipare energia. Alloro e Fillirea avevano sviluppato delle piccole chiazze clorotiche sulle foglie, mentre nel Corbezzolo le lesioni erano rossastre ([11]). In tutti i casi, le macchie erano a contorno irregolare, internervali e solo sulla pagina superiore. Nonostante l’elevato livello di esposizione all’O3, l’estensione dei sintomi visibili era inferiore all’8% dell’area fogliare campionata, facendo ipotizzare una buona tolleranza all’O3 nelle sclerofille mediterranee.
Se ci spostiamo dalle condizioni controllate a quelle di campo, gli effetti dell’O3 sulle foreste sono difficili da rintracciare. Per esempio, in piante adulte di Faggio cresciute a Pian di Novello (Toscana), la traspirazione fogliare diurna non risultava influenzata dalla presenza di sintomi visibili di danno da O3 sulle foglie ([21]). Questi sintomi sono in realtà definiti “tipo-ozono“ o ”attribuibili ad ozono”, perché possono essere facilmente confusi con quelli prodotti da altre cause. Sebbene siano tipici di ogni specie, si possono individuare alcune caratteristiche distintive per differenziarli da quelli non indotti dall’O3 ([15]): (1) Il danno tipo-ozono si esprime usualmente come una punteggiatura scura (più piccola di 1 mm) sulla pagina superiore della foglia oppure come una pigmentazione diffusa sulla pagina superiore, che può consistere in una bronzatura o in un arrossamento. In entrambi i casi, la pagina inferiore della foglia è esente da sintomi. Solo verso la fine della stagione, il danno da O3 può manifestarsi anche sulla pagina inferiore. (2) I sintomi non sono mai presenti sulle nervature. (3) Normalmente le foglie verso la base dei rametti cioè quelle più vecchie mostrano i sintomi più estesi, perché sono state esposte più a lungo (effetto età). (4) L’effetto ombra di una foglia sovrapposta impedisce il manifestarsi dei sintomi sulla parte ombreggiata della foglia sottostante.
In Italia, i sintomi fogliari tipo-ozono sono stati segnalati su varie specie di latifoglie ([15], [24], [30]). In alcune specie, soprattutto sempreverdi, sia conifere che sclerofille mediterranee, questi sintomi non sono stati ancora diagnosticati in campo. Fanno eccezione alcuni pini, come il Pinus cembra L. e il P. halepensis Mill. ([19]). Per le specie che non mostrano sintomi visibili di danno tipo-ozono, come il Leccio (Quercus ilex L.), si possono eseguire studi di campo su transetti, confrontando cioè siti con un diverso carico di inquinamento da O3. Analizzando una stazione mesica ed una xerica, Laakso et al. ([8]) hanno dimostrato che il livello di O3 influenza le caratteristiche morfologiche fogliari (in particolare, la densità degli stomi e la quantità di cere epicuticolari) più che le caratteristiche ecologiche del sito. Tuttavia, le caratteristiche ambientali possono anche mascherare le risposte delle piante all’O3. È il caso dell’analisi del polline prodotto da pini (P. nigra Arnold) distribuiti lungo un gradiente di O3 e di altitudine in Trentino ([4]). Poiché le concentrazioni di O3 aumentano con l’altitudine e il polline esposto all’O3 riduce la propria vitalità, ci si attendeva che il polline raccolto nelle stazioni in quota (1000-1300 m s.l.m.) fosse meno vitale di quello prodotto nelle stazioni di fondo valle (200-300 m s.l.m.). Al contrario, si è osservata una correlazione positiva tra vitalità e concentrazioni di O3. Poiché il traffico veicolare si concentra nei fondo valle, si presume che la miscela di inquinanti emessa dal traffico abbia danneggiato il polline più che l’O3 per se, anche in considerazione del fatto che le massime concentrazioni orarie di O3 misurate in quota non erano tali da indurre serie alterazioni nel polline (< 100 ppb). Artefatti di questo genere devono essere attentamente controllati per poter procedere ad un efficace biomonitoraggio.
Solo un’ampia base inventariale, come quella della rete europea di siti forestali di monitoraggio permanente (ICP), può permettere di svincolare gli effetti stazionali da quelli dell’O3. Tuttavia, se analizziamo la crescita forestale, che è il parametro a cui si riferiscono i livelli critici UNECE, non si riscontra un chiaro effetto dell’O3 (espresso in termini di AOT40) sull’area basimetrica delle specie investigate nelle aree permanenti italiane della rete ICP (CONECOFOR - [3]).
Le possibili cause di incongruenza fra alti livelli di O3 e non altrettanto alti sintomi in area mediterranea sono varie ([19]): prima di tutto il fatto che le relazioni dose-risposta sono state desunte da esperimenti su semenzali in condizioni controllate, ed è ovvio che l’estrapolazione a piante adulte in campo può essere suscettibile di errore. Inoltre, gli effetti dell’O3 sulla crescita forestale, essendo stati studiati sempre in condizioni controllate, non sono ancora certi e quindi è sorprendente che si scelga proprio la crescita come indicatore di danno in campo. Infine, i condizionamenti imposti dall’ambiente e quelli determinati dall’ecologia delle piante mediterranee possono ridurre l’assorbimento dell’O3 all’interno delle foglie e la sensibilità delle piante all’O3. In pratica, è possibile che i livelli critici siano sottostimati perché basati, come da definizione, sul materiale più sensibile nelle condizioni più favorevoli all’assorbimento. Una condizione, però, che si verifica raramente, soprattutto in area mediterranea.
In particolare, i livelli di O3 sono più alti nelle ore del giorno e nei periodi dell’anno in cui gli stomi si chiudono a causa dello stress idrico (evitanza - [10]). Per questo, a livello UNECE, si vuole passare da un livello critico basato su quanto O3 c’è nell’ambiente (l’esposizione, definita da indicatori quali l’AOT40), ad un livello basato su quanto O3 viene assorbito dalla pianta (il flusso stomatico - [10]), il che ridurrebbe notevolmente il rischio da O3 per l’Italia. Inoltre, in genere, il flusso stomatico di O3 non viene misurato, ma calcolato sulla base della conduttanza stomatica al vapor d’acqua, moltiplicata per il coefficiente di conversione che tiene conto delle diffusività dell’acqua e dell’O3. La misura diretta del flusso stomatico di O3 a livello fogliare ha però mostrato che il calcolo convenzionale del flusso generalmente induce una sovrastima del 25-50% ([6]). Se validato per l’area mediterranea e inserito nei modelli di flusso di O3, questo risultato porterebbe a ridurre il rischio da O3 per le nostre foreste.
Un ulteriore difetto dei modelli attuali è che sono basati su misure di flusso a stato stazionario, mentre è stato dimostrato che uno degli effetti più subdoli dell’O3 è l’alterazione dei meccanismi di chiusura stomatica in risposta agli stress ([16], [6]). In seguito all’esposizione all’O3, infatti, gli stomi sono più lenti nel rispondere alla riduzione dell’intensità luminosa e all’aumento dello stress idrico. Questo effetto è stato dimostrato sia in specie agrarie e forestali non native ([6]), sia in una latifoglia sempreverde mediterranea (A. unedo, [16]). Nel Corbezzolo, 90 giorni di esposizione a 110 ppb O3 non provocano alcuna variazione della conduttanza stomatica, quando questa misura è effettuata a stato stazionario, portando a suggerire questa specie come tollerante l’O3. La dinamica delle risposte stomatiche a variazioni luminose o idriche è invece alterata dall’O3 in modo significativo e persistente, in quanto l’effetto è misurabile addirittura 10 giorni dopo l’interruzione dell’esposizione all’O3. La modellizzazione dell’effetto dell’O3 sulla dinamica delle risposte stomatiche agli stress potrebbe aggravare, invece che ridurre, il rischio di danni da O3 nelle foreste mediterranee.
Un altro fattore non inserito nei modelli attuali è rappresentato dalla traspirazione notturna. In passato, si riteneva che le piante non traspirassero di notte perché gli stomi si chiudono in risposta al buio. Oggi, invece, sappiamo che molte specie arboree manifestano una parziale attività traspirativa anche di notte, per quanto il significato funzionale di questo fenomeno non sia ancora conosciuto. Grulke et al. ([7]) hanno dimostrato che 1-2 mesi di esposizione all’O3 (70 ppb per 8 h al giorno) aumentano di 1.6-1.8 volte la traspirazione notturna in due specie di querce californiane. Anche una sola ora di esposizione acuta (150-220 ppb) porta a raddoppiare la traspirazione notturna in Quercus douglasii Hook & Arn. L’incompleta chiusura notturna degli stomi è stata osservata anche in Frassini adulti (Fraxinus excelsior L.) cresciuti nel torinese ([41]) ed esposti ad elevati livelli di O3 ambiente (oltre 6 volte il livello considerato critico per le foreste). La conduttanza stomatica aumentava durante la stagione vegetativa in tutte le piante, ma raggiungeva i valori più alti nei Frassini che presentavano sintomi fogliari tipo-ozono, mentre le piante trattate con un antiossidante per proteggerle dall’effetto dell’O3 (etilendiurea, EDU) mostravano i livelli di conduttanza più bassi. L’alterazione dei meccanismi di chiusura notturna degli stomi ad opera dell’O3, oltre ad aggravare le perdite idriche notturne, aumenta la quantità di O3 assorbito nelle 24 ore. Inoltre, durante la notte il potenziale di detossificazione è più basso ([19]) e questo può generare seri danni in presenza di elevate concentrazioni notturne di O3, come accade nei siti remoti italiani ([36]).
Oltre ai condizionamenti a breve termine imposti dall’ambiente, un fattore che può contribuire ad aumentare la tolleranza all’O3 delle nostre foreste è legato agli adattamenti a lungo termine. Abituate a fronteggiare altri stress ossidativi come la siccità e l’eccesso di luce, le piante mediterranee posseggono un pool antiossidante molto attivo, che potrebbe essere attivo anche per la detossificazione dell’O3 all’interno del mesofillo ([19]). Per esempio, in tre sclerofille sempreverdi, Nali et al. ([11]) hanno osservato che la fotosintesi netta del Corbezzolo e soprattutto dell’Alloro diminuiva sotto O3, e non variava in Fillirea, nonostante che questa fosse la specie con la conduttanza stomatica più elevata e quindi con il massimo assorbimento potenziale di inquinante. Alcuni antiossidanti (l’attività della superossido dismutasi e il contenuto di glutatione ridotto, ma non quello di ascorbato ridotto) aumentavano sensibilmente nelle foglie ozonate di Corbezzolo e soprattutto di Fillirea, ma non in quelle di Alloro. L’Alloro era anche la specie con il più basso livello costitutivo di superossido dismutasi, il che suggerisce che la capacità di aumentare le difese antiossidanti sotto O3 e il livello di base degli antiossidanti contribuiscono alla tolleranza all’O3 delle specie mediterranee. Da notare che le risposte all’O3 diminuivano nell’ordine Alloro > Corbezzolo > Fillirea, corrispondente all’ordine di crescente xerofilia. I naturali adattamenti della vegetazione mediterranea al deficit idrico e all’eccesso di luce possono evitare o contro-bilanciare anche i danni da UV-B ([17]), confermando che le foreste mediterranee sono adattate a fronteggiare stress ossidativi, come le elevate concentrazioni di O3, la siccità e l’alta irradiazione. Questo non significa che siano immuni da danni.
L’elevato livello di base di O3 ([36]) e la presenza di sintomi fogliari visibili tipo-ozono nelle foreste italiane ([15], [24], [19]) confermano che l’inquinamento da O3 è un problema da non sottovalutare. Inoltre, anche in assenza di danni visibili, l’esposizione all’O3 è in grado di generare una cascata di risposte fisiologiche e metaboliche, i cui effetti complessivi sulla crescita forestale non sono ancora chiari ([13], [20]). Per esempio, nelle specie che si sono dimostrate più tolleranti all’O3 (come Fillirea, Corbezzolo e Alloro), l’esposizione a livelli di O3 corrispondenti a quelli ambientali stimola l’efficienza fotosintetica, valutata sulla base della fluorescenza della clorofilla a ([26]). Questa risposta può essere interpretata come una sovra-compensazione dovuta alla reazione per contrastare gli effetti negativi dell’O3. Ci si chiede, però, quanto a lungo la pianta potrà mantenere questo sforzo metabolico aggiuntivo senza danneggiare la crescita.
Come sopra riportato, l’O3 può indurre risposte stomatiche aberranti ([16], [6], [7], [41]) con conseguenze sul controllo delle perdite idriche. I cambiamenti climatici in corso stanno portando le comunità vegetali dell’area mediterranea a fronteggiare condizioni di siccità sempre più severa ([18]). Comprendere il comportamento stomatico è dunque un tassello fondamentale per interpretare le implicazioni sul bilancio idrogeologico a scala territoriale e definire le funzioni degli ecosistemi forestali in un clima e in una atmosfera in cambiamento ([12]).
L’esposizione all’O3 può alterare la risposta delle piante a stress abiotici (siccità) e biotici (funghi). La fumigazione con 110 ppb O3 (5 h al giorno per 30 giorni) predispone le foglie di Sughera (Quercus suber L.) e Cerro (Q. cerris L.) all’attacco di Diplodia corticola e Biscogniauxia mediterranea, rispettivamente ([33]). Anche se le cause di questa maggiore aggressività non sono state chiarite, l’O3 potrebbe dunque contribuire al deperimento delle Querce causato da questi deboli parassiti fungini negli ecosistemi mediterranei, sia direttamente che indirettamente, andando ad inficiare il controllo delle perdite idriche. La siccitàè infatti un importante fattore predisponente nella patogenesi di B. mediterranea su Q. cerris e di D. corticola su varie specie di Quercia.
Prospettive di ricerca
Per la comprensione dell’effetto dell’O3 sulle foreste mediterranee, e italiane in particolare, è indispensabile migliorare la conoscenza dei livelli di O3 in aree remote. La copertura spaziale e temporale dei dati di O3 di base in Italia non è ancora adeguata a rappresentare la complessità delle nostre condizioni climatiche e orografiche, in particolare al Sud ([19]). Parallelamente, occorre migliorare i modelli di valutazione del rischio da O3 muovendo da indici di esposizione tipo AOT40 a indici basati sul flusso effettivo di O3, inclusivo cioè sia dei meccanismi di evitanza che di quelli di detossificazione e riparazione del danno ([10]). Il processo per la definizione di standard normativi basati sul flusso di ozono è comunque lungo e impegnativo ([14]), per cui gli standard basati sull’esposizione rappresentano ancora un metodo pratico per riassumere la qualità dell’aria ([36]). Questo penalizza i paesi mediterranei, caratterizzati da livelli di O3 anche 3 volte superiori a quelli del Nord Europa ([10]). Inoltre, non è ancora chiaro quali dei numerosi indicatori di esposizione all’O3 suggeriti finora siano quelli biologicamente più significativi ([14]). L’AOT40 si è dimostrato inadeguato a riassumere gli effetti potenziali sulla vegetazione per ogni specie vegetale e in tutte le condizioni ambientali ([10]). Comunque, un confronto fra 34 dei più comuni indici di esposizione all’O3 ha mostrato che sono tutti altamente correlati tra loro ([36]). Una possibilità da vagliare sperimentalmente è l’utilizzo di un livello critico diversificato a seconda del tipo di vegetazione prevalente nell’area in esame, piuttosto che l’elaborazione di un unico indice sempre più complesso. Perciò, è ancora necessario che la ricerca si impegni a suggerire standard realistici per la protezione della vegetazione mediterranea, sia basati sul flusso che sull’esposizione.
Dato che le risposte all’O3 sono specie-specifiche, occorre migliorare la conoscenza della sensibilità all’O3 nelle nostre specie forestali più rappresentative. Per esempio, Contran & Paoletti ([2]) hanno dimostrato che l’Orniello (Fraxinus ornus L.) è più resistente all’O3 del Frassino maggiore (F. excelsior), grazie ad un migliore potenziale di detossificazione e riparazione dei danni. Sulla base di inventari di specie sintomatiche, risultati sperimentali e osservazioni in campo, la Tab. 2 riassume la sensibilità all’O3 delle principali specie forestali italiane. Il Leccio è una delle specie più tolleranti, sia in condizioni controllate ([9]) che in campo ([32], [40]). Tuttavia, rimane ancora molto lavoro da fare per definire le funzioni dose-risposta nella vegetazione mediterranea. Gli esperimenti devono essere condotti nelle condizioni più realistiche possibili e in sinergia con altri fattori, in particolare siccità e aumento della CO2 atmosferica.
In generale si pensa che l’elevata CO2 mitighi gli effetti negativi dell’O3 riducendo la conduttanza stomatica e quindi il flusso potenziale di O3 all’interno delle foglie. Non è ancora chiaro, comunque, se la riduzione della conduttanza indotta dall’aumentata CO2 atmosferica possa essere sostenuta a lungo, oppure vada incontro ad una down-regulation come accade alla fotosintesi ([12]). Lavorando in un sito naturalmente arricchito in CO2, e quindi su piante adattate da generazioni a vivere ad alta CO2, Paoletti et al. ([40]) hanno osservato che la conduttanza stomatica di foglie di Leccio era inferiore rispetto a quella di piante a CO2 ambiente, ma era insensibile all’ulteriore aumento della CO2 (dal livello ambientale di 1500 ppm a 2000 ppm), il che suggerisce un’acclimatazione stomatica. Tuttavia, è possibile che entrambe le risposte siano adattamenti al particolare ambiente di questi siti, caratterizzati da ampie e repentine oscillazioni della CO2 atmosferica ([31]). L’esposizione artificiale all’O3 di porzioni fogliari o rami interi causava un lieve decremento della fotosintesi e dell’efficienza nell’uso dell’acqua (-9%) rispetto ai controlli in aria deprivata di O3 ([5], [32], [40]). Poiché l’effetto era significativo solo nel sito arricchito in CO2, se ne deduce che l’adattamento a lungo termine all’elevata CO2 non compensa gli effetti negativi dell’O3 sulla fotosintesi del Leccio.
Come evidenziato all’ultimo convegno per Specialists in Air Pollution Effects on Forest Ecosystems ([34]), un’ulteriore emergenza della ricerca in merito agli effetti dell’O3 sulle foreste risiede nella comprensione e quantificazione dei meccanismi biochimici di detossificazione e di riparazione del danno, e la loro inclusione nei modelli di flusso. Come verificato in Frassini adulti in campo, gli individui con sintomi visibili da O3 presentano caratteristiche biochimiche che li differenziano da quelli asintomatici, quali minori livelli/attività di ascorbato e ascorbato-perossidasi, minore contenuto proteico, elevati livelli di H2 O2 ([41]). In questo caso, si presume che l’ascorbato, abbinato ad una minore conduttanza stomatica, conferisca protezione all’O3 contribuendo a limitare la produzione di H2 O2 e lo sviluppo di sintomi visibili. In altri casi, tuttavia, non si è osservata alcuna relazione tra livelli di ascorbato e di sensibilità all’O3 ([11]). Lo sviluppo delle conoscenze sulle risposte biochimiche all’O3 potrebbe contribuire a stabilire quali sono i migliori indicatori per definire la risposta all’O3 delle foreste.
Finora, gli indicatori più utilizzati per caratterizzare i danni da O3 sulle foreste in campo sono stati i sintomi visibili tipo-ozono e la crescita (in termini di incrementi diametrali/longitudinali o di trasparenza delle chiome). Tuttavia, i sintomi visibili hanno dimostrato un’elevata variabilità da individuo a individuo ([28]) e non è certo che la crescita sia il parametro più idoneo a riassumere gli effetti in campo. Infatti, la risposta all’O3 della crescita forestale è stata studiata finora in condizioni controllate (camere chiuse o a cielo aperto) e su piante giovani o giovanissime. L’etilendiurea (N-[2-(2-oxo-1-imidazolidini)etil]-N0-fenilurea), abbreviata come EDU, è stata usata con successo per prevenire i danni da O3 e studiare gli effetti dell’O3 sulla crescita di varie specie erbacee e poche specie legnose. In genere, l’EDU viene spruzzata sulle foglie, applicata al terreno in piante in vaso o iniettata nei fusti delle piante legnose tramite sistemi a bassa pressione. Recentemente, Paoletti et al. ([37]) hanno messo a punto un sistema di infiltrazione gravitazionale lavorando per la prima volta su alberi adulti (F. excelsior). L’infiltrazione ha avuto successo nel limitare i danni da O3 sulle foglie ([37]) e sulla crescita dei getti annuali ([35]), nonché nel chiarire i meccanismi di danno da O3 e di protezione da parte dell’EDU ([41]). Tuttavia, così come i sistemi a bassa pressione, questa tecnica necessita di praticare due fori nel tronco ogni tre settimane e non è quindi sostenibile in studi di lungo termine.
Lo sviluppo di tecniche innovative per lo studio degli effetti dell’O3 su alberi adulti in campo, come l’applicazione di EDU o le fumigazioni in open air, permetterebbe di ovviare a quello che è stato finora il maggior limite per gli studi forestali, cioè il fatto che le relazioni dose-risposta sono state desunte da esperimenti su semenzali in condizioni controllate. Ormai da anni la comunità scientifica chiede di passare a esperimenti su piante adulte in campo e a tal fine si è assistito al progressivo evolversi delle tecniche di ricerca: serre, camere climatiche o a cielo aperto, cuvette fogliari dinamiche, camere per rami o interi alberi, applicazioni di EDU, sistemi di fumigazione all’aperto, misure di flusso della linfa ([42], [23], [25], [34]).
Conclusioni
L’attuale obiettivo della ricerca sul tema ozono e foreste, soprattutto in area mediterranea, è quello di fornire una base biologica agli standard per l’O3. Per questo, è ancora necessario comprendere le alterazioni a livello metabolico e funzionale, implementare il data-base specie-specifico sul flusso di O3 e sulle risposte della crescita all’O3, e infine validare i modelli di flusso, correlando i flussi con gli effetti.
I problemi che inquinamento e cambiamento climatico pongono alle foreste sono tipicamente transnazionali e intrinsecamente di natura politica. I paesi europei stanno attualmente lavorando per adeguarsi alla Direttiva 2002/03/CE, i cui valori bersaglio per ridurre gli effetti dell’O3 sulla vegetazione si basano su un indicatore di esposizione, l’AOT40. La ricerca ha chiarito che l’esposizione all’O3 non è il miglior indicatore per riassumere il rischio potenziale per la vegetazione. Livelli critici basati sul flusso sono stati indicativamente suggeriti al Workshop di Gothenburg (2002) della Long Range Transboundary Air Pollution Convention. Al workshop successivo (Obergurgl 2005), purtroppo, non è stata portata alcuna nuova informazione scientifica di rilievo, il che riflette la povertà di attività sperimentali sull’O3 portate avanti in Europa negli ultimi anni. Infatti, l’argomento O3 e vegetazione non è stato incluso né nel VI Programma Quadro europeo (2002-2006), né nel primo bando del VII PQ (2007-2013). Paradossalmente, è stato attivato un processo di aggiornamento e revisione della 2002/03/CE, senza aver favorito le ricerche necessarie a fornirgli una base scientifica valida. Per questo, gli scienziati europei del settore si sono riuniti a Ispra nel febbraio 2006 ed hanno creato la rete “Ozone risk assessment: To further develop and validate the flux concept for the prediction of ozone impact on vegetation”, il cui steering group fra i vari suoi compiti si è fatto carico di informare i funzionari europei di questa incongruenza.
Solo una corretta informazione, sia all’interno che all’esterno della comunità scientifica, può permettere un ottimale indirizzo delle politiche di ricerca, nonché un migliore utilizzo dei dati e dei modelli disponibili, progetti cooperativi a lungo termine multidisciplinari e multinazionali, e l’armonizzazione delle politiche ambientali. Le società scientifiche, come SISEF, SITE, IUFRO, hanno un ruolo chiave nel favorire la divulgazione ed i contatti con il mondo politico. Tramite il Gruppo di Lavoro “Inquinamento e Foreste” (http:/www.sisef.it/sisef/gdl.php), la SISEF ha organizzato otto convegni nazionali su varie tematiche ed ha recentemente patrocinato la nascita di una rete informativa su ozono e vegetazione (RIO3-VEG), che vuole essere un forum di aggiornamento per scienziati e tecnici del settore.
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar