Experimental use of a native isolate of Phlebiopsis gigantea: efficacy and eco-sustainability.
Forest@ - Journal of Silviculture and Forest Ecology, Volume 6, Pages 148-153 (2009)
doi: https://doi.org/10.3832/efor0578-006
Published: May 19, 2009 - Copyright © 2009 SISEF
Technical Reports
Abstract
Heterobasidion annosum is an important pathogen, causing conifer root and butt rot. In Italy it attacks Pinus species both in mountain and in coastal plantations. Its diffusion is greatly enhanced during thinning, as its aerial inoculum germinates on new wounds or freshly cut butts. During thinning in the Castel Fusano Pinus pinea forest (Rome, Italy), in 2002-2005, a biological control trial was carried out for preventing new disease centres of a North American population of H. annosum, whose airborne spores were abundantly present. In particular, in February 2003 a suspension prepared with a native isolate of Phlebiopsis gigantea, previously studied in controlled environment, was applied on 23 butts. Observations on efficacy and persistence of the isolate in the treated stumps were carried out thirty months later. The pathogen was never detected in the stumps treated. Moreover, it was impossible to re-isolate from the upper part of the butts the P. gigantea individual isolate which had been profusely applied. These results confirm that the used isolate is an efficient biological control agent on P. pinea against the exotic isolates of H. annosum, and it is safe from an ecological point of view, as it does not trouble the natural succession of micro-organisms in butts.
Keywords
Heterobasidion annosum, Pinus pinea, Biological control, Castel Fusano, Italy
Introduzione
Heterobasidion annosum s. l. è un ben noto basidiomicete della famiglia delle Bondarzewiaceae. Attualmente, all’interno della specie originariamente descritta sono state riconosciute tre diverse specie (in precedenza indicate come gruppi intersterili), che mostrano specificità nella patogenesi verso generi di conifere diversi. In particolare, Heterobasidion annosum (Fr.) Bref. (H. annosum s.s.), che corrisponde al patogeno indicato in precedenza come gruppo P (dall’inglese pine - [8]), in Italia attacca sia le specie del genere Pinus che vegetano in ambiente alpino ed appenninico, sia quelle di ambiente costiero ([4]). Il ruolo decisivo delle attività selvicolturali, e in particolare del diradamento, nella diffusione di H. annosum è ben noto: le spore trasportate dal vento germinano rapidamente sulle ferite fresche e sulla superficie di alberi appena tagliati, permettendo al patogeno da una parte di colonizzare la ceppaia e successivamente di formare carpofori in grado di produrre nuovo inoculo aereo, dall’altra di infettare eventualmente le piante circostanti attraverso i contatti radicali ([11], [12]).
Phlebiopsis gigantea (Fr.) Jülich, invece, è una specie saprotrofa della famiglia delle Phanerochaetaceae, nota per la capacità di causare nelle ceppaie di conifere una veloce crescita superficiale ed intensa carie bianca, disgiunta da qualsiasi patogenicità, e di impedire così l’ingresso di H. annosum ([7]). Tale organismo è, quindi, utilizzabile per la lotta biologica al patogeno e in diversi paesi europei sono presenti formulati commerciali a base di frammenti di micelio ed oidi, cioè i propaguli naturali del fungo, predisposti in vario modo per un periodo più o meno prolungato di conservazione prima dell’uso ([10]).
La pineta di Castel Fusano, impiantata nel XVIII secolo a scapito della vegetazione originaria di macchia mediterranea, costituisce attualmente un’area di grande valore paesaggistico e naturalistico all’interno della Riserva Naturale Statale del Litorale Romano. In tale popolamento, Amorini et al. ([1]) verificarono che H. annosum causava morie a macchia d’olio, con schianti e sradicamenti, soprattutto a carico di soggetti di Pinus pinea L. di 120-160 anni. Nella stessa area, l’inoculo aereo di H. annosum era abbondante e costantemente presente, come fu verificato con un accurato e prolungato monitoraggio che evidenziò, in particolare, che si trattava esclusivamente di spore riferibili ad una popolazione alloctona del patogeno introdotta dal Nord America ([5]). Nel 2002-2005, poiché si doveva effettuare il diradamento della parte di pineta più “giovane” - circa 500 ettari con soggetti seminati 60-70 anni prima e mai sottoposti a diradamento - si pensò di proteggere le ceppaie nel corso dell’intervento selvicolturale: a titolo sperimentale e con l’autorizzazione della Commissione di Riserva, fu prevista la lotta biologica con l’uso di un isolato di P. gigantea autoctono, reperito cioè proprio all’interno della stessa pineta. Dopo alcune prove preparatorie, sia in ambiente controllato ([9]) che in bosco ([3]), il trattamento fu saggiato in una parcella in cui le osservazioni furono effettuate nei tre anni successivi.
La sperimentazione nella pineta di Castel Fusano (Roma)
L’area sperimentale era già stata definita dal C.R.A. - Centro di Ricerca per la Selvicoltura di Arezzo, per indagini ecologiche e strutturali in vista dei diradamenti da effettuare nella pineta ([2]). Il transetto sperimentale su una superficie di 1.400 m2 comprendeva 67 pini, con diametro compreso tra 17 e 50 cm.
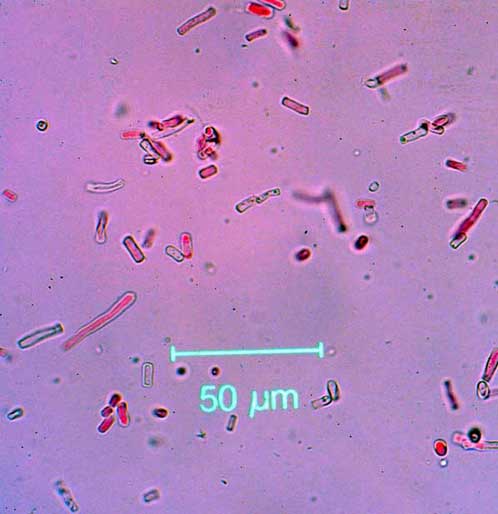
Nel febbraio 2003, nel corso del diradamento, su 23 ceppaie si applicò il trattamento di difesa biologica. Fu utilizzata una sospensione acquosa di oidi (circa 50.000 conidi/ml; Fig. 1) dell’isolato di P. gigantea scelto (ISPaVe PF 52), preparata il giorno stesso. Il trattamento fu effettuato entro un’ora dal taglio, spruzzando 0.1 ml/cm2 e applicando quindi 5.000 propaguli/cm2.
Fig. 1 - Propaguli di Phlebiopsis gigantea, agente di lotta biologica contro Heterobasidion annosum (colorazione con fucsina acida). La sospensione di propaguli del fungo da applicare per il trattamento delle ceppaie contiene in prevalenza oidi, ma anche frammenti di micelio (50000 propaguli/ml). Essi sono in grado di colonizzare rapidamente la superficie delle ceppaie trattate, contrastando così l’ingresso del patogeno.
Nel novembre 2003, a 9 mesi dal trattamento, fu effettuato un primo rilievo in bosco, con la semplice osservazione sulla presenza e caratteristiche di eventuali basidiomi di P. gigantea sulle 23 delle ceppaie trattate, segno di un’efficace affermazione del saprofita, o di H. annosum, in caso di mancata protezione delle ceppaie stesse.
In seguito, nel novembre 2005, 33 mesi dopo il trattamento, furono effettuate osservazioni sulle ceppaie rintracciabili nel transetto, per valutare in via definitiva l’efficacia del trattamento e verificare la sopravvivenza dell’organismo utilizzato per la lotta biologica. Dopo aver valutato visivamente le ceppaie, si effettuò un campionamento su ogni ceppaia, prelevando la metà della superficie esposta, per uno spessore di 3-4 cm, e lo strato seguente, per altri 3-4 cm di profondità. I campioni raccolti dallo strato più esterno furono incubati in camera umida, adagiandoli su carta bibula inumidita e chiudendoli singolarmente in un sacco di polietilene, senza ulteriori manipolazioni. Da ciascun campione delle sezioni più profonde, invece, furono prelevati a caso con una sgorbia sterile 20 trucioli di legno; i frammenti furono posti in piastre Petri con PDA, mentre il materiale residuo dopo tali prelievi fu incubato in camera umida. A più riprese, per 15 giorni, tutta la superficie del legno incubato fu esaminata allo stereomicroscopio, mentre i miceli fungini che colonizzavano la superficie dei campioni legnosi e quelli prodotti dagli isolamenti su PDA furono esaminati al microscopio ottico. Gli isolati di P. gigantea reperiti nelle diverse fasi dello studio furono caratterizzati con l’analisi RAMS (randomly amplified microsatellites - [6]).
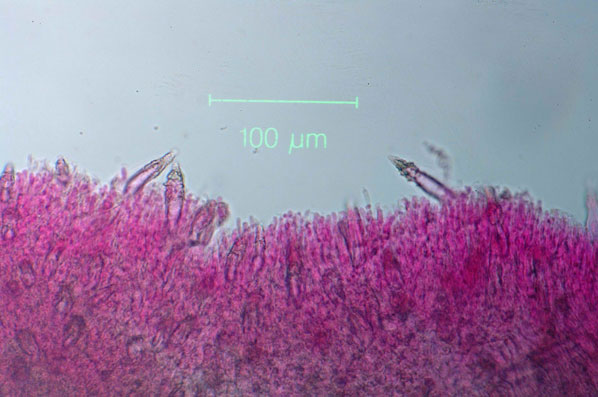
Sulla base dei controlli in bosco nel novembre 2003, le ceppaie trattate mostravano la presenza di una crosta soffice ed umida, di colore grigio, che, oltre a ricoprire almeno in parte la superficie di taglio, scendeva talvolta sino ai residui vegetali che circondavano la ceppaia, inglobandoli (Fig. 2). I carpofori di H. annosum non furono mai osservati. Piccoli campioni raccolti a caso mostravano che la crosta era costituita da basidiomi di P. gigantea (Fig. 3) da cui fu sempre possibile isolare il fungo. Il micelio così ottenuto, sottoposto ad analisi RAMS, risultò sempre essere l’isolato ISPaVe PF 52.
Fig. 2 - Ceppaia di Pinus pinea 9 mesi dopo il trattamento con Phlebiopsis gigantea. Il preparato biologico è stato spruzzato sulla ceppaia subito dopo il taglio (5000 propaguli/cm2) e durante l’inverno il fungo ha colonizzato la ceppaia ed i residui circostanti, producendo il basidioma, visibile sotto forma di crosta grigia e soffice che copre tutto il materiale legnoso.
Fig. 3 - Sezione di basidioma di Phlebiopsis gigantea (colorazione con fucsina acida). Sono visibili molto chiaramente i cistidi caratteristici della specie, inclusi nell’imenio o sporgenti sino a 40 µm al di sopra dei basidi, con la porzione distale incrostata da cristalli ialini.
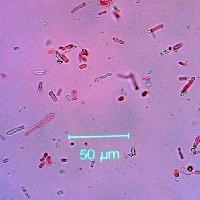
Le osservazioni in bosco effettuate nel novembre 2005 evidenziarono che, delle 23 ceppaie trattate 33 mesi prima, 20 presentavano un residuo dei basidiomi osservati due anni prima, sotto forma di una crosta superficiale, ben visibile anche se ormai secca e molto sottile (Fig. 4); in due casi la crosta non era più apprezzabile, mentre una ceppaia aveva subito una degradazione così intensa da risultare completamente distrutta e non più campionabile. Dalle analisi effettuate sui campioni di legno asportati in tale periodo dalla superficie delle ceppaie, risultò che i residui dei basidiomi non erano più vitali: infatti, i numerosi tentativi effettuati per reisolare da essi P. gigantea fallirono. Le ulteriori analisi condotte su tutti i campioni di legno prelevati a profondità variabili da 3 a 8 cm mostrarono che in nessun caso H. annosum aveva colonizzato le ceppaie, evidenziando così l’efficacia del trattamento, ed esclusero anche la persistenza di P. gigantea. L’unica eccezione a tale riguardo è stata evidenziata su una ceppaia colonizzata da insetti, probabilmente Coleotteri Buprestidi (Fig. 5): all’interno di una galleria con sezione ovoidale e di circa 1.5 cm di massima larghezza, nella sezione di ceppaia più profonda fu possibile rinvenire il micelio vitale di P. gigantea, che fu anch’esso identificato come appartenente all’isolato ISPaVe PF 52. Più in generale, fu notato che nei campioni raccolti a profondità di 3-8 cm dalle ceppaie trattate era evidente un’intensa alterazione del legno, che interessava gran parte dell’alburno.
Fig. 4 - Ceppaia di Pinus pinea 33 mesi dopo il trattamento con Phlebiopsis gigantea. I basidiomi maturati due anni prima sono ridotti ad una sottile crosta asciutta che, alle indagini in laboratorio, risulta ormai sterile.
Fig. 5 - Campione di legno prelevato da ceppaia 33 mesi dopo il trattamento con Phlebiopsis gigantea. Sulla sezione (diametro di 25 cm circa) sono visibili le aree più chiare, quasi grigie, profondamente alterate dall’agente di lotta biologica, e quelle più scure, corrispondenti al duramen, che in Pinus pinea risulta sempre scarsamente colonizzabile sia da parte di P. gigantea che di Heterobasidion annosum. In entrambi i tipi di tessuto sono visibili alcuni prelievi, effettuati a caso con sgorbia sterile, per isolare gli organismi fungini presenti, ed è evidente il foro prodotto da un insetto lignivoro, l’unico punto in cui è stata rilevata la presenza dell’isolato di P. gigantea ISPaVe PF 52, a suo tempo inoculato.
Discussione
La lotta biologica con P. gigantea è praticata di routine nei paesi scandinavi, dove è disponibile un formulato commerciale a base di un isolato reperito in Finlandia su abete rosso (Rotstop®): tale prodotto, però, non è registrato in Italia. In effetti, qualche perplessità può sorgere nell’applicare la lotta biologica utilizzando organismi non autoctoni, soprattutto quando questi vengono introdotti in ambienti sottoposti a vincoli, quali Parchi e Riserve Naturali. Inoltre, l’efficacia di un intervento di lotta biologica è fortemente influenzata dalla prontezza con cui l’organismo utile si afferma nel substrato da proteggere. Per ottimizzare tale aspetto può essere, quindi, fondamentale l’utilizzo di un organismo autoctono del sito in cui si effettua il trattamento, che, in linea di principio, dovrebbe essere il più adatto ed efficiente per le specifiche caratteristiche microclimatiche ed ecologiche. Il trattamento biologico con l’isolato ISPaVe PF 52, reperito ed applicato nella pineta di Castel Fusano nel corso della sperimentazione descritta, ha sempre impedito efficacemente la penetrazione di H. annosum.
Un’alternativa ampiamente sperimentata e di efficacia comparabile agli interventi di lotta biologica è l’uso di urea. La sostanziale differenza tra i due tipi di trattamento riguarda l’evoluzione del materiale legnoso che rimane in bosco: l’urea interferisce nella successione dei funghi degradatori del legno, ritardando l’azione di quelli più attivi e favorendone altri poco efficienti, come già evidenziato su altre specie di conifere [Picea abies (L.) Karsten, P. sitchensis (Bongard) Carrière, Pinus sylvestris L., P. elliottii Engelmann, P. resinosa Aiton] ([13]). Sulle ceppaie trattate con P. gigantea, invece, si evidenziano i vari livelli di degradazione, con colorazioni e consistenze del legno diverse, con il completo sviluppo della catena trofica, costituita da una serie di altri funghi e da insetti lignivori, che a loro volta sostengono in foresta la presenza di uccelli e mammiferi insettivori.
Lo studio svolto ha dimostrato che il rispetto dell’ambiente risulta salvaguardato anche perché, nonostante la massiccia dose con cui il fungo è stato inizialmente introdotto sulle ceppaie, secondo i dosaggi indicati in bibliografia ([7]), l’isolato utilizzato per la difesa da H. annosum non solo non ha precluso l’attività di altri isolati della stessa specie, ma dopo tre anni non è più risultato isolabile. Infatti, la presenza in bosco di altri isolati nativi era già stata verificata a suo tempo nella prova preliminare ([3]) ed è stata ripetutamente confermata nel corso di monitoraggi dell’inoculo aereo di H. annosum effettuato nella stessa pineta ([5]), in quanto dalle rotelle-trappola veniva catturato, anche dopo il trattamento biologico, inoculo di P. gigantea con caratteristiche genetiche diverse dall’isolato ISPaVe PF 52 (dati non pubblicati). In precedenti sperimentazioni la “non persistenza” di un isolato utilizzato per il controllo biologico era stata dimostrata su P. sylvestris ([15]), ma non su P. abies, dove era reperibile sino a sei anni dopo ([14]). Questa non persistenza è stata qui verificata anche su P. pinea, evidenziando un ulteriore argomento a favore dell’utilizzo di questo organismo per la lotta biologica a H. annosum in ambiente mediterraneo.
I risultati positivi ottenuti nella sperimentazione descritta hanno incoraggiato a proseguire la raccolta di isolati di P. gigantea, ponendo particolare attenzione ai parchi urbani e alle aree protette. Diversi isolati, saggiati con prove in ambiente controllato, sono conservati nella collezione CRA-PAV (ex ISPaVe), in vista di possibili utilizzi sperimentali nelle pinete di provenienza.
Ringraziamenti
Lo studio è stato svolto con il contributo economico del Comune di Roma (Assessorato alle Politiche Ambientali ed Agricole - Dipartimento X) e della Regione Lazio (Assessorato all’Ambiente e Cooperazione tra i Popoli). Si ringraziano per la collaborazione i colleghi del C.R.A. - Centro di Ricerca per la Selvicoltura di Arezzo e il personale del Comune di Roma.
References
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar