Light and soil humidity influencing oak seedling growth and physiology in mixed hardwood gaps
Forest@ - Journal of Silviculture and Forest Ecology, Volume 6, Pages 240-255 (2009)
doi: https://doi.org/10.3832/efor0589-006
Published: Jun 30, 2009 - Copyright © 2009 SISEF
Research Articles
Abstract
In “S. Rossore, Migliarino, Massaciuccoli” Natural Park (Pisa, I) six-month-old pedunculate oak seedlings (Quercus robur L.) were transplanted within natural gaps of a mixed oak forest. Micro-environmental variability for radiation and water soil content were measured for 145 seedlings during the year. Irradiation relative to the open field (IR) ranged from 5% to 57%. Seven classes of IR each with 20 seedlings were selected. Leaf mass per area was strongly influenced by IR. In the first 3 years survival was high (95, 76 and 75%, respectively) and seedling reached 14±6 cm, 27±13 cm and 39±19 (sd) cm of height. Even if IR and soil water content (SWC) were negatively associated, indicating a lower SWC at the centre of the gaps, height and its relative growth rate increased with IR (explored range: 8-40%) with a significant interaction with SWC in the 1st year, indicating the positive effect of soil moisture. In the 3rd year dimensional traits were higher in L+W+ (high light and humidity) followed by L-W+ (low light and high humidity), L+W- and finally by L-W-. Summer drought typical of the Mediterranean climate was evaluated by chlorophyll fluorescence of PSII on apical leaves of seedlings and mature trees at the beginning (21 June) and in mid-summer (20 July). While in June physiological traits did not differ between low and high IR, in mid-summer (at the peak of water-stress) seedlings of the two highest light classes showed chronic photoinhibition (Fv/Fm<0.75) and an increase in thermal dissipation (D) by constitutive term (Dc=1-Fv/Fm) and by regulated mechanisms of dissipation through xanthophyll-cycle term (Dx). Moreover, in July seedling leaf physiology largely differed with IR: leaves acclimated to high IR have higher photosynthetic potentialities, as shown by electron transport rate (ETR) and quantum yield (P) at saturating light maintained by an increase of the fraction of open reaction centres (qP), counterbalancing the efficiency decrease of the single reaction centres (Fv’/Fm’) dynamically protected via xanthophyll-cycle (Dx). Tree apical leaf physiology behaved differently from seedling leaves both in June (except Fv/Fm) and in July (except Dx). In June photochemistry was higher in tree apical leaves with higher ETR, P, qP and Fv’/Fm’ with a lower fraction of energy dissipated and in particular through lower loss by photoprotection through Dx as expected for high light conditions without stress; in July no chronic photoinhibition was observed in tree light leaves, the efficiency of single reaction centres (Fv’/Fm’) remained high but a drop in the fraction of open centre (qP) decreased significantly P and thus ETR. Consequently the highest potentialities in photochemistry (P) were observed in large gaps (at 40% IR).
Keywords
Forest gaps, Natural regeneration, Light environment, Soil humidity, Fluorescence, Oakwood, Quercus robur
Introduzione
L’esigenza di sviluppare sistemi selvicolturali che assicurino la continuità della copertura forestale del suolo con tutti i benefici connessi e che al contempo rivalutino le funzioni ambientali e sociali delle foreste (biodiversità, risorse idriche, assorbimento di CO2, attività ricreative) incentiva sempre più una gestione volta a favorire la naturalità e la diversità strutturale e biologica, ponendo particolare attenzione alla rinnovazione naturale in seguito alla dinamica di creazione di spazi aperti all’interno delle foreste. La quantificazione della disponibilità di luce sotto copertura e nelle radure permette quindi di seguire l’evoluzione delle cenosi e l’affermazione della rinnovazione. Non va comunque trascurata l’interazione tra luce e disponibilità idrica importante sia in climi mediterranei ([42], [43], [16]) che temperati ([19], [3]). Infatti, se da un lato l’ombreggiamento implica la concorrenza degli alberi circostanti per l’intercettazione di una frazione anche rilevante di luce, presenta comunque il vantaggio di ridurre il fabbisogno idrico dei semenzali e la concorrenza esercitata dalle erbe. Sebbene la farnia (Quercus robur L.) sia una specie di rilevante interesse naturalistico e produttivo, che attualmente occupa circa il 3% della superficie europea (EU30, [20]), la sua rinnovazione naturale risulta spesso problematica ([47], [39]) per la competizione esercitata dalle altre specie vegetali ([22], [45], [51], [9]), per la produzione discontinua del seme soggetto a forte predazione e per l’incidenza dei danni apportati dalla fauna selvatica ([38], [28]). Questo studio si propone di determinare la sopravvivenza e la crescita dei semenzali di farnia in radure createsi per mortalità naturale valutando per i primi tre anni: (i) la sensibilità dell’accrescimento della farnia alle condizioni micro-stazionali di disponibilità idrica e luminosa; (ii) l’influenza della disponibilità idrica e luminosa sulla morfologia fogliare e fisiologia dei processi fotosintetici.
Materiali e metodi
La ricerca è stata condotta nei querceti misti mesofili mediterranei di 120-150 anni appartenenti all’associazione Fraxinus angustifoliae - Quercetum roboris (Gellini, Pedrotti, Venanzoni) del Parco Regionale di San Rossore, Migliarino, Massaciuccoli (Pisa). I rilievi sono stati effettuati nelle particelle 362 e 368 della Tenuta di San Rossore cartografate da Selca ([37]) e situate all’interno della Riserva Naturale “Bosco di San Bartolomeo” (UTM WGS 32 Lat. N 4841506, Long. E 608218), una stretta fascia boscata di circa 95 ettari, larga 200 - 400 m e lunga poco più di 3 km, che occupa insieme alle Riserve “Bosco della Maddalena” e “Palazzetto” la parte più orientale del Parco caratterizzata da terreni di più antica emersione dal mare e pertanto pedologicamente più evoluti ([34]). Qui la farnia è prevalentemente consociata con il frassino meridionale e marginalmente con l’ontano nero, che caratterizza la variante igrofila tipica di aree sommerse per molti mesi dell’anno, o con il carpino bianco, con il quale forma un’associazione più mesofila indice di suoli freschi, profondi e poco soggetti alla sommersione invernale. L’intera riserva del “Bosco di San Bartolomeo” è stata completamente recintata nel 2005 per proteggere la flora erbacea e la rinnovazione forestale dalla predazione degli ungulati. Nell’ottobre del 2004, un anno di abbondante produzione e buona qualità del seme (facoltà germinativa 99%, peso di 1000 semi 7.91±0.12 kg, UR 35.5%) circa 200 ghiande furono seminate in contenitore subito dopo la raccolta ed allevate in serra durante l’inverno. Nell’aprile 2005 dopo il decespugliamento di 13 radure originatesi per mortalità naturale all’interno del Bosco di San Bartolomeo 145 semenzali (hmedia = 11 cm) furono trapiantati in buche distanziate tra loro circa 5 m, proteggendoli individualmente dalla predazione degli ungulati con una rete metallica sostenuta da paline di castagno, alta 1 m ed ampia 0.4 m2 in modo da non interferire con il naturale sviluppo della vegetazione del sottobosco e con le variabili ambientali. Le 13 radure sono state caratterizzate misurando la distanza dal centro della radura alla proiezione delle chiome (Ø) e l’altezza delle piante adiacenti la radura (H) lungo 16 direzioni azimutali (N, N-NE, NE, NE-E, E, ecc.). Ciò ha permesso di ricavare alcune caratteristiche salienti delle radure, come l’area (A, dalla sommatoria delle 16 aree dei triangoli date dal prodotto di due distanze adiacenti ed il seno dell’angolo compreso), l’eccentricità (ε, dal rapporto tra Dperp/Dmax, dove Dperp è la perpendicolare di massime dimensioni all’asse maggiore del poligono Dmax) ed il rapporto tra diametro medio della radura e l’altezza media delle piante adiacenti (Ø/H), che definisce la classe dimensionale della radura. Possono essere considerate piccole le radure con Ø/H<1, medie se Ø/H è compreso tra 1 e 2, e grandi se il rapporto supera 2. Al fine di caratterizzare il popolamento si è proceduto al cavallettamento totale di nove aree di saggio (di 20-40 m di raggio) posizionate secondo un campionamento stratificato nel bosco a densità colma e al centro di radure piccole e medie. Nel corso della stagione e per ogni semenzale sono state misurate l’umidità del suolo (SWC) nei primi 20 cm di profondità e la disponibilità di luce. L’umidità volumetrica del suolo è stata determinata con il sensore Hydro-Sense (Campbell Scientific Inc., USA) basato sulla tecnica TDR (riflettometria nel dominio del tempo) nel 2006 (28 febbraio, 29 aprile, 20 giugno, 19 luglio), 2007 (30 gennaio) e 2008 (14 febbraio). Per il querceto mesofilo ed i tipi forestali limitrofi del frassino-ontaneto e del querceto rado a felce aquilina, Pteridium aquilinum (L.) Kuhn, caratteristici rispettivamente delle aree di depressione interdunale e di duna, l’umidità del suolo è stata misurata a tre profondità (0÷20 cm; 21÷40 cm; 41÷60 cm) nel corso del 2006 (14 e 29 marzo, 29 aprile, 21 giugno e 19 luglio). La radiazione totale espressa in percentuale della radiazione esterna è stata calcolata dall’analisi di fotografie emisferiche scattate a 1 m da terra nel 2006 (29 marzo, 29 aprile, 21 giugno). Per le fotografie è stata utilizzata una macchina fotografica Nikon FM2 con obbiettivo emisferico Sigma e pellicola Tmax-400, esposta su una porzione di cielo libero allo zenit con un esposimetro spot Sekonik L-778 e digitalizzata a 2600 dpi ottici. Il programma Hemiview (Delta-T Devices, UK) ha permesso di calcolare la radiazione relativa data dalla frazione di radiazione sotto copertura rispetto ai valori esterni al bosco (global site factor, GSF) il grado di copertura del suolo, la frazione di vuoti nelle chiome e l’indice di area fogliare (LAI). Sulla base delle misure della radiazione relativa (GSF) sono state costituite 7 classi di disponibilità di luce (ognuna composta da 20 semenzali con radiazione di 8, 14, 17, 20, 26, 32 e 40%) al fine di valutare la mortalità, crescita ed caratteristiche morfologiche e fisiologiche dei semenzali in risposta alla disponibilità di luce.
Per ogni semenzale sono stati misurati altezza totale e diametro al colletto nel corso di tre anni: 2006 (28 febbraio), 2007 (30 gennaio) e 2008 (14 febbraio), calcolandone il tasso di crescita relativo (eqn 1):
Per ogni semenzale sono stati misurati altezza totale e diametro al colletto nel corso di tre anni: 2006 (28 febbraio), 2007 (30 gennaio) e 2008 (14 febbraio), calcolandone il tasso di crescita relativo, RGR = [ln(v 2 ) - ln(v 1 )] / (t 2 - t 1 ), dove ln è il logaritmo naturale, v 2 e v 1 si riferiscono alle misure dimensionali nell’anno in corso e nell’anno precedente e (t 2-t 1) al tempo in anni intercorso tra le misure ([17]). Per soddisfare le assunzioni dell’analisi della varianza (ANOVA) di normalità della distribuzione, omogeneità della varianza ed indipendenza tra medie e varianze l’altezza (h), il diametro al colletto (d) e il volume (v=h·d2) sono stati trasformati con il logaritmo. L’analisi della varianza ha permesso di saggiare l’effetto della luce, umidità del suolo e della loro interazione sui valori dimensionali dei semenzali e sugli incrementi. Le quattro classi di luce ed umidità edafica sono state definite dal valore mediano di radiazione e SWC invernale: 23% per la radiazione e 35% per SWC. La significatività statistica delle differenze tra le medie è stata valutata con il test di Duncan per confronti multipli post-hoc.
La misura della fluorescenza della clorofilla del fotosistema II (PS II) effettuata con il fluorimetro modulato PAM-2000 (Walz, Germania) ha permesso di studiare in modo rapido e non invasivo i meccanismi dei processi fotosintetici, nonché gli effetti delle condizioni ambientali sull’efficienza fotosintetica del fotosistema II. Nelle date 20 giugno ed il 19 luglio 2006 è stata campionata una foglia apicale per ognuno dei 145 semenzali e 15 foglie di luce da piante adulte. L’efficienza massima del fotosistema II (Fv/Fm) è stata misurata dopo aver posto le foglie per 16 ore al buio, a temperatura ambiente ed umidità saturante. Su ogni foglia - dopo aver attivato il sistema fotosintetico per 30’ a bassa luce (20 μmol fotoni m-2 s-1) ed aver nuovamente ri-adattato la foglia al buio per 20’ - è stata effettuata una curva rapida di risposta alla luce (rapid light curve, RLC) con 12 livelli progressivamente crescenti di irradiazione (0, 10, 30, 50, 75, 150, 300, 500, 800, 1250, 2200, 3660 μmol fotoni m-2s-1) mantenuto ognuno per 10 ([50]). I parametri fotosintetici sono stati calcolati secondo quanto proposto da Verhoeven et al. ([44]) e da Maxwell & Johnson ([26]): massima efficienza fotosintetica (Fv/Fm), efficienza quantica del fotosistema II (P), tasso di trasporto elettronico (ETR), frazione di centri di reazione aperti (qP), efficienza quantica per centro di reazione (Fv’/Fm’), frazione di energia assorbita dal fotosistema II dissipata sotto forma di calore (D) come dissipazione costitutiva (Dc=1-Fv/Fm) o tramite il ciclo delle xantofille (Dx=D-Dc). Gli effetti sui parametri fotosintetici dovuti alla luce (2 livelli, determinati dal valore soglia 23%) e alla disponibilità idrica massima invernale (2 livelli, determinati dalla soglia del 35%) nonché alla loro interazione sono stati analizzati con l’analisi fattoriale della varianza e confronti multipli post-hoc (test di Duncan). Al termine delle misure di fluorescenza è stato determinato il rapporto tra biomassa ed area fogliare, noto anche come leaf mass per area (LMA; g m-2), un indice dell’ambiente luminoso in cui la foglia si è sviluppata.
Risultati e discussione
Rilievi ecologici ed accrescimento
La farnia della Tenuta di San Rossore costituisce il lembo più settentrionale di foresta planiziaria costiera in area tirrenica originatosi dai rifugi glaciali dell’Italia meridionale ([12]) e presente nei boschi delle pianure costiere toscane da almeno 9600 anni, come documentato dalle analisi polliniche di Mariotti Lippi et al. ([24]). Attualmente all’interno della Tenuta la farnia partecipa alle associazioni vegetazionali più significative per estensione, assetto floristico e caratteri dendrometrici. Nel “Bosco di San Bartolomeo” è la specie arborea di maggiori dimensioni con diametri fino a 142 cm ed altezze fino a 43 m, rappresenta il 12% della popolazione arborea ed il 47% dell’area basimetrica totale. Il frassino meridionale è numericamente la specie più frequente e la seconda per dimensioni; seguono l’olmo e l’ontano nero (Tab. 1). Nelle aree a densità colma il querceto misto mesofilo presenta un’area basimetrica di 43 m2 ha-1, una densità di 239 piante ad ettaro, LAI di 3.3 m2 m-2 corrispondente ad una copertura del suolo pari a 86% ed un’irradianza relativa al suolo del 7%.
Tab. 1 - Caratteristiche dendrometriche del Bosco di San Bartolomeo. Media ± errore standard per altezza totale, altezza di inserzione della chioma (H, Hins), diametro a petto d’uomo (DBH) e diametro della proiezione della chioma (Dchioma). Ripartizione percentuale tra le specie del numero di piante (N), area basimetrica (G) e valore di importanza, IMP = 0.5·(N+G - [30]).
| Specie arborea | H m |
Hins m |
DBH cm |
Dchioma m |
N % |
G % |
IMP % |
|---|---|---|---|---|---|---|---|
| Quercus robur L. | 26.5±1.3 | 10.7±7.5 | 76.0±4.8 | 16.3±2.4 | 12.5 | 46.7 | 29.6 |
| Fraxinus angustifolia Vahl. | 19.3±0.6 | 6.4±2.8 | 32.5±1.1 | 2.4±0.2 | 56.3 | 42.2 | 49.3 |
| Alnus glutinosa Gaertner | 13.3±0.9 | 2.9±0.8 | 27.3±1.8 | 1.5±0.3 | 4.8 | 2.3 | 3.6 |
| Ulmus minor Miller | 11.2±0.6 | 2.4±1.8 | 18.5±1.4 | 0.7±0.1 | 24.8 | 7.3 | 16.1 |
| Altre specie | 8.1±0.4 | 1.5±0.3 | 16.7±3.7 | 0.5±0.3 | 1.6 | 1.5 | 1.6 |
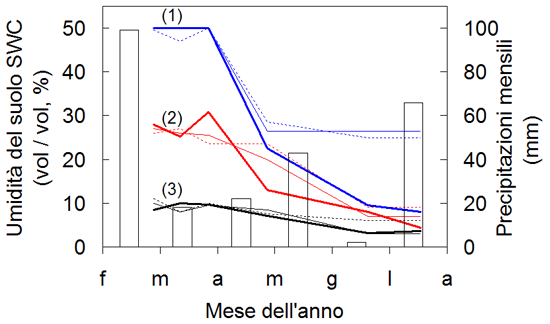
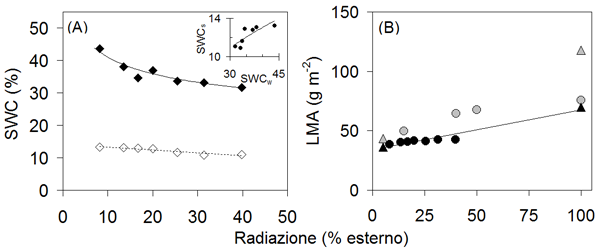
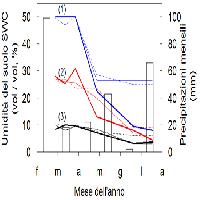
In Fig. 1 viene riportato l’andamento stagionale delle precipitazioni e dell’umidità del suolo delle tre consociazioni forestali tipiche del sistema duna-interduna del Bosco di San Bartolomeo. A partire dal mese di aprile l’umidità superficiale nei primi 20 cm di suolo mostra un rapido e forte calo che segue la nuova emissione delle foglie del piano arboreo. La farnia ed il frassino meridionale sono entrati in vegetazione negli ultimi giorni di marzo e dopo un mese, alla fine di aprile i valori di copertura del suolo nel bosco (84%) sono simili ai valori di giugno, l’umidità edafica superficiale risulta più che dimezzata nell’alno-frassineto e nel querco-frassineto, mentre nel querceto rado a felce aquilina è scesa del 30%. Nelle prime due tipologie la riduzione dell’umidità del suolo superficiale prosegue fino a raggiungere in estate valori simili a quelli del querceto rado, mentre la dinamica degli strati più profondi nel corso della stagione varia con la tessitura del suolo. Nonostante le rilevanti precipitazioni di luglio 2006 l’umidità del suolo non ha subito variazioni significative, rimanendo sotto alla soglia del 10% nelle tre “tipologie” indice del perdurare della carenza idrica nella parte superficiale del suolo (Fig. 1). Nei boschi di farnia di climi temperati centro-europei traspirazione ed evapotraspirazione costituiscono rispettivamente 80% ([21]) e 90% ([4]) dell’evapotraspirazione potenziale influenzando fortemente il bilancio idrico annuale ([21]). Tra le querce europee la farnia è la specie più sensibile allo stress idrico ([10]), presenta una bassa efficienza intrinseca di uso dell’acqua ([11], [32]) ed un’elevata vulnerabilità alla cavitazione xilematica ([41]). Lo stress idrico estivo (espresso come potenziale idrico del suolo) riduce in un primo momento la conduttanza stomatica, a cui segue con il perdurare delle condizioni di stress anche una forte riduzione delle potenzialità fotosintetiche come osservato per le farnie di una Kyoto forest della Pianura Padana durante l’estate 2003 particolarmente calda e siccitosa ([14]). In letteratura sono riportate numerose strategie di acclimatazione allo stress idrico nella farnia che coinvolgono sia l’architettura della chioma con l’abscissione dei rametti e rami meno produttivi (cladopsi - [18], [35]), che variazioni nella morfologia e fisiologia fogliare. In risposta alla carenza idrica i semenzali presentano una minore espansione e biomassa fogliare ([10], [13], [40]), un ridotto accrescimento di biomassa ed in altezza ([19]), oltre alla già menzionata chiusura stomatica ([40]). Essendo una specie eliofila un fattore determinante per l’accrescimento dei semenzali è la disponibilità di luce all’interno delle radure ([29]). Nel nostro studio le radure saggiate sono state classificate sulla base del rapporto Ø/H da piccole a medie. La direzione prevalente è E-NE con forma meno eccentrica nelle radure più grandi. Al centro delle radure medie la radiazione relativa è pari al 50% rispetto all’esterno, scendendo a 18% e 33% nelle radure piccole e medio-piccole (Tab. 2). Le condizioni medie per l’insieme campionario dei 145 semenzali sono 23% di radiazione relativa, 35% di umidità del suolo in inverno e 12% in estate. L’umidità edafica estiva (SWCs) è risultata molto bassa e positivamente correlata ai valori invernali (SWCw - Fig. 2a). Nelle radure l’umidità del suolo diminuisce significativamente con l’aumentare della disponibilità di luce: in inverno l’umidità del suolo varia da 44% nelle zone più chiuse ed ombreggiate a 33% delle zone più aperte e soleggiate; in estate il gradiente di umidità del suolo tra le due zone è fortemente ridotto variando da 13% a 11% (Fig. 2). La frazione di luce al suolo influenza lo sviluppo fogliare ed in particolare il rapporto tra biomassa e superficie fogliare (LMA) modificandolo secondo una funzione lineare (Fig. 2b). Dato l’elevato coefficiente di correlazione, LMA può essere utilizzato per monitorare le condizioni di luce in cui si accrescono i semenzali (GSF% = 2.79 · LMA (g m-2) - 93.13, R2 = 0.94, p<0.01, n=7), mentre la correlazione con l’umidità del suolo è da considerarsi un effetto secondario dovuto alla correlazione negativa esistente tra luce ed SWC nelle radure: infatti, mentre un aumento di LMA con la disponibilità di luce è stato più volte riportato in letteratura ([33], [43], [27]), non vengono riportate variazioni di LMA associate alle condizioni di umidità del suolo ([31]; [19]). Nelle radure esaminate la luce disponibile per i semenzali varia da 5% a 57%. Secondo von Lüpke ([46]) la rinnovazione di farnia riesce ad affermarsi in radure di almeno 500 m2 all’interno di querceti misti di 30 m di altezza. Nel Bosco di San Bartolomeo simile per altezza ciò richiede la morte di 2-3 farnie contigue di media dimensione con cui si apre uno spazio di circa 200 (150-275) m2 per pianta (Tab. 1).
Fig. 1 - Andamento stagionale dell’umidità idrica del suolo (SWC) nel corso del 2006 a tre diverse profondità per tre tipologie forestali del Bosco di San Bartolomeo: alno-frassineto (1, in blu), querco-frassineto (2, in rosso) e querceto rado con felci (3, in nero). Profondità: 0÷20 cm (linea spessa), 20÷40 cm (linea sottile), 40÷60 cm (linea tratteggiata). Istogramma delle precipitazioni medie mensili.
Tab. 2 - Caratteristiche delle radure campionate (media ± errore standard). (a): al centro della radura, fine giugno; (b) Ø: diametro della radura; H: altezza media del bosco adiacente alla radura.
| Classe radura | N | Area, A m2 |
Radiazione(a), % esterno | Rapporto Ø/H(b), m m-1 |
Direzione prevalente | Eccentricità, m m-1 |
|---|---|---|---|---|---|---|
| gap<300 m2 | 4 | 192±32 | 18±3 | 0.59±0.04 | E | 2.3±0.3 |
| 300<gap<600 m2 | 5 | 428±47 | 33±2 | 0.89±0.05 | E-NE | 2.8±1.1 |
| gap>600 m2 | 4 | 1052±146 | 50±4 | 1.42±0.16 | E-NE | 1.5±0.1 |
Fig. 2 - A) Radiazione relativa (GSF%) ed umidità del suolo (SWC%): in inverno (rombi neri: SWCw = 65.39 · GSF%-0.19; R2 = 0.90, p <0.01) ed in estate (rombi bianchi: SWCs = -0.10 · GSF% + 14.1, R2 = 0.87, p <0.01). In piccolo, relazione tra SWC in estate ed in inverno (cerchi neri: SWCs = 7.6 · ln(SWCw) - 14.9; R2 = 0.67, p <0.01). (B) Radiazione relativa (GSF%) e rapporto tra biomassa ed area fogliare (LMA = 0.33·GSF% + 34.71, R2 = 0.94, p<0.01; cerchi: semenzali; triangoli: farnie adulte; in nero: Bosco di San Bartolomeo, in grigio: [43], [27]).
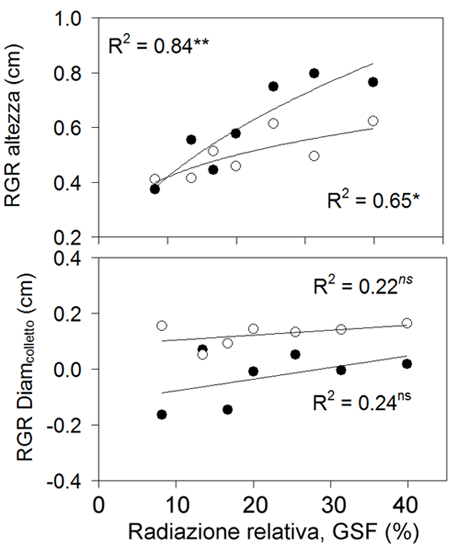
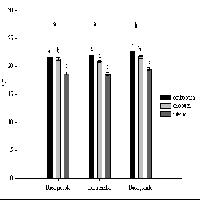
L’esclusione della predazione degli ungulati con protezioni individuali è risultata essenziale per assicurare la sopravvivenza dei semenzali, altrimenti scalzati dai cinghiali o brucati dai daini presenti all’interno della riserva nonostante la recinzione effettuata nel 2005. La sopravvivenza al primo anno è stata molto elevata (95%), nonostante che i semenzali abbiano dovuto affrontare una pronunciata siccità estiva protrattasi dalla fine di maggio a fine settembre 2005, con precipitazioni estive (49 mm) ed annue (677 mm - [1]) molto inferiori alla media climatica del trentennio 1961-1990 (124 mm e 900 mm, rispettivamente). La sopravvivenza a metà dell’estate e nell’inverno del secondo anno è stata di 85% e 76% rispettivamente. Il 2006, un anno con precipitazioni annue (902 mm) ed estive (167 mm) prossime alla norma, è stato caratterizzato da bassissime precipitazioni a giugno: i contenuti idrici nei primi 20 cm di suolo all’inizio estate sono risultati simili ai valori di metà estate (13% vs 11%) ed a fine luglio nel querco-frassineto la disidratazione del suolo si è estesa anche gli strati più profondi (Fig. 1). Nel 2007 la sopravvivenza è rimasta stazionaria (75%) nonostante precipitazioni annue inferiori (-27%) alla norma (664 mm - [2]) ed il lungo periodo di assenza di piogge dall’inizio dell’estate fino alla fine di luglio (LaMMA - http://www.lamma.rete.toscana.it/ita/climanew/report/). Nei tre anni la massima sopravvivenza è stata osservata in condizioni di bassa luce ed umidità (L-W-), la minima in alta luce ed umidità (L+W+); tra queste due condizioni le differenze sono risultate significative (p<1%) nel 1° e 3° anno. La sopravvivenza al 1° anno è risultata leggermente maggiore in condizioni di bassa umidità (W-: S% = 99% vs. W+: S% = 92%, p <0.046), mentre al terzo anno è stata nettamente favorita sia da condizioni di alta umidità che di bassa luce (W+: S% = 82% vs W-: S% = 64%, p<0.039; L-: S% = 86% vs L+: S% = 64%, p<0.007). La sopravvivenza in funzione delle condizioni luminose è stata ampiamente studiata: con livelli di irradianza pari a 1-2% i semenzali sopravvivono non più di due anni ([36]), con irradianze relative del 10% la sopravvivenza è di 4-6 anni, mentre occorre una radiazione relativa superiore al 15-20% per assicurare lo sviluppo giovanile ([46]), condizione, quest’ultima, in cui trovano il 52-77% dei semenzali analizzati. Le caratteristiche dimensionali medie dei semenzali nei primi tre anni indicano un aumento di altezza, volume e rapporto h:d (p<0.01 - Tab. 3). La crescita nei primi tre anni non è dissimile da quella osservata dai semenzali nati spontaneamente: i valori di altezza al primo anno sono simili a quelli ottenuti con ombreggiamento artificiale, mentre l’altezza al secondo anno è nettamente inferiore ([52]), indicando la presenza di una forte competizione da parte delle erbe ed in particolare del rovo ([15]). Nel secondo anno il 97% dei semenzali mantiene un fusto monocormico; tra questi il 70% è privo di ramificazioni laterali, mentre il 16%, 9%, 1% hanno rispettivamente una, due o più ramificazioni laterali ed il 4% più gemme apicali. Sebbene non siano state appurate differenze ambientali (di luce ed umidità edafica) e di crescita al primo anno tra semenzali monocormici e non, le piante rimaste monocormiche e senza ramificazioni alla fine del secondo anno (48%) hanno raddoppiato l’altezza rispetto al primo anno, mentre le piante con ramificazioni laterali hanno avuto un accrescimento longitudinale pari alla metà dell’altezza del primo anno. Nonostante che nella farnia il numero annuo di flussi di crescita aumenti con la disponibilità di risorse ([5]), la luce riveste un ruolo importante anche nel determinare l’architettura della chioma ([6]). Nell’estate del secondo anno il 27% dei semenzali presentava attacchi da oidio. I semenzali colpiti hanno avuto un minore sviluppo in altezza alla fine del 3° anno (hmedio= 33 cm vs 42 cm, p<0.03), crescono in zone più ombreggiate (GSFmedio pari a 19% vs 25%, p<0.02), ma non su terreno più umido (p<0.23). Nei primi tre anni l’ambiente luminoso influenza il tasso di crescita longitudinale ma non quello diametrale (Fig. 3). In questa specie eliofila la crescita in altezza risulta importante per superare la competizione delle infestanti, tra cui il rovo, che è particolarmente vigoroso nelle zone mesofile più luminose e la cui competizione si riflette in valori di LMA inferiori del 3, 5 e 11% per le tre classi di maggiore radiazione relativa (26%, 31% e 40%) rispetto a quanto atteso dalla relazione lineare tra luce e LMA. Il massimo tasso di incremento di altezza al 2° anno viene raggiunto in condizioni di ridotta-media irradianza, ovvero con livelli di luce del 18-25% ([31], [52]) e del 31% in questo studio (Fig. 3), simili ai valori riportati da Cutini & Mercurio ([7]) per la rovere. La strategia di massimizzare l’accrescimento epigeo rende la farnia molto sensibile allo stress idrico ([31]) in seguito al quale la crescita in generale, ma soprattutto quella delle radici, si riduce nettamente ([19]). Gli effetti della luce, umidità del suolo e della loro interazione sono stati valutati utilizzando l’analisi fattoriale della varianza con due livelli di luce e due livelli di umidità (Tab. 4). I due livelli, individuati dalla soglia del 23% per l’irradianza relativa e dalla soglia del 35% per l’umidità del suolo, sono prossimi ai valori di radiazione necessari per l’affermazione dei semenzali (15-20% - [46]) e di umidità edafica che inducono una forte riduzione della traspirazione (30%, [49], [14]).
Tab. 3 - Dimensione campionaria (N) e sopravvivenza dei semenzali (S, %). Media, errore standard (es), minimo e massimo nei primi tre anni: altezza (h), diametro al colletto (d), volume (vol), rapporto h:d e tasso di crescita relativo in altezza (RGRh), diametro (RGRd) e volume (RGRvol). (1): Test di Duncan per il confronto tra medie trasformate con logaritmo, lettere diverse per differenze significative all’1%.
| Anno | N (S,%) |
Statistica | h(1) cm |
d(1) mm |
vol(1) cm3 |
h:d(1) cm cm-1 |
RGR h ln(cm) a-1 |
RGR d ln(mm) a-1 |
RGR vol ln(cm3) a-1 |
|---|---|---|---|---|---|---|---|---|---|
| 1° 2005 |
138 (95%) |
media (es) min÷max |
14a (0.5) 5÷38 |
3a (0.1) 1÷6 |
2.0a (0.2) 0.1÷11 |
46a (1) 15÷117 |
2.6b (0.05) 1.6÷3.6 |
1.1c (0.03) 0÷1.8 |
0.3a (0.08) -2.7÷2.5 |
| 2° 2006 |
110 (76%) |
media (es) min÷max |
27b (1.2) 7÷68 |
3a (0.1) 1÷6 |
3.6b (0.3) 0.1÷20 |
82b (3) 35÷167 |
0.5a (0.05) -0.4÷1.8 |
-0.1a (0.03) -1.1÷0.8 |
0.4a (0.09) -2.3÷2.8 |
| 3° 2007 |
109 (73%) |
media (es) min÷max |
39c (2.0) 10÷140 |
4b (0.2) 1÷8 |
9.6c (1.2) 0.1÷69 |
96c (3) 40÷200 |
0.5a (0.03) -0.6÷1.7 |
0.3b (0.05) -0.9÷1.8 |
1.0b (0.14) -2.3÷5.1 |
Fig. 3 - Tasso di crescita relativa (RGR) per altezza e diametro al colletto in relazione all’ambiente luminoso nella stagione vegetativa al primo (bianco) e secondo anno (nero).
Tab. 4 - Livello di significatività (p) e varianza attesa (σ2, %) attribuibile alle fonti di variazione dell’analisi della varianza con due livelli di luce e di umidità del suolo (soglia: 23% per radiazione relativa e 35% per SWC invernale). Le caratteristiche dei semenzali sono state trasformate con logaritmo per soddisfare le assunzioni: altezza (h), diametro al colletto (d); volume (vol), rapporto h:d e accrescimento relativo in altezza (RGRh), diametro (RGRd) e volume (RGRvol); df: gradi di libertà (effetto, errore). (ns): non significativo; (*): p < 0.10.
| Anno | Fonte di variazione |
df | Livello di significatività (p); Varianza attesa (σ2, %) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ln(h) | ln(d) | ln(vol) | ln(h:d) | RGRh | RGRd | RGRvol | |||
| 1° | Luce | 1, 134 | 0.357ns; 0 | 0.794ns; 0 | 0.836ns; 0 | 0.207ns; 0 | 0.357ns; 0 | 0.794ns; 0 | 0.836ns; 0 |
| Umidità | 1, 134 | 0.102ns; 0 | 0.143ns; 3 | 0.081*; 4 | 0.680ns; 0 | 0.102ns; 0 | 0.143ns; 3 | 0.081*; 4 | |
| Interazione | 1, 134 | 0.083*; 6 | 0.845ns; 0 | 0.575ns; 0 | 0.048*; 8 | 0.083*; 6 | 0.845ns; 0 | 0.575ns; 0 | |
| 2° | Luce | 1, 104 | 0.151ns; 4 | 0.443ns; 1 | 0.263ns; 2 | 0.183ns; 3 | 0.007*; 9 | 0.683ns; 0 | 0.096*; 5 |
| Umidità | 1, 104 | 0.749ns; 0 | 0.532ns; 0 | 0.803ns; 0 | 0.261ns; 2 | 0.849ns; 0 | 0.051*;6 | 0.149ns; 3 | |
| Interazione | 1, 104 | 0.965ns; 0 | 0.668ns; 0 | 0.803ns; 0 | 0.608ns; 0 | 0.156ns; 3 | 0.524ns; 0 | 0.781ns; 0 | |
| 3° | Luce | 1, 103 | 0.580ns; 1 | 0.792ns; 0 | 0.692ns; 0 | 0.647ns; 0 | 0.358ns; 2 | 0.632ns; 0 | 0.499ns; 1 |
| Umidità | 1, 103 | 0.129ns; 5 | 0.295ns; 1 | 0.190ns; 3 | 0.383ns;0 | 0.074*; 8 | 0.264ns; 3 | 0.148ns; 5 | |
| Interazione | 1, 103 | 0.876ns; 0 | 0.434ns; 0 | 0.638ns; 0 | 0.243ns; 2 | 0.996ns; 0 | 0.694ns; 0 | 0.778ns; 0 | |
Alla fine del primo anno si osserva un’interazione significativa tra luce ed umidità nel determinare altezza (p<0.083) e rapporto h:d (p<0.048) dei semenzali: in condizioni di bassa luce ed alta umidità l’allungamento del fusto e h:d sono risultati maggiori (Tab. 5). L’umidità del suolo influenza positivamente lo sviluppo in volume (p<0.081 - Tab. 4). Nei due anni successivi l’interazione tra luce e umidità non è risultata significativa. Nel secondo anno in condizioni di bassa umiditàè stato osservato un maggiore accrescimento del diametro al colletto, un indice dello sviluppo radicale (p<0.051 - Tab. 4 e Tab. 5), mentre buone condizioni di illuminazione favoriscono lo sviluppo in altezza (p<0.007) e volume (p<0.096). Nel terzo anno l’umidità influenza positivamente la crescita in altezza dei semenzali (p<0.074); il massimo accrescimento longitudinale (e di volume) si osserva nelle condizioni più favorevoli di alta luce ed umidità, il minimo nelle condizioni di bassa luce ed umidità (Tab. 5). In condizioni di bassa luce e umidità del suolo i semenzali hanno dimensioni inferiori, suggerendo una possibile co-limitazione tra i due fattori, mentre, dopo il primo anno, i valori dimensionali sono risultati maggiori in alta luce ed elevata umidità (Tab. 5). È comunque importante sottolineare come, sebbene luce ed umidità possano spiegare in parte la crescita dei semenzali all’interno delle radure, la varianza attesa (σ2) attribuibile singolarmente ai due fattori e alla loro interazione è risultata sempre molto bassa ed inferiore al 10%.
Tab. 5 - Dimensione dei semenzali nelle 4 classi di luce ed umidità edafica. Media ed deviazione standard, test di Duncan: lettere diverse indicano gruppi statisticamente diversi con un livello di probabilità del 5% o 10%. Le variabili sono state trasformate con logaritmo per soddisfare le assunzioni. Fattori e livelli: L = radiazione relativa (L+ > 23%; L- < 23%); W = umidità volumica del suolo massima invernale (W+ > 35%; W- < 35%). Valore minimo ÷ massimo (mediano) per classe: L-W-: radiazione 9÷22 (16%), SWC 19÷35 (30%); L-W+: radiazione 5÷22 (14%), SWC 36÷63 (41%); L+W-: radiazione 23÷57 (34%), SWC 23÷35 (32%); L+W+: radiazione 23÷54 (31%), SWC 36÷53 (39%).
| Variabile | Anno | 1° | 2° | 3° | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Classe | media | sd | 5% | 10% | media | sd | 5% | 10% | media | sd | 5% | 10% | |
| Altezza, h [cm] | L- W- | 13.1 | 5.9 | a | a | 24.4 | 11.4 | a | a | 34.6 | 12.0 | a | a |
| L- W+ | 16.5 | 7.1 | b | b | 24.7 | 11.7 | a | a | 40.1 | 15.4 | a | a | |
| L+ W- | 13.7 | 5.4 | ab | a | 28.5 | 14.4 | a | a | 37.4 | 18.2 | a | a | |
| L+ W+ | 13.5 | 5.0 | a | a | 30.3 | 15.4 | a | a | 49.9 | 37.2 | a | a | |
| Diametro, d [mm] | L- W- | 3.12 | 0.9 | a | a | 3.11 | 1.0 | a | a | 3.74 | 1.3 | a | a |
| L- W+ | 3.41 | 1.1 | a | a | 3.12 | 1.0 | a | a | 4.39 | 1.6 | a | a | |
| L+ W- | 3.23 | 1.1 | a | a | 3.43 | 1.1 | a | a | 4.14 | 1.6 | a | a | |
| L+ W+ | 3.53 | 1.1 | a | a | 3.14 | 1.0 | a | a | 4.45 | 2.2 | a | a | |
| Volume, v [cm3] | L- W- | 1.47 | 1.1 | a | a | 2.98 | 2.5 | a | a | 5.96 | 4.9 | a | a |
| L- W+ | 2.43 | 2.6 | a | a | 3.16 | 3.0 | a | a | 9.97 | 9.8 | a | a | |
| L+ W- | 1.79 | 1.7 | a | a | 4.48 | 4.6 | a | a | 8.98 | 9.0 | a | a | |
| L+ W+ | 1.99 | 1.5 | a | a | 4.13 | 4.2 | a | a | 17.61 | 24.6 | a | a | |
| h:d [cm cm-1] | L- W- | 43.2 | 17.2 | ab | ab | 78.9 | 31.9 | a | a | 98.0 | 33.2 | a | a |
| L- W+ | 49.9 | 17.9 | b | b | 80.5 | 28.0 | a | a | 94.4 | 30.4 | a | a | |
| L+ W- | 45.1 | 18.0 | ab | ab | 81.7 | 26.2 | a | a | 90.6 | 27.3 | a | a | |
| L+ W+ | 40.0 | 12.6 | a | a | 92.0 | 29.4 | a | a | 109.0 | 42.8 | a | a | |
| RGRh [ln(cm) anno-1] | L- W- | 2.49 | 0.4 | a | a | 0.51 | 0.4 | ab | ab | 0.33 | 0.5 | a | a |
| L- W+ | 2.73 | 0.4 | b | b | 0.35 | 0.5 | a | a | 0.54 | 0.4 | a | ab | |
| L+ W- | 2.55 | 0.4 | ab | a | 0.63 | 0.5 | b | b | 0.44 | 0.4 | a | ab | |
| L+ W+ | 2.54 | 0.4 | ab | a | 0.75 | 0.5 | b | c | 0.64 | 0.6 | a | b | |
| RGRd [ln(mm) anno-1] | L- W- | -1.20 | 0.3 | a | a | -0.03 | 0.3 | a | ab | 0.14 | 0.4 | a | a |
| L- W+ | -1.12 | 0.3 | a | a | -0.12 | 0.3 | a | ab | 0.31 | 0.5 | a | a | |
| L+ W- | -1.20 | 0.4 | a | a | 0.04 | 0.4 | a | b | 0.24 | 0.4 | a | a | |
| L+ W+ | -1.10 | 0.3 | a | a | -0.13 | 0.3 | a | a | 0.32 | 0.4 | a | a | |
| RGRv [ln(cm3) anno-1] | L- W- | 0.08 | 0.8 | a | a | 0.45 | 0.9 | ab | ab | 0.61 | 1.1 | a | a |
| L- W+ | 0.48 | 0.9 | a | a | 0.12 | 0.9 | a | a | 1.16 | 1.3 | a | a | |
| L+ W- | 0.14 | 1.1 | a | a | 0.71 | 1.0 | b | b | 0.92 | 1.1 | a | a | |
| L+ W+ | 0.34 | 0.9 | a | a | 0.49 | 0.9 | ab | ab | 1.29 | 1.3 | a | a | |
Alla fine del terzo anno in condizioni in cui alternativamente luce od umidità siano limitanti i semenzali si sviluppano meglio in ambiente con buona disponibilità idrica. L’importanza dell’umidità per lo sviluppo nei primi tre anni è confermato dalla ripartizione della varianza attesa tra le fonti di variazione al terzo anno (Tab. 4). Inoltre, l’assenza di differenze statisticamente significative tra i due livelli di luce a bassa umidità e tra i due livelli di umidità ad alta luce suggerisce che la crescita in bassa umidità sia limitata indipendentemente dalle condizioni di luce, così come la crescita in alta luce sia favorita indipendentemente dalle condizioni edafiche riscontrate all’interno delle radure. La crescita in bassa luce è nettamente agevolata in condizioni di buona umidità del terreno: in suoli umidi (W+) alla fine del 1° anno altezza (p<0.014), h:d (p<0.070) e volume (p<0.060) sono maggiori e dopo tre anni i semenzali hanno un maggiore diametro al colletto (p<0.098) e volume (p<0.093). In condizioni di alta umidità (W+) i semenzali di un anno hanno una maggiore altezza (p <0.014) e h:d (p <0.007) in bassa luce. Questo effetto è risultato transitorio, dato che al secondo anno l’accrescimento longitudinale è risultato maggiore in alta luce (p<0.009), mentre al terzo anno non si sono osservate differenze significative tra alta e bassa luce in condizioni di buona disponibilità idrica del suolo (W+, Tab. 5). Nel complesso questi risultati evidenziano la presenza di un legame tra crescita dei semenzali e microambienti. Non si può però prescindere dalla rappresentatività campionaria degli ambienti all’interno delle radure e dai diversi tassi di sopravvivenza, fortemente influenzati dalle condizioni luminose, con valori dopo tre anni molto inferiori in alta luce (S(L+W+) = 55% S(L+W-) = 58%) rispetto a bassa luce (S(L-W+) = 76%, S(L-W+) = 73%). Le condizioni con abbondanza di luce e acqua (L+W+) in cui si è osservata la maggiore crescita sono poco rappresentate all’interno delle radure naturali (15%) ed associate ad un’elevata mortalità per competizione con la vegetazione erbacea. In ordine di importanza per la crescita seguono le condizioni (L-W+) molto frequenti (+34%) e con un’alta sopravvivenza dei semenzali, le condizioni (L+W-) anch’esse comuni (30%), ma caratterizzate da una bassa sopravvivenza e le condizioni (L-W-) poco frequenti (20%) ed associate ad un’elevata sopravvivenza. Mentre in pieno campo la farnia si avvantaggia di pratiche che aumentano la disponibilità di luce e di acqua, come il controllo delle infestanti ([23]), in bosco la progressiva apertura della copertura risulta essenziale per l’affermazione della rinnovazione ([46], [52]). All’aumentare dell’ombreggiamento la biomassa totale diminuisce in modo esponenziale ([43]), mentre, in assenza di stress idrico, la ripartizione delle risorse tra foglie: fusto: radici è risultata indipendente dal grado di ombreggiamento con una leggera prevalenza della biomassa epigea (30% al fusto ed 24% nelle foglie) rispetto alle radici (45% della biomassa totale, [48]). La biomassa dei semenzali di farnia diminuisce anche in risposta ad una ridotta disponibilità di acqua ([19], [31]). Tuttavia, in nessuno degli studi citati viene valutato l’effetto dell’interazione tra luce ed umidità edafica. Nella rovere, una specie appartenente sempre alla sezione Robur, l’interazione tra luce ed umidità del suolo influenza molte caratteristiche dimensionali dei semenzali, come gli incrementi in altezza e biomassa ([7]), l’ area fogliare e la biomassa (totale e delle singole parti, [8]).
Rilievi fisiologici
La fluorescenza della clorofilla è stata utilizzata per valutare la risposta della farnia allo stress idrico estivo in relazione alle diverse condizioni ambientali di luce ed umidità del suolo. Con il fluorimetro PAM-2000 sono state effettuate curve di risposta alla luce campionando foglie apicali di semenzali (n=137) e piante adulte (n=15) all’inizio ed in piena estate 2006. La discussione prenderà in considerazione le differenze fisiologiche osservate in condizione di luce saturante (PAR = 3660 μmol m-2 s-1, il punto finale della curva di risposta alla luce) tra foglie cresciute in ambienti con diversa disponibilità di luce, ovvero foglie apicali di (i) piante adulte (irradianza relativa media 80%), semenzali cresciuti in condizioni di (ii) buona illuminazione (33%, variabile dal 23 al 57% e corrispondente alle ultime tre delle sette classi di irradianza relativa) o di (iii) ridotta illuminazione (15%, variabile dal 5 al 23% e corrispondente alle prime 4 classi di irradianza relativa) in giugno e luglio.
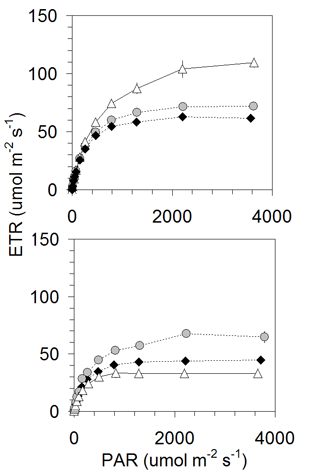
A giugno sono stati osservati i massimi valori di efficienza fotosintetica: le foglie sono nel loro pieno sviluppo fenologico, la temperatura e l’approvvigionamento idrico sono ottimali ed in condizioni di luce saturante le foglie di luce delle piante adulte hanno, rispetto alle due classi di semenzali, un maggiore trasporto elettronico (ETR = +85%) ed efficienza fotosintetica (P = +141%), dovuta a un maggior numero di centri di reazione aperti (qP = +131% - Fig. 4, Fig. 5). A fine luglio, in presenza di deficit idrico estivo, le foglie di luce delle piante adulte riducono fortemente il trasporto elettronico, l’efficienza fotosintetica ed il numero di centri di reazione aperti (-75%, -81%, -80%, rispettivamente rispetto a giugno); inoltre aumenta la frazione di luce assorbita dal sistema antenna del fotosistema II dissipata sotto forma di calore (D) passando dal 30% (giugno) al 44% (luglio), prevalentemente attraverso il ciclo delle xantofille. I semenzali cresciuti in buone condizioni di illuminazione a luglio presentano parametri di fluorescenza simili a quelli di giugno, tranne che D ammonta al 58% dell’energia assorbita dai sistemi antenna, valore notevolmente superiore a quanto osservato a giugno (D = 42%). Nonostante l’aumento della dissipazione a luglio, le xantofille contribuiscono in entrambi i mesi per il 45-50% (luglio-giugno) del valore totale della dissipazione. I semenzali cresciuti in condizioni di bassa illuminazione presentano a luglio una riduzione significativa in molti parametri fotosintetici (come il trasporto elettronico e l’efficienza fotosintetica: -27% - Fig. 4 e Fig. 5), aumenta leggermente la dissipazione D, passando dal 45% al 53% dell’energia assorbita dal PS II, ma tale aumento non è legato al ciclo delle xantofille, ma piuttosto a variazioni costitutive che inducono anche la diminuzione della massima efficienza fotosintetica.
Fig. 4 - Curve rapide di risposta alla luce in giugno (in alto) e luglio (in basso) per foglie di luce di piante mature (GSFmedio = 80%, bianco) e per foglie apicali di semenzali cresciuti in condizioni di buona (GSFmedio = 33%, grigio) o bassa (GSFmedio = 15%, nero) irradiazione.
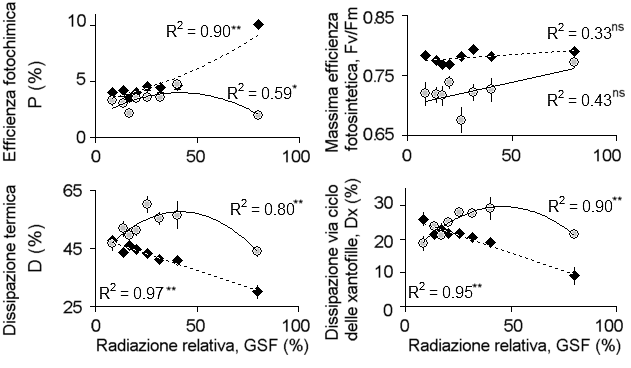
Fig. 5 - Ambiente luminoso e parametri di fluorescenza all’inizio (nero, 20 giugno) e metà estate (grigio, 19 luglio) per foglie apicali di semenzali (GSF da 8 a 40%) e piante adulte (GSFmedio = 80%). L’efficienza fotochimica (P) e la dissipazione termica (D e Dx) sono relativi a PAR = 3660 μmol m-2s-1. Efficienza fotosintetica massima con fotoinibizione cronica per Fv/Fm < 0.75. s
L’analisi fattoriale della varianza condotta con gli stessi due livelli di radiazione ed umidità edafica utilizzati per l’analisi dei caratteri dimensionali dei semenzali non ha mostrato per i due mesi estivi un effetto significativo dell’interazione tra i due fattori sui parametri fisiologici; l’umidità del suolo influenza i valori di trasporto elettronico (ETR) e l’efficienza quantica in luce saturante (P) a giugno, mentre non presenta effetti significativi a luglio, suggerendo l’importanza di una buona umidità del suolo in questo mese. I livelli di radiazione influenzano tutti i parametri fotosintetici nei due mesi ad eccezione del numero di centri di reazione aperti (qP) a giugno e l’efficienza fotosintetica massima (Fv/Fm) a luglio (Tab. 6). Rispetto all’inizio dell’estate a luglio diminuiscono i valori di efficienza fotosintetica (Fv/Fm, P e Fv’/Fm’) ed il trasporto elettronico (ETR) per tutte le classi di luce ed umidità edafica (Tab. 6). Confrontando tra loro le risposte a PAR saturante delle due classi di semenzali cresciuti ad alta (GSF>23%) e bassa (GSF<23%) luce, a giugno non sono state rilevate differenze fisiologiche se non una minore efficienza fotosintetica in condizioni di maggiore ombreggiamento (P: -12%, p<0.05) associata ad una maggiore dissipazione dell’energia luminosa assorbita (D: +8%, p<0.01), mentre a luglio gran parte dei parametri fotosintetici sono risultati statisticamente minori in condizioni di bassa radiazione eccetto che per Fv’/Fm’ (ETR e P: -26%, p<0.01; qP: -56%, p<0.01; Fv′/Fm′: +20%, p<0.001; NPQ: -14%, p<0.04; D: -14%, p<0.001; Dx: -15%, p<0.05). Ciò è in accordo sia con le osservazioni legate alla crescita, sia con dati di letteratura in cui l’irradianza relativa del 25% è considerata un valore soglia per il passaggio tra foglie di luce e di ombra nella farnia ed a cui corrisponde il picco di produttività per unità di area fogliare e di crescita relativa di biomassa ([52]). Le curve di luce sono state eseguite su foglie completamente re-idratate dopo una notte di buio, trattamento che consente al fotosistema II (PS II), se non permanentemente danneggiato, di riparare i danni subiti durante l’esposizione alla luce diurna. All’inizio dell’estate il fotosistema II delle foglie apicali non presenta danni fotochimici e l’efficienza massima fotosintetica è simile per le piante adulte e semenzali (o tra valori di irradianza relativa) e pari a 0.79. In piena estate le piante adulte mantengono un’elevata efficienza fotosintetica massima (Fv/Fm = 0.77), mentre per i semenzali Fv/Fm è inferiore al valore soglia di 0.75 - indice della presenza di danni fotochimici - e pari a 0.68 e 0.71 per i semenzali cresciuti in buona e ridotta illuminazione, rispettivamente (Fig. 5). A luglio, quindi in seguito allo stress idrico, i semenzali sono soggetti a danni fotochimici cronici, in cui parte del fotosistema II risulta inattivato, con riduzione di entrambe le componenti (Fo e Fm) dell’efficienza fotosintetica massima (Fv/Fm). La maggiore diminuzione di Fm (-27%) rispetto a Fo (-7%) è indice della disattivazione di parte dei centri di reazione all’interno del PS II, che sebbene inattivi per la fotosintesi fungono da centri di dissipazione dell’energia in eccesso, come evidenziato dagli esperimenti di Matsubara & Chow ([25]). In Fig. 5 si riportano i parametri caratterizzanti l’efficienza quantica del fotosistema II (P = efficienza a luce saturante e Fv/Fm = efficienza massima) e la frazione di energia dissipata (per via non fotochimica, D, e tramite il ciclo delle xantofille, Dx) nelle foglie apicali di piante adulte e semenzali cresciuti con diversa disponibilità di luce. A giugno in condizioni di luce saturante (con PAR > 1200 μmol m-2 s-1) il trasporto elettronico e l’efficienza quantica del fotosistema II crescono all’aumentare della disponibilità di luce (R2 = 0.90, p<0.01), mentre diminuisce sia la dissipazione non fotochimica (D, R2 = 0.97, p<0.01) che la dissipazione regolata dal ciclo delle xantofille (R2 = 0.95, p<0.01). All’inizio dell’estate non si osserva la presenza di fotoinibizione cronica (tutti i valori di Fv/Fm sono superiori a 0.75); le foglie risultano essere quindi pienamente funzionali e transienti di luce saturante di elevata intensità, come si possono verificare durante i sun-spot, sono utilizzati efficacemente dai semenzali senza mostrare fenomeni di fotoinibizione. Alla fine di luglio i semenzali di farnia presentano danni cronici da fotoinibizione in tutte le condizioni luminose presenti all’interno delle radure, ma questi sono più accentuati nelle condizioni di maggiore ombreggiamento, indicando che l’energia luminosa in eccesso dissipata dinamicamente dal ciclo delle xantofille (Dx) non è sufficiente a proteggere il fotosistema. Comunque, nelle radure l’efficienza quantica del fotosistema II (P) aumenta con l’aumento della disponibilità di luce e la minore efficienza osservata a luglio rispetto a giugno è associata a meccanismi costitutivi di fotoprotezione.
Tab. 6 - Parametri fotosintetici in giugno e luglio. Analisi della varianza (ANOVA 2x2): fonte di variazione, livello di significatività p, varianza attesa σ2 (%) attribuibile a luce (L), disponibilità idrica (W) ed interazione (L x W). Valori medi (md), deviazione standard (sd) e test di Duncan; lettere diverse indicano gruppi statisticamente diversi con un livello di probabilità del 5% o 10%. Livello di significatività (p) del confronto tra date (luglio-giugno) entro classe. (a): %; (b): μmol m-2s-1; (c): dopo acclimatazione al buio per 12 h; (d): curva di luce, PAR= 3660 μmol m-2s-1.
| ANOVA 2-vie (luce x SWC; 2 x 2) |
Medie, deviazione standard e test di Duncan | Confronto tra date |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Variabile / Fonte | Giugno | Luglio | Classe | Giugno | Luglio | |||||||||
| p | s2 | p | s2 | md | sd | 5% | 10% | md | sd | 5% | 10% | p | ||
| Efficienza fotosintetica massima, Fv/Fm (%)ac | ||||||||||||||
| Luce (L) | 0.07* | 4 | 0.26ns | 2 | L-W- | 75 | 11 | a | a | 70 | 13 | a | a | 0.14 |
| SWC (W) | 0.27ns | 0 | 0.42ns | 1 | L-W+ | 78 | 3 | a | ab | 73 | 6 | a | a | 0.00 |
| L x W | 0.29ns | 0 | 0.66ns | 0 | L+W- | 78 | 2 | a | b | 68 | 13 | a | a | 0.00 |
| - | - | - | - | - | L+W+ | 79 | 2 | a | b | 69 | 7 | a | a | 0.00 |
| - | - | - | - | - | Generale | 77 | 6 | - | - | 70 | 10 | - | - | 0.00 |
| Tasso di trasporto elettronico ETR (mmol fotoni m-2 s-1)bd | ||||||||||||||
| Luce (L) | 0.01* | 11 | 0.01* | 14 | L-W- | 56 | 26 | a | a | 44 | 27 | a | a | 0.13 |
| SWC (W) | 0.02* | 9 | 0.69ns | 0 | L-W+ | 64 | 19 | a | a | 47 | 22 | ab | a | 0.00 |
| L x W | 0.58ns | 0 | 0.85ns | 0 | L+W- | 65 | 18 | a | a | 62 | 34 | b | b | 0.60 |
| - | - | - | - | - | L+W+ | 79 | 19 | b | b | 63 | 19 | b | b | 0.07 |
| - | - | - | - | - | Generale | 64 | 21 | - | - | 53 | 28 | - | - | 0.00 |
| Efficienza quantica del fotosistema II, P (%)ad | ||||||||||||||
| Luce (L) | 0.01* | 12 | 0.01* | 13 | L-W- | 4 | 2 | a | a | 3 | 2 | a | a | 0.11 |
| SWC (W) | 0.02* | 8 | 0.84ns | 0 | L-W+ | 4 | 1 | a | a | 3 | 1 | a | ab | 0.00 |
| L x W | 0.54ns | 0 | 0.73ns | 0 | L+W- | 4 | 1 | a | a | 4 | 2 | a | b | 0.67 |
| - | - | - | - | - | L+W+ | 5 | 1 | b | b | 4 | 1 | a | b | 0.03 |
| - | - | - | - | - | Generale | 4 | 1 | - | - | 3 | 2 | - | - | 0.00 |
| Efficienza di dissipazione energetica D (%)ad | ||||||||||||||
| Luce (L) | 0.01ns | 12 | 0.00* | 17 | L-W- | 46 | 7 | b | b | 51 | 10 | ab | a | 0.05 |
| SWC (W) | 0.61ns | 0 | 0.59ns | 0 | L-W+ | 45 | 5 | ab | ab | 49 | 9 | a | a | 0.02 |
| L x W | 0.64ns | 0 | 0.68ns | 0 | L+W- | 42 | 6 | a | a | 58 | 14 | b | b | 0.00 |
| - | - | - | - | - | L+W+ | 42 | 6 | a | a | 58 | 12 | b | b | 0.00 |
| - | - | - | - | - | Generale | 44 | 6 | - | - | 54 | 12 | - | - | 0.00 |
| Dissipazione costitutiva, Dc (%)ad | ||||||||||||||
| Luce (L) | 0.07* | 4 | 0.26ns | 2 | L-W- | 25 | 11 | a | b | 30 | 13 | a | a | 0.14 |
| SWC (W) | 0.27ns | 0 | 0.42ns | 1 | L-W+ | 22 | 3 | a | ab | 27 | 6 | a | a | 0.00 |
| L x W | 0.29ns | 0 | 0.66ns | 0 | L+W- | 22 | 2 | a | a | 32 | 13 | a | a | 0.00 |
| - | - | - | - | - | L+W+ | 21 | 2 | a | a | 31 | 7 | a | a | 0.00 |
| - | - | - | - | - | Generale | 23 | 6 | - | - | 30 | 10 | - | - | 0.00 |
| Dissipazione mediata dal ciclo delle xantofille, Dx (%)ad | ||||||||||||||
| Luce (L) | 0.08* | 6 | 0.01* | 7 | L-W- | 23 | 7 | a | a | 23 | 7 | a | a | 0.91 |
| SWC (W) | 0.77ns | 0 | 0.93ns | 0 | L-W+ | 22 | 6 | a | a | 22 | 6 | a | a | 0.92 |
| L x W | 0.76ns | 0 | 0.65ns | 0 | L+W- | 20 | 6 | a | a | 26 | 15 | a | a | 0.03 |
| - | - | - | - | - | L+W+ | 20 | 5 | a | a | 27 | 6 | a | a | 0.01 |
| - | - | - | - | - | Generale | 22 | 6 | - | - | 24 | 10 | - | - | 0.02 |
| Efficienza quantica per centro di reazione, Fv’/Fm’ (%)ad | ||||||||||||||
| Luce (L) | 0.01* | 12 | 0.00* | 17 | L-W- | 54 | 7 | a | a | 49 | 10 | ab | b | 0.05 |
| SWC (W) | 0.61ns | 0 | 0.59ns | 0 | L-W+ | 55 | 5 | ab | ab | 51 | 9 | b | b | 0.02 |
| L x W | 0.64ns | 0 | 0.68ns | 0 | L+W- | 58 | 6 | b | b | 42 | 14 | a | a | 0.00 |
| - | - | - | - | - | L+W+ | 58 | 6 | b | b | 42 | 12 | a | a | 0.00 |
| - | - | - | - | - | Generale | 56 | 6 | - | - | 46 | 12 | - | - | 0.00 |
| Frazione di centri di reazione aperti, qP (%)ad | ||||||||||||||
| Luce (L) | 0.14ns | 6 | 0.03* | 8 | L-W- | 7 | 3 | a | a | 6 | 4 | a | a | 0.55 |
| SWC (W) | 0.07* | 0 | 0.35ns | 0 | L-W+ | 8 | 3 | a | ab | 6 | 3 | a | a | 0.05 |
| L x W | 0.56ns | 0 | 0.36ns | 0 | L+W- | 7 | 2 | a | ab | 10 | 5 | b | b | 0.05 |
| - | - | - | - | - | L+W+ | 9 | 2 | a | b | 10 | 3 | b | b | 0.27 |
| - | - | - | - | - | Generale | 8 | 3 | - | - | 10 | 140 | - | - | 0.15 |
Conclusioni
I semenzali di 6 mesi trapiantati nella primavera del 2005 nelle radure formatesi per mortalità naturale all’interno di un querceto misto in fase di decadimento hanno mostrato nei primi tre anni una mortalità molto ridotta, pari a 5%, 24% e 25% (contro il 50% comunemente riportato) imputabile per lo più alle condizioni edafiche al primo anno e all’ambiente luminoso nei due anni successivi. Lo studio ha evidenziato le migliori condizioni micro-ambientali per la crescita dei semenzali nei primi tre anni prendendo in considerazione per ogni ambiente la sua frequenza all’interno delle radure e la sopravvivenza dei semenzali. La vegetazione erbacea e soprattutto il rovo è nelle condizioni più aperte un forte elemento di competizione determinando la maggiore mortalità dei semenzali indipendentemente dall’umidità del suolo. Al terzo anno le dimensioni e gli accrescimenti sono maggiori (sebbene non statisticamente significativi) in condizioni di alta luce ed umidità, di contro i valori minimi si sono osservati in condizioni di carenza dei due fattori e valori intermedi in condizioni in cui uno solo dei due fattori risulta carente, con maggiore crescita in condizioni con una buona disponibilità idrica rispetto ad una buona disponibilità di luce.
Nelle radure di piccole e medie dimensioni del querceto misto del Bosco di San Bartolomeo a condizioni di maggiore illuminazione è associata una minore umidità edafica. Le condizioni con abbondanza di luce e acqua favorevoli alla crescita sono quindi poco rappresentate all’interno delle radure naturali ed associate ad un’elevata mortalità per competizione con la vegetazione erbacea. Nelle radure le condizioni intermedie con buona umidità e bassa luce sono le più comuni, mostrano una buona crescita ed un’elevata sopravvivenza dei semenzali. La condizione alternativa di buona disponibilità di luce ma bassa umiditàè anch’essa frequente, ma associata ad elevata mortalità. Con la disponibilità di luce si modifica il rapporto tra biomassa ed area fogliare, confermando l’utilità di questo indice per il monitoraggio delle condizioni luminose all’interno delle radure.
I parametri fotosintetici a luce saturante sono influenzati significativamente dalle condizioni luminose. L’umidità edafica influenza il trasporto elettronico e l’efficienza quantica in condizioni di stress idrico a metà estate, mentre l’interazione tra luce ed acqua non è risultata significativa. La capacità fotosintetica massima dei semenzali - espressa in termini di trasporto elettronico e di efficienza quantica dell’intero fotosistema a luce saturante - diminuisce all’aumentare dell’ombreggiamento e nel corso della stagione estiva, soprattutto per le piante adulte. I semenzali cresciuti in condizioni di buona disponibilità di luce e le foglie di luce di piante adulte dissipano efficacemente la luce in eccesso sotto forma di calore con meccanismi regolati dal ciclo delle xantofille. Nel corso dell’estate, e dello stress idrico, i semenzali (ma non le farnie adulte) presentano una fotoinibizione cronica, particolarmente evidente in condizioni di scarsa disponibilità idrica.
Ringraziamenti
Si ringraziano il Sig. A. Pierguidi per l’analisi della semente, il Sig. Gambogi, Comandante delle Guardie, ed il personale dell’Ente Parco per la gentilissima assistenza durante le misure in bosco, ed i revisori per i suggerimenti critici al testo.
References
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar