Deadwood in Italian forests according to National Forest Inventory results
Forest@ - Journal of Silviculture and Forest Ecology, Volume 6, Pages 365-375 (2009)
doi: https://doi.org/10.3832/efor0598-006
Published: Nov 23, 2009 - Copyright © 2009 SISEF
Research Articles
Abstract
Deadwood plays a key role in the functioning and productivity of forest ecosystem and it is an important feature for assessing and monitoring biodiversity. The third Ministerial Conference on the Protection of Forests in Europe (MCPFE) has recognized the importance of this forest component at the European level. More recently the national forest inventories have tried to harmonize the procedures including the quantitative and qualitative measurements of deadwood. This paper reports on the methods and results of Italian National Inventory of Forests and Forest Carbon Sinks (INFC) and compares the deadwood data with the results of other main European inventories and some local studies. In Italy the volume of deadwood (logs, snags and stumps) is on average 8.8 m3 ha-1.
Keywords
Coarse woody debris, Deadwood, Forest inventory, Forest habitat, Biodiversity
Introduzione
Fino a poco tempo fa il legno morto nei boschi veniva considerato dai tecnici forestali e da parte della popolazione un segno di cattiva gestione, per gli effetti relativi a possibili attacchi di parassiti, allo sviluppo di incendi o semplicemente per motivi di natura estetica ([44]). Oggi, pur non essendo trascurabili questi aspetti in particolari situazioni, al legno morto viene riconosciuto un ruolo fondamentale per la conservazione della biodiversità dell’ecosistema, e la sua presenza è divenuta particolarmente significativa per una selvicoltura attenta a salvaguardare i processi naturali e le specie. Nell’ecosistema forestale, il compartimento del legno morto ([6]) formato da CWD (Coarse Woody Debris - [42], [40]) e da alberi senescenti in vita con cavità marcescenti ([32]) fornisce infatti i microhabitat necessari agli organismi “saproxilici” definiti da Speight ([47]) quali organismi “che dipendono, durante una parte del loro ciclo di vita, dal legno morto o in via di decomposizione su alberi moribondi e/o morti o su funghi del legno o dalla presenza di altri organismi saproxilici”. La presenza degli organismi saproxilici fornisce circa il 30 % della biodiversità di una foresta ([56], [4]).
Oltre alla conservazione della biodiversità, nei boschi di montagna su versanti ripidi il legno morto può contribuire, nel breve e medio periodo, alla stabilità rispetto a fenomeni di rotolamento dei massi verso valle ([3]) ed alla conservazione del suolo ([14]). Il carbonio accumulato nella necromassa è una componente importante nella contabilità ambientale ed è menzionata tra i cinque pool di carbonio (biomassa epigea, biomassa ipogea, necromassa, lettiera e suolo) dall’Intergovernmental Panel on Climate Change ([22]).
A livello internazionale, la quantità di legno morto rappresenta uno degli indicatori di gestione forestale sostenibile ratificati dalla conferenza interministeriale europea ([35]) e il suo rilevamento è compreso nei principali programmi di monitoraggio ([51]), inclusi gli inventari forestali nazionali. In Italia, recenti studi di carattere locale in formazioni planiziarie ([31], [53], [52]) ed in formazioni forestali del Centro-Sud d’Italia ([12], [2], [28], [27], [1], [26], [29]) hanno analizzato il campionamento del legno morto sia sotto il profilo quantitativo (volume, massa, numero di pezzi e distribuzione diametrica) che qualitativo (dinamica, posizione, classe di decadimento e grado di copertura al suolo). Morelli et al. ([38]) hanno recentemente preso in esame alcuni aspetti metodologici per determinare con maggiore precisione lo stock attuale di carbonio presente nelle necromasse forestali.
I risultati del secondo inventario forestale italiano (Inventario Nazionale delle Foreste e dei serbatoi di Carbonio - INFC), recentemente divulgati ([21]), offrono l’occasione per effettuare una prima analisi ad ampio raggio della situazione italiana. In questo contributo si analizzano i dati relativi al legno morto dei nostri boschi rispetto a quanto noto per altri paesi (dati inventariali) o per casi di studio più particolari del nostro Paese.
Il rilievo del legno morto negli inventari forestali: il caso italiano
Il legno morto viene comunemente suddiviso in due principali componenti ([36]): le piante morte in piedi (standing deadwood) e il legno morto a terra (lying deadwood). Quest’ultimo viene a sua volta ripartito in coarse woody debris (CWD detrito legnoso grossolano) con diametro alla sezione più piccola uguale o maggiore a 10 cm, e in fine woody debris (legno morto fine), con diametro tra 2.5 e 10 cm ([16], [11]). Il materiale legnoso sotto la soglia di 2.5 cm viene considerato solitamente come parte della lettiera ([58]). Tali soglie diametriche non sono adottate uniformemente da tutti gli inventari forestali nazionali: ad esempio, riguardo alla soglia di rilevamento limite fra materiale grosso e fine, i paesi scandinavi (Svezia, Norvegia, Finlandia) applicano lo standard di 10 cm ([13]), Austria e Germania adottano 20 cm ([34], [25]), mentre Svizzera e Francia 7 cm ([57], [5]).
L’INFC nella sua terza fase prevede il rilievo del legno morto “grosso”, con soglia diametrica minima di 10 cm, e rinvia la misura della componente “fine” (< 10 cm) ad una successiva campagna di rilievi ([19]).
Nelle aree di saggio della terza fase INFC sono stati rilevati il legno morto a terra, gli alberi morti in piedi e le ceppaie, classificandole come conifere o latifoglie e registrandone dimensioni e stadio di decadimento. Quest’ultimo, che rappresenta il grado di decomposizione del legno ([48]), è riferito alla singola pianta o spezzone in piedi sulla base dell’integrità strutturale del legno e della presenza di corteccia e di ramuli con diametro inferiore ai 3 cm, secondo la metodologia di Hunter ([18]) e Woodall & Williams ([59]). Quale unità di campionamento è stata adottata un’area di saggio circolare di 531 m2 con centro nel punto di campionamento inventariale ([19]). I rilievi per la determinazione della necromassa sono stati effettuati su 6 685 aree di saggio, nel 25% delle quali non è stato rilevato legno morto di dimensioni superiori alle soglie fissate dal protocollo di rilevamento. A differenza delle altre componenti del legno morto, per gli alberi morti in piedi si è adottata la stessa soglia dimensionale prevista per le piante vive ed il rilievo ha pertanto interessato anche piante con diametro compreso fra 4.5 e 10 cm.
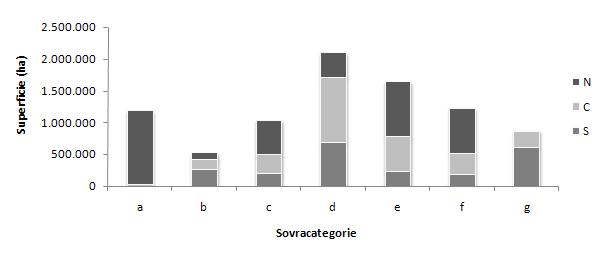
I rilievi hanno consentito di stimare il volume del legno morto (secondo la metodologia riportata in [21]), oltre che il numero di soggetti morti, ripartiti secondo la loro posizione (a terra, in piedi, ceppaie), per categoria di vegetazione e per unità amministrativa ([20]). I principali risultati sono pubblicati nel sito dedicato alla presentazione dell’inventario ([21]). Nel presente lavoro sono stati presi in considerazione i dati riferiti solo ai “boschi alti” ([20]), mentre sono stati esclusi gli impianti di arboricoltura e le aree temporaneamente prive di soprassuolo (per cause naturali, accidentali o antropiche per le quali si prevede la ricostituzione della copertura arborea in tempi brevi), per il loro contributo trascurabile (nemmeno l’1% del volume totale) al legno morto complessivamente presente a livello nazionale ([21]). I boschi alti, con una superficie di circa 8 600 000 ha, rappresentano la parte più rilevante della superficie forestale nazionale. Nell’analisi sono state raggruppate le categorie forestali (ridotte da 17 a 7 “sovracategorie”, aggregando formazioni non troppo diverse dal punto di vista ecologico) e le unità amministrative (ridotte da 21 a 3 “macroregioni”, in Nord, Centro e Sud). Questi raggruppamenti, come riportati nelle Tab. 1 e Tab. 2, sono stati costituiti con l’intento di facilitare la visione d’insieme dei risultati ottenuti. Per le sovracategorie i raggruppamenti considerati trovano un parallelo in alcune unità principali della vegetazione forestale del nostro Paese (foresta boreale di conifere, faggete, querceti misti, foresta sempreverde mediterranea) come descritte da Pignatti ([43]), sia pure con alcune differenze (ad esempio, sono state considerate unità distinte i castagneti e gli altri boschi di caducifoglie), che riflettono la fisionomia dei boschi italiani. La suddivisione in macroregioni tiene conto della suddivisione adottata dall’ISTAT per le statistiche ambientali ([23]), sebbene nel nostro caso l’Abruzzo venga considerato nella macroregione “Centro” per motivi fitogeografici ([41]). La ripartizione, in termini di superficie, dei boschi alti per le aggregazioni così determinate (Fig. 1), riflette la situazione forestale del nostro Paese: i boschi di conifere alpine sono largamente prevalenti al Nord, insieme a faggete, castagneti e carpineti ed agli altri boschi di caducifoglie; i querceti caducifogli prevalgono al Centro-Sud assieme alle pinete ed agli altri boschi di conifere (escluse le pinete di pino silvestre), mentre i boschi di latifoglie sempreverdi prevalgono al Sud.
Tab. 1 - Aggregazione delle categorie forestali INFC in sovracategorie.
| Sovracategoria | Categorie forestali INFC |
|---|---|
| a - Boschi di conifere alpine | Boschi di larice e cembro; boschi di abete rosso; boschi di abete bianco; boschi di pino silvestre e montano |
| b - Pinete e altri boschi di conifere | Pinete di pino nero, laricio e loricato; pinete mediterranee; altri boschi di conifere |
| c - Faggete | Faggete |
| d - Querceti caducifogli | Querceti di rovere, roverella e farnia; cerrete, boschi di farnetto, fragno e vallonea |
| e - Castagneti e carpineti | Castagneti; ostrieti e carpineti |
| f - Altri boschi di caducifoglie | Boschi igrofili; altri boschi di caducifoglie |
| g - Boschi di latifoglie sempreverdi | Leccete; sugherete; altri boschi di latifoglie sempreverdi |
Tab. 2 - Aggregazione dei distretti territoriali INFC in macroregioni.
| Macroregione | Distretto territoriale INFC |
|---|---|
| N - Nord | Piemonte, Valle d’Aosta, Lombardia, Alto Adige, Trentino, Veneto, Friuli V.G., Liguria, Emilia Romagna |
| C - Centro | Toscana, Umbria, Marche, Lazio, Abruzzo |
| S - Sud | Molise, Campania, Puglia, Basilicata, Calabria, Sicilia, Sardegna |
I risultati dell’INFC
Nel complesso l’INFC ha stimato, per i boschi italiani, una presenza di legno morto pari a 8.8 m3 ha-1 (Tab. 3), valore che comprende le tre componenti rilevate (alberi morti in piedi, legno morto a terra e ceppaie). A livello di aree geografiche, la densità di legno morto decresce passando da Nord Italia (13.4 m3 ha-1), a Centro (6.6 m3 ha-1) e Sud (3.5 m3 ha-1).
Tab. 3 - Volume ad ettaro del legno morto totale (alberi in piedi, legno morto a terra e ceppaie) delle sovracategorie di vegetazione (per le aggregazioni cfr. Tab. 1 e Tab. 2) e relativo errore standard percentuale.
| Sovracategoria | Nord | Centro | Sud | Italia | ||||
|---|---|---|---|---|---|---|---|---|
| m3 ha-1 | e.s.% | m3 ha-1 | e.s.% | m3 ha-1 | e.s.% | m3 ha-1 | e.s.% | |
| Boschi di conifere alpine | 14.4 | 4.7 | 25.5 | 159.4 | 5.6 | 245.4 | 14.5 | 4.1 |
| Pinete e altri boschi di conifere | 10.4 | 14.3 | 10.9 | 15.9 | 5.4 | 13.1 | 8.0 | 8.1 |
| Faggete | 9.8 | 7.2 | 6 | 19.1 | 4 | 12 | 7.6 | 6.4 |
| Querceti caducifogli | 7.6 | 10.9 | 3.1 | 8.4 | 2.2 | 11 | 3.6 | 5.6 |
| Castagneti e carpineti | 19 | 6 | 13.7 | 9.4 | 9 | 15.5 | 15.9 | 4.5 |
| Altri boschi di caducifoglie | 11.3 | 8 | 5.7 | 14.6 | 3.3 | 18 | 8.6 | 6.2 |
| Boschi di latifoglie sempreverdi | 9.2 | 96.8 | 3.6 | 23.7 | 2 | 12 | 2.6 | 10.9 |
| Totale boschi alti | 13.4 | 3.0 | 6.6 | 5.5 | 3.5 | 5.8 | 8.8 | 2.3 |
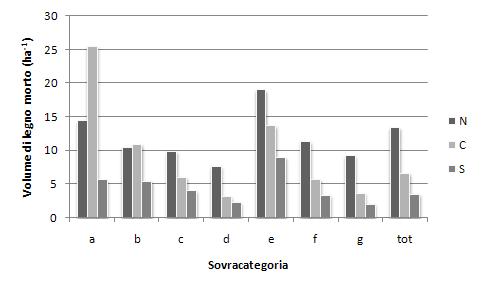
Analogamente, analizzando i risultati per sovracategorie di vegetazione (Fig. 2), si osserva la tendenza alla riduzione della quantità di legno morto passando da Nord a Sud, con l’eccezione dei boschi di conifere alpine che vedono al Centro (25.5 m3 ha-1) ed al Sud (5.6 m3 ha-1) valori elevati, ma riferibili a superfici molto ridotte presenti sull’Appennino, generalmente ad elevato grado di protezione o occupate da boschi invecchiati.
Fig. 2 - Volume del legno morto per unità di superficie per sovracategorie e macroregioni (tot: relativo al totale dei boschi alti).
Se si esclude il dato “anomalo” sopra citato, il gruppo dei castagneti e carpineti presenta la necromassa media più alta a livello nazionale (da Nord a Sud, rispettivamente pari a 19, 13.7 e 9 m3 ha-1), seguito al Nord dai boschi di conifere alpine (14.4 m3 ha-1), al Centro e al Sud dalla sovracategoria delle pinete ed altri boschi di conifere (rispettivamente 10.9 e 5.4 m3 ha-1). Infine anche gli altri boschi di caducifoglie al Nord si caratterizzano per un’elevata presenza di legno morto (11.3 m3 ha-1).
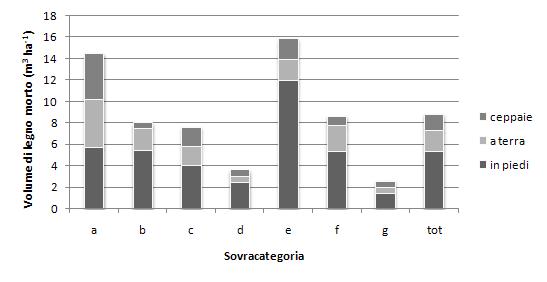
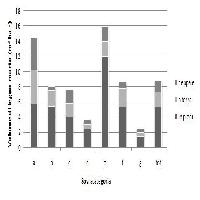
Osservando i dati relativi al tipo di legno morto (Fig. 3), si può constatare che il legno morto in piedi rappresenta la parte prevalente, ad eccezione dei boschi di conifere alpine, dove le tre componenti sono presenti in forma equilibrata. Occorre però tener presente che le stime di volume per gli alberi morti in piedi si basano su di una soglia di diametro più bassa, pari a 4.5 cm e pertanto comprendono una frazione di materiale in più, pari mediamente al 25% del volume totale di questo tipo. Considerando il carattere ecologico delle formazioni, si conferma la tendenza generale ad una presenza più ridotta di legno morto per i boschi termofili e mediterranei rispetto ai boschi montani ed alpini.
Fig. 3 - Volume del legno morto per unità di superficie, ripartito per tipo (ceppaie, a terra, in piedi) nelle diverse sovracategorie.
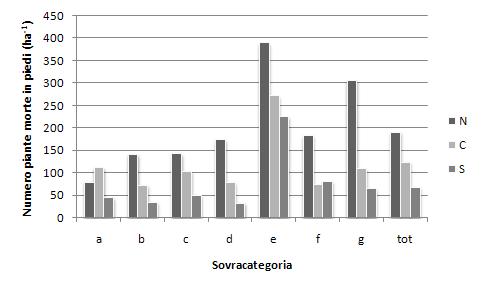
Vengono quindi illustrati i dati relativi al numero di alberi morti in piedi per ettaro, per sovracategorie di vegetazione (Fig. 4). Anche in questo caso si possono osservare le tendenze già evidenziate, con valori massimi nei castagneti e carpineti al Nord (389 piante ha-1), dovuti soprattutto al contributo delle formazioni a castagno, e decrescenti al Centro ed al Sud. I valori massimi si registrano sempre al Nord, superando le 100 piante ha-1 in tutte le sovracategorie, ad eccezione dei boschi di conifere alpine. Il valore medio nazionale risulta di 139 piante ha-1 e i valori per macroregioni di 191, 123 e 67 piante ha-1 rispettivamente per Nord, Centro e Sud.
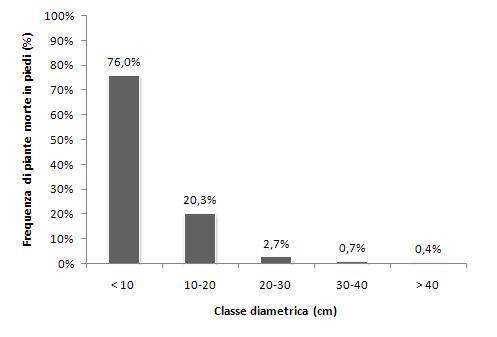
Nel grafico di Fig. 5, viene infine riportata la ripartizione percentuale del numero di alberi morti rimasti ancora in piedi, nelle diverse classi diametriche. Si può osservare che oltre tre quarti delle piante hanno un diametro a 1.30 m inferiore a 10 cm, mentre le piante più grosse (diametri sopra 30 cm) rappresentano nel complesso circa l’1% delle piante. Nella successiva Tab. 4 è riportato il numero medio ad ettaro delle piante di maggior diametro nelle diverse sovracategorie: i valori più alti si hanno per castagneti e carpineti e per i boschi di conifere alpine, quelli minimi per querceti caducifogli e per i boschi di latifoglie sempreverdi.
Tab. 4 - Numero medio di piante morte, in piedi, con diametro superiore a 30 cm, per sovracategoria.
| Sovracategoria | Numero piante morte ha-1 | |
|---|---|---|
| 30-40 cm | >40 cm | |
| Boschi di conifere alpine |
1.57 | 0.82 |
| Pinete e altri boschi di conifere | 1.59 | 0.48 |
| Faggete | 0.71 | 0.38 |
| Querceti caducifogli | 0.40 | 0.13 |
| Castagneti e carpineti | 1.64 | 0.97 |
| Altri boschi di caducifoglie |
1.26 | 0.63 |
| Boschi di latifoglie sempreverdi |
0.09 | 0.13 |
I dati dell’INFC a confronto con quelli di altre indagini nazionali e locali
Nei vari contributi relativi alla presenza di legno morto nelle formazioni forestali considerati in questo paragrafo, occorre distinguere gli studi di tipo inventariale, basati sul rilievo di numerose aree di saggio secondo un disegno campionario predefinito (come gli inventari nazionali), da indagini particolari, specifiche sul legno morto, che esaminano singoli tipi di bosco o situazioni locali, su un campione più limitato ([12], [2], [28], [51], [27], [1], [26], [29]).
Nonostante i limiti dovuti alle diverse definizioni e soglie adottate, osservando il quadro complessivo descritto dai diversi inventari nazionali e riassunto schematicamente nella Tab. 5, si può affermare che la presenza di legno morto nei boschi centro-europei sia mediamente superiore a quella dei boschi dei paesi scandinavi o di paesi come l’Italia e la Francia. Rispetto ai paesi che hanno adottato soglie minime di rilievo pari o inferiori a quelle italiane, i valori medi di volume complessivo del legno morto dei nostri boschi si collocano al di sopra di quelli della Svezia (6.1 m3 ha-1 - [13]), di Norvegia e Finlandia (6.8 e 5.6 m3 ha-1 - [37]) e della Francia (2.2 m3 ha-1 - [55]), ma risultano inferiori a quelli della Svizzera (11.9 m3 ha-1 - [8]). In Germania ed Austria, paesi con soglie di rilievo superiori a quelle italiane, i valori medi di legno morto sono, rispettivamente, 11.5 ([25]) e 13.9 m3 ha-1 ([34]).
Tab. 5 - Dati sul volume del legno morto derivanti dai principali inventari forestali europei con le rispettive soglie di rilievo.
| Paese | Necromassa media (m3 ha-1) |
Anno di rilievo |
Soglia limite di rilievo legno a terra (cm) |
|---|---|---|---|
| Svezia | 6.1 | 1993-2002 | 10 |
| Norvegia | 6.8 | 1994-1998 | 10 |
| Finlandia | 5.6 | 1996-2003 | 10 |
| Germania | 11.5 | 2001-2002 | 20 |
| Austria | 13.9 | 2000-2002 | 20 |
| Svizzera | 11.9 | 1993-1995 | 7 |
| Italia | 8.8 | 2005 | 10 |
| Francia | 2.2 | 2002 | 7 |
L’accumulo di legno morto nei boschi viene considerato un effetto della maggiore ricorrenza di fenomeni di disturbo naturali (p.es., passaggio del fuoco, vento, attacchi di parassiti) e della conseguente mortalità delle piante arboree, rispetto ai processi che incidono sulla sua riduzione, come la decomposizione, le utilizzazioni legnose o gli stessi incendi ([10], [49]). Come osservato da Hahn & Christensen ([15]), esiste anche una relazione diretta fra produttività (volume degli alberi vivi per tipo di vegetazione forestale) e legno morto nel bosco. L’effetto combinato di questi diversi fattori potrebbe spiegare i valori più elevati di legno morto presente nei boschi dei paesi centro-europei.
Relativamente alla situazione del nostro Paese, la presenza di quantitativi di legno morto inferiori per le formazioni più termofile (p.es., pinete non alpine, querceti e boschi di latifoglie sempreverdi) rispetto a quelle più montane (p.es., boschi di conifere alpine, faggete, castagneti e carpineti) conferma una tendenza analoga rilevata nei siti di livello II della rete di monitoraggio europea ICP ([51]).
Le peculiari condizioni ambientali delle aree mediterranee (maggiore rapidità di decomposizione a temperature medie più alte, maggiore frequenza degli incendi, minori danni per eventi meteorologici estremi nei boschi montani), le utilizzazioni più frequenti ed intensive (prevalenza dei cedui sulle fustaie, turni brevi di trattamento), unite alle diffuse pratiche di raccolta di legna secca da parte delle popolazioni locali ([29]), potrebbero spiegare, a livello nazionale, i quantitativi di legno morto più bassi nei boschi di impronta più termofila e in quelli del Centro e del Sud.
I maggiori quantitativi di legno morto a livello nazionale si hanno invece nella sovracategoria che include castagneti e ostrieti, dove sono riconducibili agli attacchi parassitari sul castagno, e in quella delle conifere alpine, dove agli effetti degli schianti prodotti da eventi di natura climatica si sommano le ridotte utilizzazioni nei boschi di alta quota o in condizioni meno accessibili, con conseguente accumulo di legno morto.
Più difficile appare il confronto con dati rilevati localmente. Gli inventari regionali effettuati in passato (così come il precedente inventario nazionale) non prevedevano il rilievo del legno morto, salvo il caso della Liguria ([50]). Una comparazione di massima può essere pertanto effettuata solo con studi specifici, come quello condotto in Alto Adige sull’emerobia nel 1997, che ha stimato un volume di legno morto (a terra, in piedi e ceppaie) di 21.7 m3 ha-1 ([54]), valore molto superiore alla media nazionale, ma in linea con quello (23.9 e 29.3 m3 ha-1) rilevato nella vicina Svizzera per altre due regioni forestali (Giura e Plateau) da Böhl & Brändli ([5]).
Nei numerosi studi condotti per l’Italia centro-meridionale, sono stati applicati diversi metodi di rilevamento del legno morto, adottando aree campione di superficie variabile fra 1200 e 2700 m2 (Barreca et al 2005, [1], [26], [29]), oppure transect di intersezione lineare in subplot di aree campione di 2500 m2 ([27]). I risultati pubblicati presentano un’elevata variabilità. Nello studio di Lombardi et al. ([27]), effettuato in 21 siti rappresentativi dei diversi tipi forestali del Molise, sono stati rilevati quantitativi di legno morto medi fra 3.2 e 15.8 m3 ha-1 per boschi ordinariamente gestiti e 5.8 e 56.3 m3 ha-1 per quelli non soggetti a prelievo da circa 50 anni. Per boschi di farnetto della Calabria (Serre e Aspromonte), Barreca et al. ([1]) hanno calcolato valori di legno morto medi di 9.3 m3 ha-1, mentre per le cerrete del Molise, Marchetti & Lombardi ([28]) hanno riscontrato valori di 15.1 m3 ha-1, che rappresentano livelli assai superiori di quelli rilevati dall’INFC per i querceti caducifogli al Sud (2 m3 ha-1 - Tab. 3). Infine, per cedui di faggio del Parco Nazionale dell’Aspromonte e nel Parco dell’Etna, Barreca et al. ([2]) hanno stimato volumi di legno morto medio di 8.9 m3 ha-1 (soprassuoli transitori) e di 15.4 m3 ha-1 (cedui in evoluzione).
Relativamente ai boschi non soggetti a gestione selvicolturale ordinaria, La Fauci & Mercurio ([26]), per cedui di castagno invecchiati dell’Aspromonte riportano valori medi di 21.0 ± 6.3 m3 ha-1 (ceduo di 40 anni) e di 59.1 ± 17.1 m3 ha-1 (ceduo di 45 anni). Nelle faggete invecchiate della Valle Cervara in Abruzzo sono stati stimati volumi medi di legno morto pari a 65 m3 ha-1 ([12]), mentre Marziliano ([29]) ha rilevato 33.9 m3 ha-1 in cedui invecchiati di leccio (55 anni) del Gargano. Infine, si cita uno studio relativo al Nord Italia, condotto in formazioni planiziarie a ceduo composto della Pianura Padana abbandonate da circa 60 anni, dove sono stati stimati valori medi di 26.3 m3 ha-1 ([31]).
Discussione e conclusioni
Sintetizzando i principali risultati emersi dal confronto fra i dati INFC e quelli di altri studi a livello nazionale e locale, è possibile evidenziare:
- una presenza di legno morto nei boschi italiani mediamente inferiore a quella dei boschi dei paesi centro-europei, ma superiore a quella dei paesi scandinavi e della Francia;
- a livello nazionale, un valore medio del volume di legno morto per le formazioni più termofile (e.g., pinete non alpine, querceti e boschi di latifoglie sempreverdi) inferiore a quello presente nelle formazioni più montane o alpine (e.g., boschi di conifere alpine, faggete, castagneti e carpineti);
- un’elevata presenza di legno morto, anche molto superiore alla media nazionale, in boschi caratterizzati da una gestione poco intensiva, abbandonati o invecchiati, come emerge da studi locali effettuati in Italia centro-meridionale e nella Pianura Padana.
Gli studi di carattere locale, riflettendo aspetti particolari dei popolamenti esaminati, conseguenza dell’età, della gestione e del contesto territoriale ed ambientale, si prestano meno bene a confronti con dati rilevati a livello nazionale, ma costituiscono una base conoscitiva importante per successive analisi, come quelle sulla dinamica di accumulo e sulla distribuzione territoriale del legno morto, in relazione alle specifiche esigenze di flora e fauna. Come evidenziano alcune ricerche in regioni più settentrionali ([15], [7], [24]), questi aspetti sono importanti per valutare il ruolo svolto dal legno morto per la conservazione della biodiversità.
Secondo [45] circa un quinto della fauna del bosco dipende dalla presenza di legno morto, ma è tuttavia evidente che la ricchezza specifica di un bosco dipende anche da molti altri fattori, non ultimo anche dalla presenza di alberi vivi. Più che puntare ad una massimizzazione della quantità di legno morto, nella gestione del bosco si dovrebbe tendere a portare questa componente verso valori ottimali, indicati da soglie di riferimento, variabili per contesto ambientale e tipo di bosco ([46]).
Per i boschi centro-europei, Böhl & Brändli ([5]) riportano una quantità ottimale di legno morto intorno a 20-40 m3 ha-1, come indicazione di massima scaturita da un confronto su base bibliografica, anche se tale soglia varia con il tipo di bosco. Secondo [9] basterebbero ad esempio circa 15 m3 ha-1 per la salvaguardia di particolari specie ornitiche in boschi subalpini di conifere, mentre Müller et al. ([39]), in uno studio in boschi temperati della Baviera, considerando le esigenze della fauna xilobiontica, indicano un valore di 20 m3 ha-1. Sotto questo profilo, i valori medi per il Nord Italia (13.4 m3 ha-1 per i boschi alti), risulterebbero inferiori a quelli ottimali. Occorre comunque rilevare che non sono rari i casi di valori prossimi o superiori ai 20 m3 ha-1 a livello di singole categorie forestali analizzate nelle diverse regioni. Si segnalano ad esempio i valori medi di volume di legno morto nei boschi di abete rosso del Piemonte e della Val d’Aosta (rispettivamente pari a 22.7 e 20.0 m3 ha-1) e quelli dei boschi di abete bianco che in 6 regioni superano la soglia indicata, arrivando a un valore massimo di 36.9 m3 ha-1 in Friuli-Venezia Giulia ([21]).
Per i boschi mediterranei, Humphrey et al. ([17]) considerano più importante, dal punto di vista biologico, il numero di soggetti arborei senescenti cavi, definiti come “alberi habitat” ([33]). Questi autori considerano la presenza di 5-10 “alberi habitat” ad ettaro quale numero sufficiente per la conservazione della biodiversità riferita agli organismi saproxilici, un valore sostanzialmente in accordo con quanto già riportato da Mason ([30], [32]) per l’Italia. Un’indicazione molto approssimativa della presenza di alberi cavi nei boschi italiani è ricavabile dai risultati della II fase dell’INFC ([20]). Il rilievo prevedeva infatti di osservare, riferendosi ad un’area circolare di 2000 m2, la presenza di alberi cavi di diametro superiore a 20 cm nell’intorno del punto di campionamento. Sul territorio nazionale tale fenomeno è stato osservato su circa 500 000 ha di bosco, pari a circa 1/16 della superficie coperta dal bosco, di cui ben 120 000 concentrati nella categoria forestale dei castagneti. Dovendosi osservare almeno un soggetto su di un’area di 2000 m2, si può stimare che in questi boschi siano presenti almeno 5 alberi ad ettaro con cavità, che potrebbero quindi svolgere un’importante funzione di microhabitat.
Non va altresì dimenticato che le considerazioni sulle soglie ottimali sono anch’esse necessariamente indicative, in un paese come il nostro, con formazioni differenziate dal punto di vista ecologico e fisionomico, nel quale l’indicazione generale va necessariamente interpretata alla luce delle specificità del popolamento forestale esaminato.
I risultati prodotti dall’INFC offrono per la prima volta la possibilità di considerare stime per aggregati di specie (categorie e sottocategorie forestali), facilitando per questo anche l’interpretazione dei risultati delle analisi locali. In tale contesto, gli studi di approfondimento sui valori di soglia ottimali per le principali formazioni forestali del Paese, in relazione alle specifiche esigenze delle specie associate di fauna e flora, appaiono di notevole interesse per un avanzamento delle conoscenze in questo settore.
Ringraziamenti
Si ringraziano il Corpo Forestale dello Stato, che ha realizzato l’INFC insieme al CRA, per il consenso dato agli autori all’uso dei dati inventariali, e il dott. Franco Mason, che con una revisione critica e puntuale del testo ha consentito di migliorarne la forma ed i contenuti originari.
References
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar