Large outbreaks of Ips acuminatus in Scots pine stands of the Italian Alps
Forest@ - Journal of Silviculture and Forest Ecology, Volume 7, Pages 259-267 (2010)
doi: https://doi.org/10.3832/efor0644-007
Published: Dec 02, 2010 - Copyright © 2010 SISEF
Research Articles
Abstract
In the last years, many Scots pine (Pinus sylvestris) stands have been severely attacked by the bark beetle Ips acuminatus (Coleoptera Curculionidae Scolytinae). In the outbreak area of San Vito di Cadore (Eastern Dolomites), the number of attacked trees since 2005 and both the emergence of bark beetles and natural enemies have been assessed. The investigated forests showed dozens of easily recognizable infestation spots with size ranging from about 20-30 trees (small spots) up to 300 trees (large spots). These infested spots evolved quickly, while new ones appeared within a radius of few hundreds of meters. During the last 5 years (2006-2010) we sampled branches from small and large spots and lodged them into emergence cages: adults of I. acuminatus as well as natural enemies were collected weekly, identified and counted. At the same time, a monitoring program of the surveyed pine stands was carried out to check the enlargement of old spots and the appearance of new ones. Voltinism and phenology of I. acuminatus were investigated by pheromone traps baited with different lures (Austrian vs. Spanish lures). The effects of a sanitation felling of about 4500 infested trees, carried out by the Regional Forest Service in autumn 2007 on I. acuminatus population were also assessed. Throughout the whole sampling area I. acuminatus resulted bivoltine, with the highest density attained during the first generation. However, a part of the population still evidenced a monovoltine behaviour. The realized sanitation felling strongly reduced both breeding sites and the number of infested trees observed during the following year. Moreover the pheromone-baited traps gave useful information about changes in bark beetle population density; the trapping efficiency of Spanish lure resulted clearly higher than the Austrian one. Finally, the recorded parasitism may have a role in outbreak dynamics as it was significantly higher during the second host generation, in both small and large spots.
Keywords
Ips acuminatus, Scots pine, Pine decline, Bark beetles, Mass-trapping, Sanitation felling
Il deperimento del pino silvestre sulle Alpi
Negli ultimi anni le formazioni di pino silvestre (Pinus sylvestris) hanno subito severi fenomeni di deperimento e mortalità che hanno interessato vasti settori continentali delle Alpi Italiane (Valle d’Aosta, Piemonte, Alto Adige, Lombardia, Veneto), Austriache (Tirolo, Carinzia, Stiria), Svizzere (Vallese) e Francesi (Savoia e Provenza orientale - [15], [11], [1]). I primi segnali del declino della vitalità del pino silvestre comparvero nell’Europa centro-meridionale già a partire dagli anni ’80 del secolo scorso ([28]), in seguito agli alti livelli di inquinamento atmosferico e di deposizioni acide misurati in quegli anni. L’origine chimica del deperimento fu tuttavia presto esclusa in seguito al manifestarsi di nuovi fenomeni di mortalità avviati a partire dagli anni ’90, concentrati principalmente a quote inferiori ai 1200 m. Una recente analisi dello stato di salute delle pinete delle Alpi occidentali ([15], [11], [1]) ha rilevato un deperimento da medio a grave in molte delle situazioni esaminate: i dati evidenziano la recessione del pino silvestre nelle foreste di media e bassa quota e la presenza di estese zone di moria distribuite in modo apparentemente casuale sia sui versanti settentrionali sia su quelli meridionali, sebbene le pinete di alta quota siano relativamente prive di danni riconducibili al deperimento. É interessante notare che i versanti a maggiore pendenza esibiscono i tassi di mortalità più alti, che in alcuni casi raggiungono il 35% dell’area basimetrica del comprensorio forestale, un valore dieci volte superiore alla mortalità ordinaria ([1]).
Il deperimento del pino silvestre si manifesta con un quadro sintomatologico complesso, variabile e generalmente aspecifico. Improvvisi ingiallimenti della chioma e disseccamento dei rami e del cimale sono osservabili nel periodo estivo, associati ad una progressiva e precoce filloptosi degli aghi più vecchi. Nei casi più gravi l’evento culmina con la morte delle piante, che si può manifestare o in modo improvviso, durante la primavera, o dopo un deperimento lungo e progressivo, in estate. Il fenomeno può riguardare sia singoli individui, sia gruppi di piccole o medie dimensioni. In molti casi ai sintomi aspecifici si sovrappongono quelli dovuti alla presenza di particolari agenti parassitari o patogeni, definiti di debolezza, che colonizzano piante in precarie condizioni vegetative ([15], [11]).
Le cause di questo deperimento sono tuttora oggetto di numerose ricerche, sebbene appaia sempre più evidente l’azione congiunta di molteplici fattori che includono le variazioni climatiche, con prolungati deficit idrici, l’abbandono della gestione selvicolturale di pinete montane, con l’avvio di successioni forestali a favore di latifoglie xerofile, e la comparsa di infezioni fungine e infestazioni di insetti parassiti del pino silvestre.
Gli scolitidi dei pini
Nell’ambito degli insetti fitofagi di interesse forestale, le specie che si sviluppano a spese delle parti durevoli delle piante (xilofagi sensu lato) rappresentano la componente più incisiva per la sopravvivenza dell’ospite vegetale attaccato e, nel lungo termine per il mantenimento e la funzionalità di interi soprassuoli. Gli effetti immediati delle loro pullulazioni si registrano soprattutto in popolamenti sofferenti per scompensi di natura climatica. La presenza di questo gruppo funzionale è infatti spesso intimamente correlata all’azione di deperimenti che riducono il vigore generale dell’ospite ([4]). Tra le entità xilofaghe strettamente legate al pino silvestre e maggiormente coinvolte nei fenomeni di mortalità di tali soprassuoli, i coleotteri scolitidi (Coleoptera Scolytidae), e in particolare quelli afferenti ai generi Tomicus (T. minor e T. piniperda) e Ips (I. acuminatus e I. sexdentatus), rivestono indubbiamente un ruolo di primo piano con infestazioni di intensità e frequenza crescenti in molti ambienti alpini italiani ([12], [6]) ed europei ([28], [22], [4], [11]). Il riscaldamento climatico in atto altera le condizioni vegetative di molte pinete, indebolite sempre più da gravi fenomeni di aridità estiva ed invernale che influenzano la suscettibilità di tali popolamenti ad attacchi di insetti xilofagi.
Il bostrico acuminato
Il coleottero scolitide Ips acuminatus (Gyllenhal), comunemente noto come bostrico acuminato, è fra i più comuni agenti parassitari che approfittano del deperimento delle pinete di pino silvestre. Negli ultimi decenni si sono infatti verificate gravi pullulazioni in diversi paesi europei collocati al margine meridionale dell’areale di distribuzione del pino silvestre, quali Francia ([28], [18], [19]), Spagna ([23]) e Svizzera ([15], [11]). In Italia sono stati documentati attacchi piuttosto consistenti in Trentino e Alto Adige a partire dal 1995 ([25]), Valtellina dal 2001 ([21]), e Calabria dai primi anni 2000 a carico del pino loricato, in associazione con altri scolitidi ([17], [27]). Dal 2005 anche numerose pinete della provincia di Belluno, e in particolare del Cadore, manifestano ingenti danni ([13], [6], [7], [8], [9], [10]).
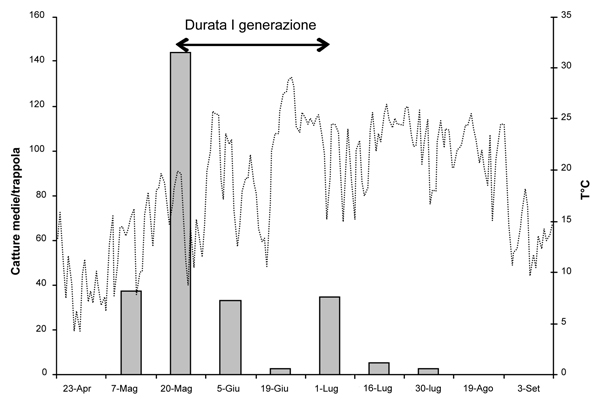
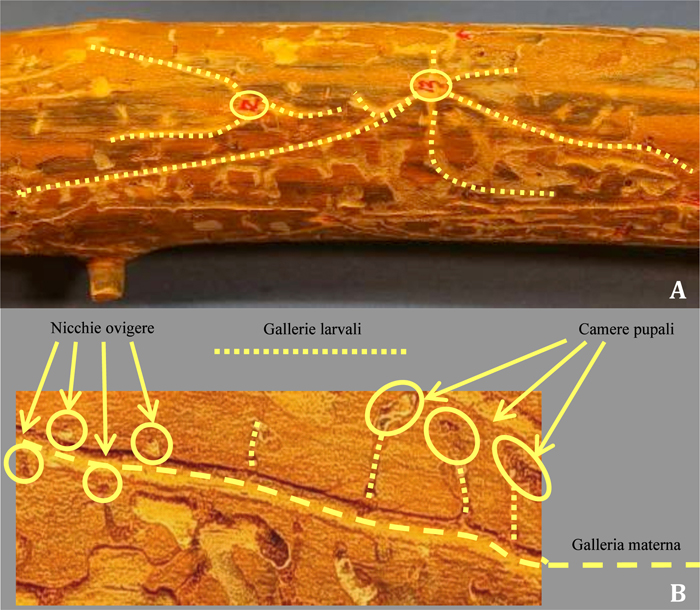
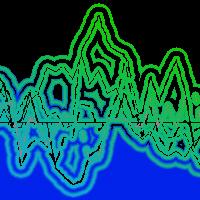
Date le sue piccole dimensioni (2.2 - 3.5 mm) il bostrico acuminato colonizza la corteccia della parte medio-alta del fusto e pressoché tutte le branche principali. In primavera gli adulti volano alla ricerca delle piante ospiti e il picco delle catture si registra con temperature massime dell’aria almeno pari o superiori a 16° C (Fig. 1). I primi a giungere sulla corteccia sono i maschi che, dopo aver scavato una “camera di accoppiamento” o “vestibolo”, con una miscela di feromoni di aggregazione attraggono da 2 a 7 femmine. In seguito all’accoppiamento ciascuna femmina scava sotto corteccia una “galleria materna” che, a seconda della densità di colonizzazione, può raggiungere gli 11 cm di lunghezza, presentando un andamento parallelo alle fibre del legno (Fig. 2A). Lungo i due lati della galleria, entro piccoli loculi detti “nicchie ovigere”, vengono singolarmente deposte le uova (Fig. 2B), il cui numero dipende dalla lunghezza della galleria essendo la distanza tra le nicchie piuttosto costante (circa 0.6 cm). Le larve neonate iniziano a nutrirsi del floema scavando, perpendicolarmente alla galleria materna, brevi “gallerie larvali” ingombre di rosura e con diametro progressivamente crescente (Fig. 2B). Al termine dello sviluppo le larve mature affrontano la metamorfosi all’interno di “celle pupali” che spesso vanno a intaccare l’alburno (Fig. 2B). Il neo-adulto sfarfallato, per completare lo sviluppo e raggiungere la maturità sessuale, trascorre un ulteriore periodo sotto corteccia scavando gallerie di nutrizione ad andamento irregolare, sovente sovrapposte al sistema di gallerie sopra descritto. Lo sviluppo completo richiede circa 6 settimane (Fig. 1) e verso la fine di giugno compaiono i nuovi adulti. La generazione estiva, ovvero la seconda, produrrà individui che sverneranno sottocorteccia allo stadio adulto.
Fig. 1 - Catture medie di Ips acuminatus avute nella primavera-estate 2008 in Cadore e andamento delle temperature massime giornaliere.
Fig. 2 - Sistemi riproduttivi sottocorticali di Ips acuminatus. (A): sono chiaramente visibili i vestiboli (cerchiati in giallo) e le numerose gallerie materne che si originano da essi (evidenziate dal tratteggio); (B): nicchie ovigere, gallerie larvali e celle pupali (foto: F. Colombari).
Gli attacchi conducono rapidamente a morte le piante, che nel giro di poche settimane presentano chiome rosseggianti a seguito del disseccamento degli aghi (Fig. 3). Inoltre, sebbene le gallerie materne e larvali incidano il legno solo superficialmente, il materiale infestato subisce un danno tecnologico dovuto all’invasione dell’alburno da parte di funghi simbionti agenti di azzurramento, sempre rilevati nel materiale abbattuto (Fig. 4). I. acuminatus è infatti una specie fleomicetofaga, regolarmente associata con tre principali specie fungine: Ophiostoma brunneo-ciliatum, O. ips e Ambrosiella macrospora. Le prime due specie sono patogene e interagiscono con le difese della pianta limitando la possibilità di questa di difendersi dagli attacchi dello scolitide ([20]). A. macrospora è invece un fungo dell’ambrosia, fondamentale per l’alimentazione delle larve ma non patogeno per la pianta ([16]).
Fig. 3 - Nucleo di piante attaccate con chiome arrossate in seguito all’attacco del bostrico acuminato (foto: V. Finozzi).
Fig. 4 - Azzurramento dell’alburno dovuto a funghi del genere Ophiostoma inoculati dagli adulti di Ips acuminatus (foto: F. Colombari).
Misure di monitoraggio e controllo
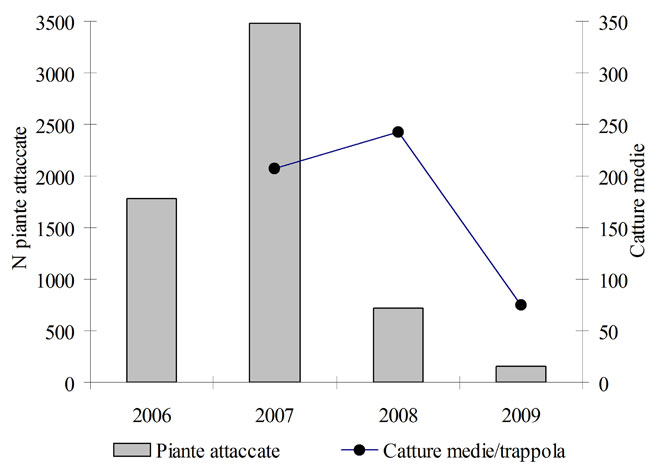
Nell’ambito di un’ampia indagine relativa all’analisi di vari aspetti della bio-ecologia e del controllo di I. acuminatus, numerose popolazioni di I. acuminatus distribuite lungo l’intero arco alpino - Valle d’Aosta, Valtellina (SO), Valcamonica (BS), Val Venosta (BZ), Cadore (BL) e Val Dogna (UD) - sono state ripetutamente campionate al fine di poter analizzare le variazioni temporali e geografiche dei principali parametri presi in considerazione. In particolare, le infestazioni comparse in provincia di Belluno sono state studiate con attenzione già a partire dal 2006. I primi risultati mostrano come gli alberi attaccati dal 2006 al 2010, oltre 6000 piante, si presentino ripartiti in decine di nuclei di dimensioni variabili (da un minimo di 2-3 a oltre 150 piante l’uno), successivamente censiti, cartografati e campionati misurandone inoltre i principali parametri selvicolturali e fitosanitari. L’analisi dei dati mostra che le aree colpite si distribuiscono in modo apparentemente casuale sul territorio e che non si espandono nel tempo, ma nelle loro vicinanze - anno dopo anno - compaiono nuove aree che seguiranno la stessa evoluzione ([13]). Il 2006 e 2007 hanno presentato elevate densità di infestazione con danni particolarmente gravi (Fig. 5). Nell’autunno del 2007 si è quindi intervenuti con un taglio fitosanitario finalizzato all’abbattimento e rimozione di tutte le piante colpite nel corso dei due anni precedenti. L’azione è stata condotta mediante esbosco con elicottero e distruzione per cippatura di oltre 4500 piante distribuite in 47 nuclei di infestazione. Il taglio ha interessato anche alcune piante sane presenti all’interno o lungo i margini dei nuclei di infestazione. L’intervento si è dimostrato estremamente positivo in quanto ha ridotto di quasi l’80% il danno registrato nell’anno seguente (Fig. 5), e ha avviato alla conclusione una pullulazione che durava da almeno 3 anni.
Fig. 5 - Andamento temporale delle catture di Ips acuminatus e ammontare dei danni provocati nei popolamenti di pino silvestre monitorati.
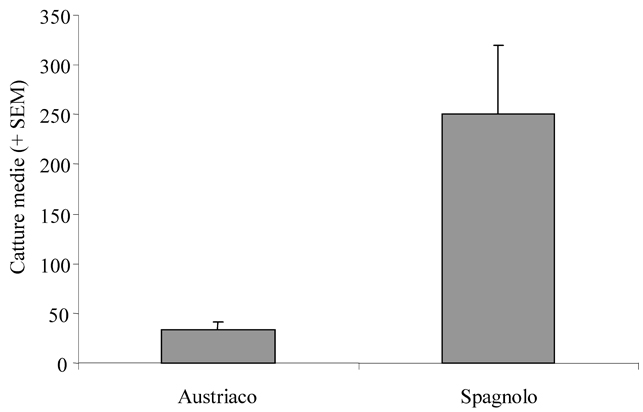
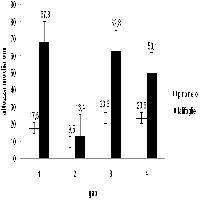
Oltre al censimento dei danni, a partire dal 2007 è stata intrapresa una sorveglianza delle popolazioni di I. acuminatus mediante trappole “ad imbuto” (Fig. 6) innescate con uno specifico feromone di aggregazione di produzione austriaca (AcuWit®, Witasek®). Le trappole sono state collocate nei vari nuclei d’infestazione in numero variabile in relazione alle dimensioni del nucleo, mantenendo tuttavia una densità costante pari a circa 1 trappola ogni 20 piante colpite. Il controllo delle catture e lo svuotamento delle trappole è stato eseguito ogni 15 giorni a partire da metà aprile fino a metà settembre. A metà giugno, dopo due mesi dall’inizio delle prove, gli erogatori dei feromoni sono stati sostituiti. I periodi di volo e il numero di generazioni riscontrate nei boschi monitorati sono risultati essere molto simili da un anno all’altro, fatto salvo qualche piccola variazione dovuta alle locali condizioni climatiche. L’insetto inizia l’attività primaverile a fine aprile (Fig. 1); dopo circa un mese (fine maggio) si hanno in genere deboli catture di insetti riemergenti alla ricerca di nuovi ospiti su cui avviare “generazioni sorelle” (Fig. 1). Nel corso dell’estate le catture sono generalmente molto scarse e l’assenza di nuovi consistenti sfarfallamenti indica che la specie affronta l’inverno con individui di seconda generazione rimasti all’interno dei pini attaccati in giugno. Benché le catture medie siano molto basse (Fig. 5), il loro andamento temporale riflette in parte quello dei danni, con valori elevati nel corso del 2007 e 2008, e poi sensibilmente inferiori nel 2009 (-70%), a indicare una popolazione in declino (Fig. 5). L’uso di tali trappole sembra quindi essere un valido strumento per il monitoraggio delle popolazioni, ma non per il loro controllo, data la ridotta capacità attrattiva nei confronti degli adulti. Per cercare di ovviare a questo problema, e per poter disporre di nuove tecniche di controllo, nel 2009 è stato saggiato un formulato sperimentale di un nuovo feromone di aggregazione di produzione spagnola (SEDQ®). La prova è consistita nel confrontare l’efficacia attrattiva dei due feromoni (austriaco e spagnolo), innescando 20 trappole per ciascun formulato. La miscela spagnola si è dimostrata estremamente più attrattiva con un’efficacia circa 7.5 volte superiore a quella del feromone austriaco (Fig. 7), con densità medie di cattura di 250 contro 34 insetti per trappola. La migliore efficacia dei nuovi formulati sperimentali prospetta un possibile impiego dei feromoni non solo nel monitoraggio, ma anche in programmi di controllo basati sulle catture massali, come già avviene in altre specie di scolitidi ([14]).
Fig. 6 - Trappola a feromoni del tipo “ad imbuto” impiegata in Cadore per il monitoraggio delle popolazioni di Ips acuminatus (foto: F. Colombari).
Fig. 7 - Differenze nelle catture medie degli adulti di bostrico acuminato in trappole innescate con feromoni di produzione austriaca e spagnola.
Inoltre, a partire dal 2007 le popolazioni di I. acuminatus sono state monitorate anche mediante raccolta di rami attaccati contenenti stadi di sviluppo dello scolitide. I tronchetti sono stati collocati entro fotoeclettori mantenuti a temperatura ambiente in attesa del completo sviluppo degli insetti e del loro sfarfallamento. I neo-adulti emergenti sono stati raccolti e contati al fine di definire la curva di volo del bostrico acuminato e di eventuali altre specie presenti, nonché la densità dell’insetto per dm2 di corteccia. Le epoche di sfarfallamento e l’entità dei picchi di volo di I. acuminatus sfarfallati dai tronchetti in allevamento corrispondono ai picchi di cattura riscontrati in campo con l’ausilio delle trappole. La maggior parte degli individui sfarfallati si riscontra infatti ad inizio primavera, con un contingente pari a circa 6 individui per dm2 di corteccia infestata nel corso dell’anno precedente, mentre la prole della prima generazione emerge in giugno con un numero molto limitato, pari a meno di un individuo per dm2. Tale ridotto numero sembra dovuto al comportamento monovoltino di una parte della popolazione, che compirebbe un solo ciclo riproduttivo. Lo scortecciamento dei tronchetti colonizzati in primavera ha permesso di appurare che una parte degli insetti di prima generazione rimane effettivamente sottocorteccia fino all’anno successivo senza avviare una seconda generazione.
Prospettive future
Ips acuminatus è una specie comune nelle pinete alpine, ma per molti anni considerata di scarso interesse selvicolturale. Di norma infatti è un insetto secondario in grado di colonizzare alberi la cui capacità di difesa risulta gravemente compromessa da eventi occasionali di origine abiotica (siccità, elevate temperature, incendi, schianti da vento, neve o valanghe) o biotica (forti defogliazioni, intense infezioni fungine - [5]). In questi casi lo xilofago, presente a bassi livelli di popolazione, aumenta rapidamente la propria consistenza numerica dando luogo a pullulazioni spesso aggravate dall’intervento di altre specie. Le elevate densità di popolazione raggiunte consentirebbero poi all’insetto di comportarsi da fitofago primario in grado di colonizzare anche piante apparentemente vigorose.
Nella maggior parte dei casi le infestazioni di I. acuminatus segnalate sul territorio nazionale interessano pinete con prevalente funzione protettiva e paesaggistica; si tratta infatti di boschi situati in aree ad alta frequentazione turistica estiva e invernale. La loro presenza costituisce dunque un elemento insostituibile del paesaggio alpino, che può venire gravemente compromesso dalla presenza di nuclei di piante morte in piedi visibili anche a chilometri di distanza. Tali nuclei sono riconoscibili come macchie dapprima rosse e poi grigie sparse nel manto boschivo di formazioni sempreverdi. Inoltre le pinete di pino silvestre rappresentano spesso formazioni pioniere edificate su ghiaioni di sfaldamento di rocce carbonatiche, ambienti difficili e instabili che non consentono un’agevole evoluzione di suoli e soprassuoli e che sarebbero difficilmente occupabili da altre specie arboree. Si tratta di colonizzazioni spontanee di pendii franosi lasciate crescere senza cure particolari, e che ora si trovano frequentemente esposte ad avversità di natura parassitaria indotte dalle difficili condizioni stazionali e dalla compromessa vigoria degli alberi. In tale sfavorevole situazione vegetativa, gli ormai noti cambiamenti climatici - fra cui il variato ritmo delle precipitazioni, la sempre più breve e sottile copertura nevosa e le crescenti temperature estive ([26]) - possono contribuire ad innescare gravi processi di deperimento. Le recenti anomalie climatiche sembrano infatti avere un ruolo determinante negli equilibri fra piante ospiti e fitofagi ([24]), indebolendo i primi a vantaggio dei secondi o influenzandone profondamente la diffusione, come osservato nel caso di altri parassiti forestali ([2], [3]).
Il contenimento di tali infestazioni può basarsi su tecniche selvicolturali finalizzate al mantenimento delle pinete in buone condizioni vegetative, o sulla progressiva sostituzione di pinete presenti in realtà climatiche ormai non più idonee a soddisfare le esigenze del pino silvestre. In queste situazioni il costante monitoraggio delle popolazioni di I. acuminatus, basato sia sull’impiego di trappole a feromoni che sul censimento dei nuclei d’infestazione, risulta essere un primo fondamentale strumento di supporto decisionale. In considerazione degli elevati costi di realizzo, tagli fitosanitari finalizzati alla rimozione e distruzione del materiale infestato possono trovare giustificazione solo nel caso di rischi di gravi pullulazioni o in formazioni di particolare valore economico, ecologico o paesaggistico, come avvenuto nelle coniferete del Cadore. Ulteriori studi sono tuttora in corso per chiarire le strette relazioni fra pianta ospite, condizioni stazionali, insetto fitofago e organismi ad esso associati in un contesto di protezione delle pinete alpine.
References
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar