Analysis of the seed regeneration process in a Quercus pubescens Willd. coppice in the province of Florence over twenty years after cutting
Forest@ - Journal of Silviculture and Forest Ecology, Volume 9, Pages 39-51 (2012)
doi: https://doi.org/10.3832/efor0687-009
Published: Feb 28, 2012 - Copyright © 2012 SISEF
Research Articles
Abstract
The technical standards and regulations ruling coppicing procedures have been changed in recent years, and they mainly focused on the minimal rotation age of the coppice woodland, on the size and contiguity of area to be coppiced, and on the standard trees. For the latter, the discussion concerned almost exclusively the number, characteristics and spatial distribution of standards whereas the traditionally reported role played by them in term of future gamic regeneration process, as well as the characteristics and dynamics of the long term process itself, is far to be studied and clarified. The objective of this work, carried out in a Quercus pubescens coppice woodland in the province of Florence, Central Italy, is to analyze the dynamics of the population of seedlings since the time of felling in 1980 over the next 20 years. This work examined changes in number of seedlings, the age of seedlings, the development of agamic regeneration. Main results: (a) in about 20 years since felling any of the survived seedling grew to sapling; (b) mortality rate of seedlings was initially very high, gradually decreasing over the years; (c) spatial distribution varies in space and time, and is related to the presence either absence of the standard trees; (d) over the years, there was a severe selection among the coppice stumps and among the coppice shoots, some of which die, without however be replaced by seed-born trees. It emerged the marginal role of the populations of seedlings, both in terms of replacement of died stumps, and in recruitment of the new standards (“allievi”). This conclusion calls into question the term “natural regeneration” by which even in technical either scientific terminology about coppice woodlands often refers to a set of seedlings present, which is theoretically assigned a role that definitively they cannot really play.
Keywords
Coppice, Quercus pubescens , Standard trees, Seed regeneration, Competition
Introduzione
Le norme tecniche e legislative che regolano le modalità di utilizzazione dei boschi cedui hanno subito, negli ultimi anni, numerose modifiche, che rispondono soprattutto alla esigenza di adeguare, per quanto possibile, questa tradizionale forma di uso del suolo a nuove istanze, emerse negli ultimi decenni, relative alla mitigazione di alcuni effetti ritenuti negativi dal punto di vista paesaggistico e idrogeologico ed alla tutela della biodiversità. Le modifiche recepite da gran parte delle legislazioni regionali, hanno interessato, in particolare, il campo di variazione di età in cui è ammesso il taglio di ceduazione (compreso tra il turno “minimo” e l’età alla quale il ceduo è considerato in fase di avviamento all’alto fusto), la dimensione e la contiguità delle tagliate, la matricinatura.
Per quest’ultimo aspetto la discussione si è concentrata soprattutto sul numero delle matricine, soprattutto perché nei decenni a cavallo del XX e XXI secolo, in particolare nelle Regioni dell’Italia centrale, per diverse ragioni (per scarsa conoscenza dei meccanismi biologici, per paura di incorrere in possibili sanzioni, per compiacere l’autorità di turno) è prevalsa nella pratica la tendenza a rilasciare un numero di matricine molto superiore a quanto previsto dalle leggi vigenti, con risultati spesso negativi sullo sviluppo dei nuovi ricacci. ([28], [2], [3], [20], [39], [16]).
Per quanto concerne la rinnovazione, è opinione comune che questa sia funzione primaria delle matricine, benché Zanzi Sulli & Di Pasquale ([44]) e Zanzi Sulli ([45]) abbiano verificato che in letteratura l’assegnazione di questo ruolo compare solo dalla metà del XX secolo.
Per quanto riguarda l’origine, se è vero che si parla genericamente e cautelativamente di “preferenza” per le piante da seme ([38], [9], così come la maggior parte dei regolamenti forestali emanati dalle Regioni italiane), l’origine gamica viene comunque indicata come il primo criterio di scelta, anche se spesso viene osservata l’origine agamica della maggior parte delle matricine ([10]).
Viene, quindi, implicitamente dato per scontato che il processo che prevede, in successione, la produzione di seme, la germinazione, la nascita dei semenzali e il successivo passaggio al portamento arboreo avvenga nel volgere di un turno e che, in definitiva, nei boschi cedui ci sia una rilevante presenza di piante nate da seme; le migliori di esse dovrebbero essere scelte come “allievi” al momento della ceduazione, mentre di quelle che restano non si sa quale sia il destino, considerando che, anche quando si pensa alla sostituzione di ceppaie esauste, spesso si presume che questo avvenga dopo una fase di allevamento della pianta ad alto fusto e successiva ceduazione ([6]).
In realtà alcuni studi condotti in campo negli ultimi decenni sia in Italia ([25], [26], [17]) che all’estero ([31], [14], [33], [15], [43], [18], ecc.) hanno evidenziato come il processo di rinnovazione da seme nei cedui sia tutt’altro che scontato, e che già la prima fase di passaggio dallo stato di semenzale a quello di sapling (piante con diametro basale di almeno 1 cm e con diametro a petto d’uomo DBH ≤ 3 cm, così come definite da [41]), sia un evento estremamente raro.
L’obiettivo di questo lavoro è l’analisi del processo di sviluppo dei semenzali durante un periodo pari, o leggermente superiore) a quello di un turno consuetudinario, verificando il ruolo e le possibilità di affermazione della rinnovazione da seme. Lo studio è iniziato nel 1980 in un ceduo di roverella, dopo l’utilizzazione, e si è protratto fino al 2002.
Materiali e Metodi
Area di studio
Il bosco ceduo in cui è stato condotto lo studio si trova nel versante sud di Poggio delle Carpinete, nei pressi dell’abitato delle Sieci, Comune di Pontassieve, provincia di Firenze (UTM 32T 692947 E, 4852600 N). Il bosco si trova ad una quota compresa tra i 200 ed i 300 m s.l.m., e fa parte delle proprietà della Fattoria di Poggio a Remole. Il trattamento a ceduo di questi boschi con turni brevi (dai 9 agli 11 anni) è documentato fino alla metà del XX secolo da Piussi ([37]). Il substrato è calcareo-marnoso, il suolo poco profondo con rocce affioranti, la pendenza intorno al 25%. Il tipo di bosco può essere ricondotto al querceto mesotermofilo di roverella. In base alla classificazione fitoclimatica di Pavari, la zona può essere ascritta al Lauretum freddo.
Il ceduo fu utilizzato nell’inverno 1979-80. Al momento del taglio vennero rilasciate circa 100 matricine ad ettaro, che determinavano una copertura del 15%. Nel mese di aprile 1980, prima ancora che le ceppaie iniziassero a ricacciare, è stata definita un’area di saggio (Area A) di 360 m2 (60 x 6 m, con lato maggiore disposto lungo la curva di livello). Una parte dell’area (64 m2) venne esclusa dallo studio perché condizionata dalle operazioni di esbosco e accatastamento della legna; la superficie si ridusse così a 284 m2. Successivamente l’area è stata delimitata sul terreno con una serie di picchetti posti ai vertici di una maglia di 1 m di lato, che ha permesso la suddivisione in unità elementari di 1 m2 di superficie.
Rilievi sulla popolazione di semenzali
Lo schema generale rilievi sui semenzali è riassunto in Tab. 1.
Tab. 1 - Schema dei rilievi.
| Anno | Età polloni | Num. semenzali | Altezza semenzali | Superficie interessata dai rilievi |
|---|---|---|---|---|
| 1980-1983 | 1-4 | SI | NO | intera area A (284) m2 |
| 1984-1986 | 5-7 | SI | NO | sottoarea A1 (m2 60) |
| 1993 | 14 | SI | SI | sottoarea A1 (m2 60) |
| 1998 | 19 | SI | SI | sottoarea A1 (m2 60)sottoaree M1-3 e P1-3 (m2 10x6 aree) |
| 2002 | 23 | - | - | Età del fusto e della radice di un campione di semenzali |
Dal 1980 al 1984 è stato effettuato, a cadenza annuale, il conteggio dei semenzali di roverella presenti in tutta l’area, tenendo separati i dati di ciascun quadrato di 1 m2 di superficie. Negli anni 1985, 1986, 1993 e 1998 il conteggio è stato limitato ad una parte omogenea dell’intera area (di seguito definita A1) di 60 m2 (10 x 6 m) in cui, durante gli ultimi due rilievi (1993 e 1998), è stata misurata anche l’altezza di tutti i semenzali presenti. Per le analisi statistiche è stato utilizzato il test χ2 e l’analisi della varianza.
Basandosi sui rilievi del primo anno, nel 1998 (all’interno dell’intera area A) sono state individuate 6 subaree di 10 m2 ciascuna, in 3 delle quali cui, nel 1980, era stata rilevata una densità di semenzali molto superiore alla media (indicate rispettivamente con M1, M2, M3) ed altre 3 in cui, viceversa la densità era molto bassa (P1, P2, P3). In queste 6 sottoaree è stata effettuato nell’estate 1998 un rilievo sui semenzali (numero e altezza) per verificare i cambiamenti avvenuti nel corso del tempo.
Dal 1981 al 1985 è stato inoltre monitorato lo sviluppo dei ricacci delle ceppaie, mediante misura dell’altezza del pollone più alto per ogni ceppaia e della proiezione orizzontale della chioma di ciascuna ceppaia, preventivamente numerata e rilevata topograficamente.
Età del fusto e della radice
Nel 2002 sono state effettuate misurazioni e stime dell’età del fusto e della radice su un campione di 40 semenzali, prelevati appena al di fuori dell’area di saggio. I semenzali sono stati scelti in relazione all’altezza degli stessi, in modo che il campione fosse rappresentativo della distibuzione delle altezze rilevata nel corso dell’ultimo rilievo.
La stima dell’età del fusto e della radice è stata effettuata mediante conta degli anelli sezionando gli assi e utilizzando uno stereoscopio con ingrandimenti diversi (8x, 16x, 40x). Per il fusto è stata effettuata una verifica contando le cicatrici dei getti annuali.
Risultati
Densità di semenzali
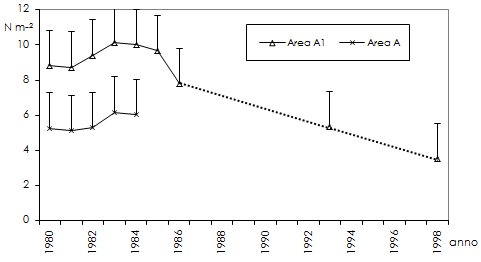
Il grafico rappresentato in Fig. 1 riporta le variazioni della densità di semenzali (N m-2) rilevata nell’area A (superficie = 284 m2, serie dal 1980 al 1984), all’interno della sottoarea A1 (parte dell’area A, superficie = 60 m2).
L’andamento osservato dal 1980 al 1984 è simile nelle due aree, anche se i valori registrati nell’area A1 sono superiori a quelli dell’intera area A. Nella sottoarea A1, che ha una superficie pari al 21% dell’intera area censita, nei primi 4 anni è stato contato un numero di semenzali che ha oscillato dal 35 al 37% dei semenzali censiti in tutta l’area.
Nel 1980, durante il primo rilievo effettuato dopo la ceduazione, nell’area A sono stati contati 1496 semenzali, corrispondenti ad una densità di 5.3 ± 7.3 sem. m-2. Durante i primi 5 anni il numero totale ha oscillato tra 1452, (5.1 ± 7.2 sem. m-2) nel 1981 e 1754, (6.2 ± 7.6 sem. m-2) nel 1983, anno in cui si è raggiunta la massima densità, frutto della pasciona dell’anno precedente.
Esaminando i dati ricavati nella sottoarea A1, si osserva un andamento del tutto analogo a quello registrato nel totale dell’area per i primi 5 anni: i valori medi sono passati da 8.8 ± 9.7 sem. m-2 del 1980 a 10.1 ± 8.1 nel 1984. nell’area A1 il numero massimo di semenzali è stato trovato nel 1983 (10.2 ± 6.2 sem. m -2).
Dal 1983 in poi si registra una costante diminuzione del numero. Nel 1993 la densità nell’area A1 era quasi dimezzata rispetto al 1983 (5.3 sem. m-2 contro 10.2) e la tendenza si è accentuata nel 1998, quando si sono registrati in assoluto i valori minimi di densità con 3.6 sem. m-2
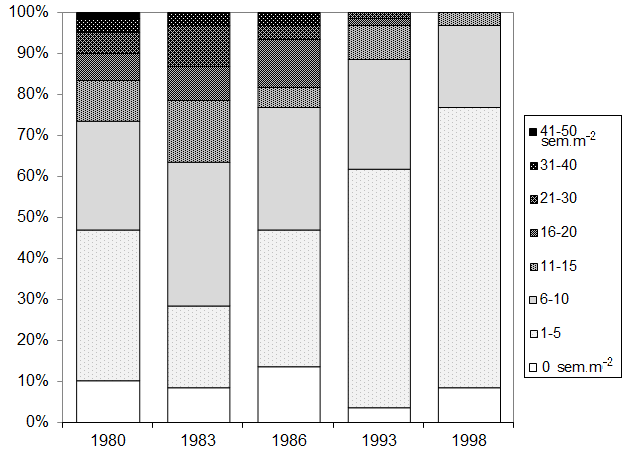
La densitàè risultata non omogenea nell’area A già nel 1980: assenza di semenzali nel 21% delle unità elementari di 1 m2; una densità di semenzali inferiore a 5 sem. m-2 sul 61% della superficie mentre in altre parti dell’area di studio la densità risultava molto elevata (N > 20 sem. m-2 sul 12% della superficie).
Nel corso degli anni si è potuto osservare che, in conseguenza della diminuzione del numero totale, è diminuita la frequenza delle unità minime di rilievo (quadrati di 1 m di lato) con forte dotazione di semenzali (Fig. 2), ed il valore massimo di densità osservato su un quadrato (50 sem. m-2 nel 1980 e solo 12 nel 1998) mentre non si registrano differenze significative relativamente alla frequenza di quadrati privi di semenzali (χ2 [4] = 3.027; n.s.).
Confronto tra zone omogenee
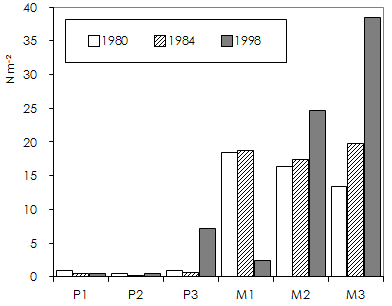
Il confronto tra i valori osservati in sei parti dell’area, di 10 m2 ciascuna, in 3 nelle quali nel 1980 la densità di semenzali era molto bassa (aree “povere” P1, P2, P3) e 3 (M1, M2, M3) in cui, al contrario, nel 1980 la densità era alta, ha dato risultati contrastanti (Fig. 3):
- in 2 aree “povere” (P1 e P2) la situazione è rimasta pressoché invariata, con valori medi al di sotto di 1 sem. m-2 e un massimo di 4 sem. m-2; nell’area P3, dove la densità era ancora scarsa nel 1984, nel 1998 si è osservata una densità molto più alta, che ha portato i valori medi da 1 a 7.2 sem. m-2 con densità massima passata da 2 a 19 sem. m-2;
- in 2 aree “ricche” (M2 e M3) nel 1998 la densitàè risultata sensibilmente superiore a quelle registrate sia nel 1980 che nel 1984, in particolare nell’area M3, con valori medi passati dai 14 sem. m-2 nel 1980 ai 38 sem. m-2 nel 1998 (l’unità di 1 m2 che ha registrato il massimo incremento è passata da 23 sem. m-2 nel 1980 a 73 sem. m-2 nel 1998). Nell’area M2, invece, la densitàè passata dai 16.3 sem. m-2 del 1980 ai 24.7 sem. m-2 del 1998 mentre nell’area M1, che era quella che nel 1980 presentava i valori medi più alti (18.4 sem. m-2) si è registrato un aumento nel 1984 e successivamente un crollo che ha ridotto i valori medi a 2.4 sem. m-2, con un massimo di 5 sem. m-2 (contro i 42 del 1980!).
Sia l’area M2 che la M3 si trovano per gran parte della superficie sotto la proiezione delle chiome di una matricina di più turni, rilasciata nel 1980. In prossimità dell’area M1, in cui si è registrata la diminuzione più forte, nel 1980 al momento della ceduazione è stata tagliata una matricina di più turni responsabile, presumibilmente, dell’abbondanza di semenzali.
Nella Tab. 2 sono riportati i risultati dei rilievi del 1998 ed il confronto con il numero osservato nei primi anni dopo il taglio. Si può notare che le aree P hanno altezze medie leggermente superiori rispetto alle aree M (ANOVA: F[1.734] = 4.75; p < 0.03), mentre la situazione complessiva sembra leggermente migliore per le aree M, considerando sia il numero di semenzali che l’altezza del semenzale più alto. Si tratta tuttavia di valori molto bassi e le differenze, se pur statisticamente significative, non sono tali da produrre reali differenze in campo.
Tab. 2 - Densità e altezza dei semenzali nelle subaree P ed M. Rilievo del 1998 e confronto con i primi anni successivi al taglio.
| Subarea | Numero semenzali (m-2) | Altezza nel 1998 (cm) | |||||
|---|---|---|---|---|---|---|---|
| 1980 | 1982 | 1984 | 1998 | media | minima | massima | |
| P1 | 1 | 1 | 0.7 | 0.5 | 19.4 | 10 | 33 |
| P2 | 0.5 | 0.5 | 0.1 | 0.5 | 12.6 | 8 | 16 |
| P3 | 0.9 | 0.5 | 0.7 | 7.2 | 13.6 | 5 | 56 |
| tot P | 0.8 | 0.7 | 0.8 | 2.7 | 13.9 | - | - |
| M1 | 18.4 | 20.2 | 18.8 | 2.4 | 14.5 | 8 | 28 |
| M2 | 16.3 | 16 | 17.4 | 24.7 | 14.1 | 5 | 44 |
| M3 | 15.2 | 14.2 | 20.7 | 38.4 | 11.4 | 5 | 43 |
| tot M | 16.6 | 16.8 | 19 | 21.8 | 12.5 | - | - |
Altezza dei semenzali
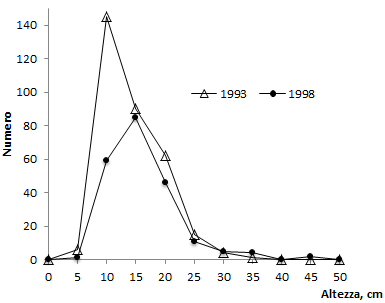
Nel 1993 l’altezza media dei 321 semenzali presenti nell’area A1 era di 12.6 cm (SD = 4.29 cm, Hmax = 35 cm), mentre 5 anni dopo, nel 1998, l’altezza media era di 14.2 cm (N = 231, SD = 3.06 cm) che, pur essendo la differenza della media delle altezze statisticamente significativo (ANOVA: F[1.534] = 11.39; p < 0.0008), non costituisce un cambiamento reale della situazione: nessun semenzale ha portamento ed altezza tali da poter essere considerato affermato o, comunque nessuno è in condizione di competere con i polloni e neppure con le poche piante da seme di orniello, nate dopo la ceduazione del 1979. Il semenzale più alto trovato nell’area A1, nel 1993 misurava infatti 35 cm, quello più alto nel 1998 era alto 45 cm (non è possibile sapere se si tratti dello stesso oppure di un altro semenzale non essendone stata registrata la posizione sul terreno). In tutti questi casi, e in generale per tutti i semenzali più sviluppati, il portamento è accestito senza getti con chiara dominanza apicale.
L’esame della distribuzione delle frequenze, per classi di altezza di 5 cm (Fig. 4) evidenzia una prevalenza di individui di piccola dimensione (classe modale: 10 cm nel 1993 e 15 cm nel 1998) ed una sostanziale coincidenza delle due spezzate dalla classe 15 cm in poi.
Il tipo di rilievo effettuato non ci permette di affermare con certezza se la mortalità, che pure è un dato certo, ha interessato i semenzali più piccoli o quelli appartenenti nel 1993 alle classi di altezza maggiore, con passaggio di quelli piccoli alle classi intermedie. Le osservazioni in campo dei semenzali, ed in particolare i modesti incrementi longitudinali osservati, fanno tuttavia pensare che l’aumento dell’altezza media dal 1993 al 1998 sia dovuto più alla scomparsa di semenzali di piccola dimensione che all’incremento in altezza dei più alti del 1993.
Esame dendrocronologico del campione di semenzali
L’esame del campione di semenzali esaminati in laboratorio nel 2002, ha evidenziato nella maggior parte dei casi una differenza, anche notevole, tra l’età dell’apparato radicale nella parte prossima al colletto e quella del fusto.
Quasi il 65% dei semenzali è costituito in realtà da ricacci (microceppaie o seedling sprouts); si tratta cioè di semenzali il cui fusto é morto (die back), una o più volte, e che hanno ricacciato dal colletto.
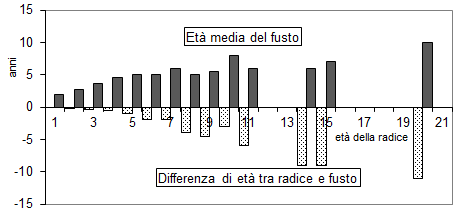
Nel campione esaminato, in base agli anelli contati sulle sezioni delle radici emerge un campo di variazione di età da 2 a 21 anni, mentre l’età del fusto varia da 1 a 12 anni, senza apparente relazione con l’età dell’apparato radicale, cosa per altro abbastanza logica considerando le diverse cause che possono aver determinato i fenomeni di die-back.
La differenza di età tra parte ipogea ed epigea tende ad aumentare con l’età della radice (Fig. 5). È interessante rilevare che tutti i semenzali il cui apparato radicale ha un’età superiore a 8 anni presentano un differenziale di età tra la radice e il fusto e che solo tra quelli di 2 anni non si registrano differenze, segno evidente che il fenomeno osservato (formazione di microceppaie) rappresenta il caso più comune, come rilevato anche da Johnson et al. ([24]) in boschi di diverse specie quercine statunitensi.
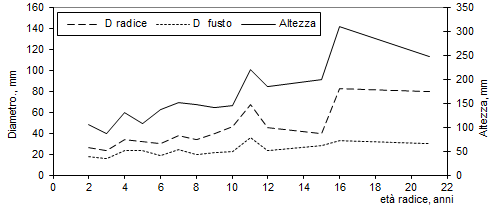
Altri parametri quali il diametro della radice, il diametro e l’altezza del fusto sono positivamente correlati tra loro (Tab. 3). La stessa tendenza si nota osservando la Fig. 6, che evidenzia, comunque, piccole variazioni all’aumentare dell’età della radice.
Tab. 3 - Matrice di correlazione tra diametro della radice (Drad), diametro (Dsem) e altezza dei semenzali (Hsem). (): coefficiente di correlazione di Pearson; (SD): deviazione standard; (b): coeffinciente angolare regressione; (Int): intercetta regressione.
| Var. X Var. Y |
N | Media, cm | Dev Std | (X,Y) | 2 | t | Prob. | Int (dip. Y) |
(dip. Y) | Int (dip. X) |
(dip. X) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Hsem
Dsem |
40 | 14.9 2.23 |
5.764 0.69 |
0.604 | 0.365 | 4.676 | .000036 | 1.1547 | 0.072 | 3.618 | 5.048 |
| Hsem
Drad |
40 | 14.9 39.3 |
5.764 17.299 |
0.750 | 0.562 | 6.989 | .000000 | 5.762 | 2.251 | 5.080 | 0.250 |
| Dsem
Drad |
40 | 2.23 39.3 |
0.69 17.299 |
0.694 | 0.482 | 5.938 | .000001 | 0.430 | 17.392 | 1.147 | 0.028 |
La popolazione di semenzali che non ha mai subito la morte della parte aerea e che non ha ricacciato (true seedlings) o costituita da microceppaie (seedling sprouts), definita globalmente come seedling bank da Grime ([19]), sembra quindi formata da semenzali che sopravvivono per diversi anni, subendo (anche ripetutamente e periodicamente) la morte della parte aerea e ricacciando dal colletto grazie alla grande quantità di gemme dormienti presenti ([8], [27]).
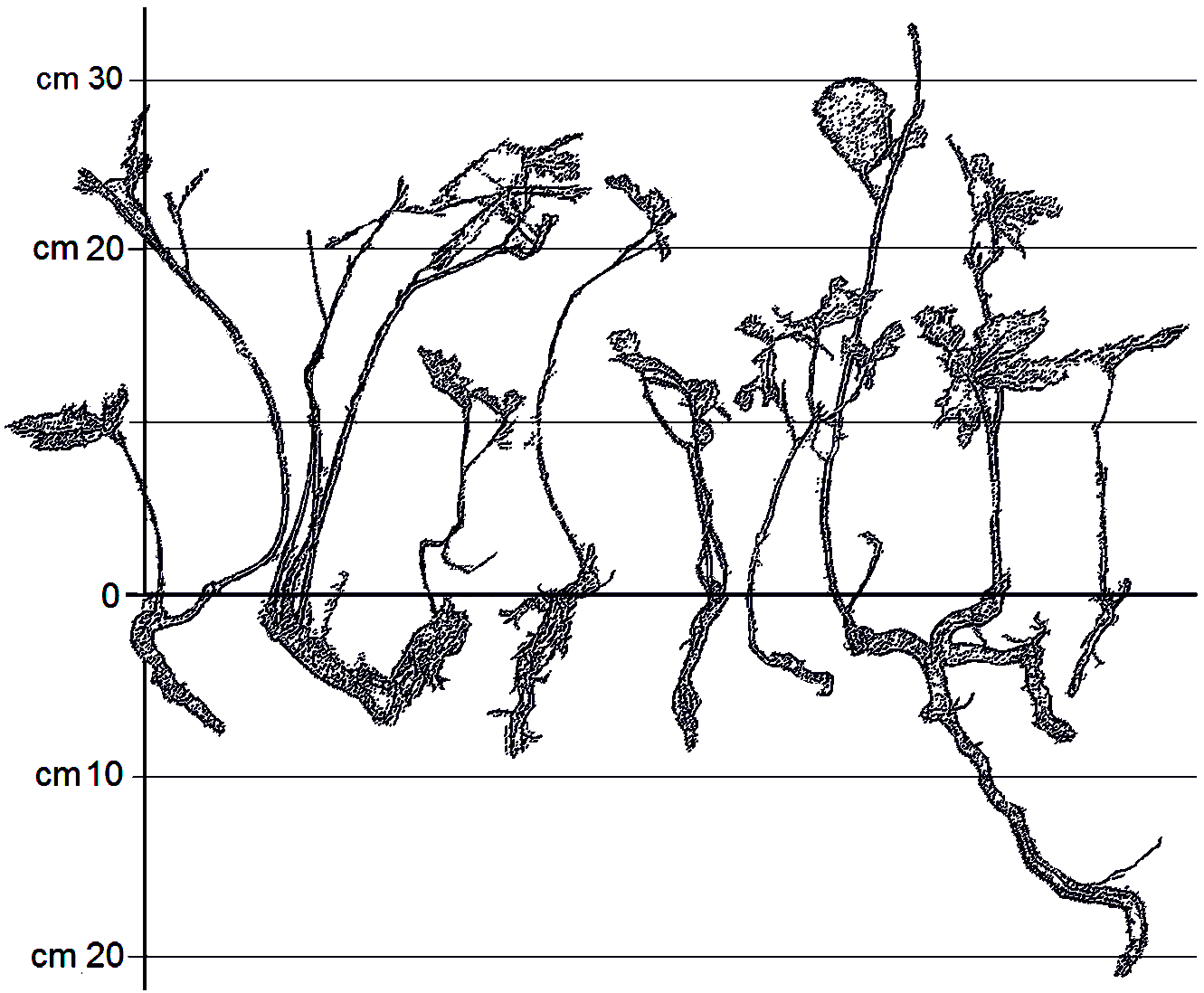
Il ripetersi di questo meccanismo di die-back e ricaccio determina, in molti casi, la formazione di un apparato radicale molto sviluppato (Fig. 7).
Rilievi sulla componente a ceduo
I dati rilevati nel 2002 evidenziano una densità di circa 2000 ceppaie ad ettaro, di cui il 62.3 % di roverella e il 37.7 % di orniello, a cui si devono aggiungere circa 100 matricine ad ettaro.
L’area basimetrica totale è di circa 19.2 m2 ad ettaro. Rispetto ai primi rilievi del 1982 si evidenzia una forte mortalità di ceppaie, soprattutto di roverella (41%), tuttavia la copertura delle chiome delle ceppaie del piano dominate e delle matricine è pressoché totale. La copertura del suolo è inoltre completata dal piano inferiore, composto da ginepro comune, ligustro e orniello, quest’ultimo presente con numerosi individui da seme nati dopo la ceduazione. Lo strato erbaceo-arbustivo è composto da Ruscus aculeatus, Edera helix, Rubia peregrina, graminacee.
Durante i primi rilievi sulle ceppaie, dal 1982 al 1986, era stata rilevata l’altezza del pollone dominante per ciascuna ceppaia. La Tab. 4 riporta i valori di altezza media dei polloni dominanti delle ceppaie nei primi anni dopo il taglio (a 3, 5 e 7 anni) in relazione alla attuale posizione sociale delle ceppaie, comprese quelle morte nel corso del turno. Il confronto, se da un lato evidenzia differenze già molto marcate nei primi anni, dall’altro mostra che le ceppaie che in seguito sarebbero morte per effetto della concorrenza presentavano un trend di sviluppo in altezza del tutto simile a quello delle ceppaie arrivate vive a fine turno, a prescindere dalla posizione sociale raggiunta, anche se su valori più bassi.
Tab. 4 - Differenziazione precoce dei polloni. Altezza media dei polloni dominanti (HD, in cm) a 2, 4 e 6 anni di età delle ceppaie di roverella in diversa posizione sociale nel 2002. Risultato ANOVA e test HSD.
| PS2002 | N | HD 1982 |
HD 1984 |
HD 1986 |
|---|---|---|---|---|
| Dominanti | 30 | 216 a | 369 a | 510 a |
| Codominanti | 12 | 206 a | 362 ab | 511 ab |
| Dominate | 24 | 154 b | 295 b | 400 b |
| Morte | 55 | 123 c | 206 c | 281 c |
| ANOVA F | - | 31.314 | 21.097 | 22.218 |
| Prob. | - | <0.001 | <0.001 | <0.001 |
Nel 1986, a 7 anni di età, 54 delle ceppaie di roverella morte nel corso degli anni, erano vive e presentavano un’altezza media dei polloni dominanti di circa 2.8 metri, poco più della metà dell’altezza media raggiunta dai polloni delle ceppaie dominanti e codominanti, quindi insufficiente a garantire la competizione con le ceppaie dominanti (come dimostrerà la sorte di queste ceppaie) ma comunque di gran lunga superiore all’altezza massima raggiunta dai semenzali.
Discussione
Nel corso del lavoro è stata seguita l’evoluzione della popolazione di semenzali in un ceduo di roverella, partendo da quella presente in bosco immediatamente dopo l’utilizzazione del 1980.
Questa componente, nei boschi di quercia, è costituita da veri e propri semenzali nati in diversi periodi e da microceppaie (seedling sprouts), ovvero semenzali che hanno subito di fatto una sorta di ceduazione. Secondo Johnson et al. ([24]), la struttura cronologica risulta dagli effetti combinati di: (i) periodicità di abbondante produzione di seme; (ii) grande quantità di sostanze di riserva presente nelle ghiande, che consente una buona sopravvivenza del semenzale durante il primo anno; (iii) forte capacità di ricaccio dei semenzali; (iv) tolleranza dell’aridità dei semenzali; (v) capacità di persistenza in condizioni di moderata illuminazione.
L’evoluzione di questa popolazione può essere esaminata sia dal punto di vista della consistenza numerica che da quello dell’accrescimento e dello sviluppo dei semenzali.
Un primo risultato che emerge dal presente lavoro, a circa 20 anni dal taglio di ceduazione, è una dotazione di semenzali minore di quella osservata immediatamente dopo il taglio, per effetto di una diminuzione pressoché costante a partire dal quarto anno dopo il taglio. Una mortalità ancora più elevata (85%) è stata osservata da La Marca et al. ([25]) in un ceduo di cerro di 14 anni. Diversi altri lavori hanno evidenziato, per diverse specie quercine, una diminuzione forte del numero di semenzali nei boschi cedui: Matsuda ([31]) per Q. serrata in Giappone, La Marca et al. ([26]) per Q. ilex in Puglia.
Il numero di semenzali presenti al momento del taglio può dipendere da una serie di fattori concomitanti, e in certi casi casuali. Bobinac ([5]) rileva che la ottimale sincronizzazione tra fruttificazione e taglio, ai fini della presenza di semenzali, si ottiene quando la germinazione delle ghiande avviene immediatamente dopo la eliminazione delle chiome (la ceduazione, nel nostro caso).
La variazione numerica osservata nel corso degli anni, così come l’esame di quelle zone omogenee per densità che si caratterizzavano nel 1980 per essere tra le più ricche e le più povere di semenzali, fanno pensare che la diminuzione possa essere dovuta anche ad una scarsità di nuove nascite, che non compensano la mortalità. Durante l’utilizzazione alcune matricine sono state tagliate, mentre gli allievi selezionati, ad un’età di 18 anni, non potevano certo avere la stessa produzione di seme delle matricine eliminate.
Tra le condizioni favorevoli alla disponibilità di seme può essere ricordato l’effetto positivo sulla fruttificazione indotto dall’isolamento e dalla conseguente maggiore illuminazione delle chiome delle matricine ([29]).
Bigotti ([4]), in un ceduo di cerro in provincia di Perugia, ha osservato l’effetto positivo dell’isolamento delle chiome sulle dimensioni delle ghiande prodotte dalle matricine già nell’anno successivo al taglio. Secondo Jarvis ([22]), in Q. pubescens ghiande più grosse danno origine a semenzali più vigorosi, mentre Ashton & Larson ([1]), in uno studio su Quercus coccinea, Q. rubra e Q. velutina condotto in USA hanno osservato che la capacità di germinazione è poco influenzata dalle condizioni stazionali proprio per l’alta quantità di sostanze di riserva contenute nelle ghiande.
Siamo in presenza quindi di un flusso di seme in entrata che probabilmente non compensa la fisiologica mortalità (ogni anno un certo numero di semenzali muore), e che può spiegare una diminuzione del numero di semenzali che avviene negli anni successivi.
Negli ultimi anni non si può escludere l’effetto della predazione del seme da parte di ungulati, così come la brucatura di semenzali da parte di caprioli, mentre nei primi anni dopo il taglio gli ungulati selvatici non erano presenti in questi boschi.
La distribuzione del numero di semenzali per unità di rilievo (quadrati di 1 m di lato) è assai variabile, passando dall’assenza totale di semenzali a valori di oltre 50 sem. m-2 rilevati nel 1980 che coincidono quasi sempre con l’area di incidenza delle matricine del vecchio turno, alcune delle quali tagliate durante le utilizzazioni. Si nota anche una spiccata variabilità nel tempo per cui zone ricche di semenzali nel 1980 ne presentavano pochissimi nel 1998 e viceversa. Una spiccata variabilità nella distribuzione di semenzali è stata rilevata anche da Gracia et al. ([18]) in un ceduo di leccio del nord-est della Spagna.
Numerose possono essere le cause che spiegano questa dinamica. Per quanto riguarda i primi anni dopo il taglio, in cui si è potuto osservare un contenuto aumento, si può pensare che l’eliminazione di gran parte della copertura delle chiome può aver favorito la sopravvivenza dei semenzali, grazie alla maggiore quantità di luce che giunge al suolo, che tende a diminuire man mano che le chiome dei polloni vanno a formare un piano continuo di copertura.
La più probabile causa di mortalitàè individuabile nella concorrenza esercitata sia dai ricacci che dalla vegetazione erbacea.
L’accrescimento dei polloni già dal primo anno è sicuramente molto superiore a quello dei semenzali; i polloni, nei primi anni dopo il taglio, hanno generalmente più flussi di accrescimento nel corso della stagione vegetativa e raggiungono in breve altezze al di fuori della portata dei semenzali, mentre l’accrescimento dei semenzali durante il primo anno, in condizioni di concorrenza e di stress idrico (comuni sotto copertura forestale) avviene per un breve periodo, nel quale il semenzale raggiunge una altezza di una quindicina di cm. L’accrescimento cessa e non riprende prima dell’anno successivo ([24]).
Hodges & Gardiner ([21]), in una rassegna sulle querce nordamericane, rilevano che la mancanza di luce diviene un possibile fattore limitante allo sviluppo dei semenzali quando terminano le riserve cotiledonari e le giovani piantine devono sopravvivere grazie ai fotosintati prodotti dalle nuove foglie.
Crow ([13]), osserva che e la sopravvivenza dei semenzali di Q.rubra diminuisce all’aumentare della densità del piano superiore (92 % all’aperto, 54 % con copertura incompleta e 36 % con copertura completa), così come l’accrescimento in altezza.
Secondo Montgolfier ([33]), in cedui di roverella, un certo grado di copertura è necessario per la germinazione, ma poi impedisce lo sviluppo dei semenzali e ne provoca il deperimento.
Tonioli et al. ([42]) ritengono che la competizione con la vegetazione erbacea riduca la biomassa fogliare di semenzali di roverella ma non ne aumenti la mortalità: la vegetazione presente potrebbe giocare un ruolo positivo di facilitazione durante la germinazione, e negativo (a causa della competizione) durante il periodo di crescita.
L’altezza media dei semenzali presenti nell’area A quasi 20 anni dal taglio era di circa 15 cm; il semenzale più alto, rilevato durante i rilievi eseguiti nel 1998, raggiungeva una lunghezza del fusto di poco più di 50 cm, per altro con portamento prostrato e con diametro del fusto di pochi millimetri, e il 95% dei semenzali aveva un’altezza inferiore ai 30 cm.
Collet & Frochot ([11]) affermano inoltre che la forte competizione determina, in semenzali di Q. petraea e di Q. robur, un minor numero di flussi di accrescimento, e di conseguenza un minore accrescimento in altezza. Relativamente a questo aspetto, Crow ([12]) segnala una forte differenza del numero di flussi di accrescimento annui, e conseguentemente di altezza, tra semenzali di Q. rubra presenti in bosco, che presentano generalmente un solo flusso di accrescimento, e quelli allevati in vivaio (6-8 flussi annui con altezze di 1.5-2 m).
Già oltre un secolo fa, Vittorio Perona ([35]) affermava che “sotto le matricine nascono non pochi semenzali, ma, a cagione dell’aduggiamento molto forte dei polloni circostanti, quasi sempre tendono a scomparire”; e successivamente, parlando del metodo della piantagione (oggi desueto) per rinfoltire i cedui, consiglia di effettuare nelle piccole radure la piantagione 3-4 anni prima del taglio del ceduo perché “facendola dopo e servendosi del postime ordinario, esso verrebbe ben tosto sopraffatto dai novelli polloni delle ceppaie vicine, che crescono molto più rapidamente, e tornerebbe a scomparire”. E’ difficile quindi ipotizzare una sorte migliore per semenzali nati in bosco.
E’ stato inoltre rilevato ([18]) che le operazioni di utilizzazione ed esbosco possono provocare danni alle piantine, ed in particolare l’accumulo di ramaglia sul terreno può provocare la morte dei semenzali. Nel nostro caso quest’ultima eventualità deve essere esclusa, dal momento che la ramaglia è stata asportata, e questo può anche spiegare le differenze rilevate con altri lavori citati in questo lavoro, in cui la diminuzione del numero di semenzali è più forte fin dai primi anni.
La stima dell’età effettuata nel presente lavoro su un campione di semenzali a circa 20 anni dal taglio indica la grande capacità di sopravvivenza dei semenzali i quali, anche dopo la morte della parte aerea (die back) ricacciano, andando così a costituire una microceppaia (seedling sprouts). Secondo Johnson ([23]), questa rappresenta la tipologia di plantule più comune nei boschi cedui di quercia, mentre McDonald & Tappeiner ([32]) sostengono che questo meccanismo di die-back e ricaccio può avvenire in qualsiasi momento e sia per i motivi più prevedibili (freddo, siccità, brucature) sia per altri motivi sconosciuti, ed è estremamente comune nelle querce americane, tanto che sembra che non possano evidenziarsi relazioni certe tra dimensioni del fusticino ed età del semenzale.
La popolazione di semenzali, sembra quindi formata da semenzali che sopravvivono per diversi anni, subendo (anche ripetutamente e periodicamente) la morte della parte aerea e ricacciando dal colletto grazie alla grande quantità di gemme dormienti presenti ([8], [27]), cosa che determina la formazione di un apparato radicale molto sviluppato.
Secondo Gracia et al. ([18]), in boschi di leccio, la popolazione di semenzali rappresenta una riserva di “oskar” che non crescono e non hanno alcun evidente ruolo nella dinamica forestale (Oskar è il nome del protagonista del romanzo di Günter Grass “Il tamburo di latta”, che per 25 anni decide di non crescere non superando mai la statura di un bambino di 3 anni).
Nell’area oggetto del presente studio, a oltre 20 anni dal taglio, nessun semenzale di roverella (o di altre specie quercine) è riuscito ad affermarsi, vale a dire a raggiungere dimensioni e portamento tali da poterne prevedere la collocazione nel piano arboreo nel breve periodo (nel ciclo attuale del ceduo o in uno successivo per effetto di una eventuale ceduazione) e, in subordine, nessuna di queste piantine nate da seme potrebbe essere presa in considerazione nel futuro reclutamento di matricine.
Negli ultimi anni non si può escludere l’effetto della predazione del seme a terra da parte di ungulati, mentre nei primi anni dopo il taglio gli ungulati selvatici non erano presenti in questi boschi. Non sono stati tuttavia osservate molte tracce di brucatura, che su piante in via di affermazione sarebbero facilmente individuabili. L’eventualità della sparizione totale è tuttavia possibile per giovani semenzali - segnalata ad esempio da Motta ([34]) per semenzali di sorbo degli uccellatori sulle Alpi -, benché numerose osservazioni, sia pure in ambienti diversi, abbiano mostrato che spesso i semenzali di specie quercine sono meno appetiti dagli animali selvatici, in particolare quando è presente una consistente offerta alimentare alternativa, anche perché la brucatura quasi sempre limitata a getti recenti e non lignificati ([7]) ed il periodo in cui i getti sono maggiormente appetiti è molto breve.
Conclusioni
Dal lavoro emergono alcuni risultati di particolare interesse:
- nei circa 20 anni trascorsi dal taglio di ceduazione non si è verificata l’affermazione di alcun semenzale, né di roverella né di altre specie;
- si osserva una elevata mortalità dei semenzali, il cui numero è andato progressivamente decrescendo nel corso degli anni, pur in presenza di semenzali molto longevi, microceppaie (seedling sprouts) e la nascita di nuove plantule;
- la distribuzione spaziale varia nello spazio e nel tempo, in particolare in relazione alla presenza di matricine;
- nel corso degli anni ha luogo una forte selezione anche tra le ceppaie, alcune delle quali muoiono, senza essere tuttavia rimpiazzate da piante da seme.
I risultati di queste osservazioni, pur avendo abbracciato una arco temporale molto lungo, non possono certamente essere generalizzati, essi tuttavia permettono di fare alcune considerazioni dal momento che nel bosco studiato non si sono verificati fatti inusuali che possano aver condizionato in modo anomalo il processo di reclutamento di nuovi individui da seme.
In un bosco ceduo gestito secondo le attuali modalità (ovvero senza quella serie di operazioni che venivano effettuate comunemente fino a cinquant’anni fa: taglio del sottobosco, diradamento dei polloni, asportazione della ramaglia residua dal taglio o di rami secchi e di lettiera), le condizioni di vegetazione dei semenzali sono nettamente sfavorevoli rispetto a quelle dei polloni.
Questi ultimi, grazie all’apparato radicale delle ceppaie, in qualche modo “sovradimensionato” rispetto alla parte epigea, riescono ad avere fin dai primi anni incrementi di altezza molto superiori a quelli dei semenzali, a cui si deve aggiungere la capacità di occupare lo spazio per effetto del gran numero di polloni che vengono emessi: le chiome delle ceppaie riescono nell’arco di pochi anni (in relazione alla fertilità, alla specie, ecc.) a determinare una copertura quasi totale del terreno. Con il passare degli anni la concorrenza produce una forte selezione tra i polloni e tra le ceppaie, di cui non riescono ad approfittare i semenzali perché la morte dei polloni sopravviene generalmente dopo una fase di regressione sociale e non crea spazi vuoti tra le chiome.
Da ciò ne consegue che semenzali di 20-30 cm di altezza, benché già presenti al momento del taglio hanno poche possibilità di competere con i polloni; una miglior sorte forse potrebbero avere piantine da seme che avessero altezze almeno superiori al metro al momento del taglio del ceduo, anche se dovrebbero superare indenni le operazioni connesse all’utilizzazione, non potendo sperare di essere selezionate (e quindi risparmiate) come allievi. Il più probabile destino di queste piante è quello di essere tagliate e di formare una nuova ceppaia.
Il momento migliore per la fruttificazione e la nascita di nuovi semenzali logicamente dovrebbe coincidere con i primi anni dopo il taglio. Tuttavia l’effetto dell’isolamento delle chiome, che può stimolare un aumento della produzione di seme da parte delle matricine, può produrre i primi effetti nell’autunno successivo al taglio - nella migliore delle ipotesi -, quando cioè i polloni hanno già avuto un anno di forte accrescimento e quando si osserva un forte sviluppo della componente erbacea.
Da tutto ciò sembra quindi emergere il ruolo marginale della popolazione dei semenzali, sia nella sostituzione delle ceppaie che muoiono sia, soprattutto, nel reclutamento degli “allievi” a fine turno (momento in cui si opera la evocata scelta di piante “preferibilmente nate da seme”), tanto che sorge il dubbio se sia corretto definire l’insieme dei semenzali presenti come “rinnovazione” o se non sia più logico considerarli come una riserva disponibile per situazioni di emergenza, che in situazioni normali forma una sorta di seedling bank con scarsa possibilità di evoluzione (Grime 1979). D’altra parte è opinione diffusa che la continuità della produzione legnosa venga demandata quasi esclusivamente alla rinnovazione agamica ([9]).
Quando i cedui venivano sfruttati molto più intensamente di adesso, con turni molto brevi (nell’ordine dei 12 anni) sicuramente c’erano condizioni molto diverse da quelle attuali, le ceduazioni ripetute tendevano a spossare le ceppaie provocandone più velocemente l’esaurimento della capacità pollonifera. Tuttavia, secondo la letteratura, la sostituzione delle ceppaie, o comunque il rinfoltimento dei cedui, era demandato a una molteplicità di soluzioni tra cui la ceduazione delle matricine ([6]), la semina prima del taglio con successiva ceduazione delle piantine ([35]), la tramarratura, il coniferamento (anche per produrre assortimenti diversi). Le stesse matricine avevano soprattutto la funzione di diversificare la produzione legnosa ([36]) e di fornire legname di pregio ([44]). Nel lavoro citato precedentemente, Perona ([35]), parlando della piantagione per rinfoltimento, consigliava l’anticipo di 3-4 anni rispetto al taglio, in modo che “essi saranno ben attecchiti, e allora si cedueranno al piede, al tempo stesso che si taglierà il bosco: così emetteranno uno o più rampolli , ma avendo essi eguale rapidità di crescimento che i polloni delle vecchie ceppaie, non ne potranno altrimenti venire aduggiati”.
Poskin ([40]) afferma che nei cedui i semenzali vivono, insieme con i polloni, fino al momento dell’utilizzazione quando vengono tagliati e formano delle giovani ceppaie. La stesse motivazioni che stanno alla base della matricinatura a gruppi sembrano far prevalere altre funzioni rispetto alla disseminazione ([20]).
La rinnovazione da seme, intendendo il processo per cui semenzali si sviluppano fino ad assumere portamento arboreo, non viene quasi mai citata, il che non prova certamente che non avvenisse, ma fa supporre che fosse quantomeno insufficiente ad assicurare la sostituzione delle ceppaie. Mathey ([30]), tra l’altro, afferma che utilizzando cedui quercini molto giovani, si favorisce la moltiplicazione del popolamento accessorio e delle specie secondarie.
Anche l’apporto di seme era probabilmente diverso. Nel passato le matricine erano in numero assai minore di oggi, venivano lasciate in piedi per 1 o 2 turni (età dai 12 ai 24 anni), quindi veniva appena sfruttata la loro capacità riproduttiva, e forse solo se le matricine erano di origine agamica (con età di inizio fruttificazione molto anticipata rispetto alle piante di origine gamica); i polloni tagliati a 12 anni, e gli allievi per i primi anni difficilmente avrebbero potuto contribuire in modo significativo alla produzione di seme.
Allo stato delle cose appare quindi quantomeno ottimistico pensare addirittura di poter fare una selezione tra le piante da seme per scegliere gli allievi. Infine una considerazione relativamente alla necessità di avere matricine da seme per ottenere nuovi genotipi: una nuova piantina che nasce da seme è comunque un nuovo genotipo, a prescindere dall’origine agamica o sessuata dei genitori, dato che si tratta comunque di un prodotto della ricombinazione genetica. La sopravvivenza di nuovi individui aumenta, quindi la diversità genetica, ma ciò accade anche quando l’affermazione della giovane piantina passa attraverso il taglio e la formazione di una nuova ceppaia.
Ringraziamenti
In un lavoro che dura più di venti anni la lista delle persone da ringraziare rischia di essere più lunga dell’articolo e di discriminare qualcuno. Voglio però rivolgere un ringraziamento sentito a Piero Piussi, per aver dato l’avvio alla ricerca e per le continue discussioni, magari sfiancanti ma utili e a Daniele Perulli che ha condiviso questo lavoro per diversi anni.
References
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar