Tree biomass and deadwood density into aged holm oak (Sardinia) and beech coppices (Tuscany)
Forest@ - Journal of Silviculture and Forest Ecology, Volume 9, Pages 108-129 (2012)
doi: https://doi.org/10.3832/efor0690-009
Published: May 07, 2012 - Copyright © 2012 SISEF
Research Articles
Abstract
Current National Forest Inventory highlight the further increase over the last two decades of coppice area under the position of mature standing crop or in the post-cultivation phase, both being developed throughout the original cultivation area. This pattern, mainly due to the unprofitable fuel wood harvesting, also involved holm oak and beech forests, some of the most diffused forest covers in Sardinia, along the Apennines and pre-Alps. The alternative management option to ageing (the pro-active way of coppice conversion into high forest) has been also practiced in the public domain, but on much smaller areas as compared with those undergoing post-cultivation phase. Aged coppices located into medium-good site classes showed a positive growth pattern resulting in a high, age-related, wood matter storage. At the meantime, regular mortality occurring since former rotation into the fully-stocked shoot populations, stocked up high deadwood amounts, this becoming an outstanding attribute of these types. Carbon storage is becoming one of the major tasks attributable to these systems within the post-cultivation phase. Purposes are here to: (i) estimate living woody and standing + lying deadwood mass densities; (ii) determine deadwood/living mass ratio; (iii) verify lying deadwood decay class; (iv) analyse diversity between two sites aged likewise but different as for geographical location and tree species. A holm oak coppice aged 55 in Sardinia and a beech coppice aged 57 in Tuscany were selected at the purpose. Both stands have been developing the post-cultivation phase since two-three times the traditional rotation and represent the maximum ages in this position. Living and standing dead woody dry mass density were determined in each site by specific allometric functions. Lying deadwood amount was assessed by a sampling design covering systematically the full test area. Three decay classes were determined according to Hunter (modified). The tree species, both shade-tolerant, showed a similar pattern as for time of wood formation and its transfer to deadwood, as well. The main difference consists only in their evergreen and deciduous habit. Auto-ecology seems to be the main driver of stand development as for carrying capacity, mortality rate and survival time into the overstocked stand structures. Leaf standing mass and leaf /thin branches ratio are two and three times higher in holm oak, consistently with its biology. Living woody mass density is made basically by stem and thick branches (88%) and varies from 322 Mg ha-1 (beech) to 225 Mg ha-1 (holm oak). Deadwood amount ranges from 28 to 25 Mg ha-1 i.e., from 9 to 11% of living woody mass. Standing deadwood is 70 to 73% of total amount. As for lying material, the intermediate decay class is prevailing: 74%, (beech) and 66% (holm oak). Both dynamics and age-related data suggest the active role these types may play in soil conservation, improvement of forest quality and carbon storage. The need of a consistent monitoring of the further post-cultivation progress is finally stressed to recognize driving forces acting, the onset of possible limiting factors and feedbacks.
Keywords
Holm oak, Beech, Aged coppice forest, Living woody biomass, Deadwood, Wood decay.
Introduzione
I dati del primo Inventario forestale nazionale ([74]) riportano per il 73% dei cedui di faggio e il 65% dei cedui di leccio età superiori a 20 anni, corrispondenti allo stadio adulto ([7]). L’attuale Inventario ([58]) colloca l’89% del bosco ceduo negli stadi adulto e “invecchiato”, corrispondenti alle età rispettivamente prossima e superiore al turno. Per il faggio le due fasi assommano all’84.5% (36.9+47.6) in Toscana e al 91.8% (53.5+38.3) a livello nazionale; per il leccio, al 68.7% (59+9.7) in Sardegna e all’85.6% (51.2+34.4) a livello nazionale. Se complessivamente i valori specifici sono simili e la fase adulta (soprassuoli ancora suscettibili di utilizzazione) è sempre maggiore di quella in “invecchiamento”, a livello regionale (Toscana) il faggio prevale come post-coltura mentre il leccio (Sardegna) è più presente come ceduo adulto. Questa situazione evidenzia la dinamica adattativa della gestione, che da un lato ha ridotto le utilizzazioni e posticipato i turni per aumentare le masse unitarie raccolte ([35]), dall’altro si è confrontata con la rinuncia crescente alla coltivazione secondo il modello tradizionale ([34]). A livello locale, la prevalenza del tipo di proprietà pubblico/privato, la collocazione territoriale delle tipologie di bosco, l’accorpamento o piuttosto la dispersione e frammentazione delle superfici, le sollecitazioni economiche del mercato, la regolazione corrente e l’incidenza crescente di aree protette, contribuiscono a mantenere un equilibrio tra gestione e non gestione o a sviluppare la progressione della post-coltura ([36]). Questa risulta tuttavia in aumento se si confrontano le superfici dei “cedui adulti e invecchiati” con quelle di utilizzazione recente, definite dagli stadi di sviluppo “cedui giovani e in rinnovazione”.
Il faggio rappresenta ambienti di vegetazione appenninici e prealpini, il leccio caratterizza il piano basale lungo la penisola, e progressivamente quello sub-montano e montano verso sud e nelle Isole maggiori. In Toscana, come in altre aree appenniniche, la presenza diffusa dei cedui di querce caducifoglie ha marginalizzato l’utilizzazione dei cedui di faggio. In Sardegna, i cedui di leccio rappresentano invece ancora i soprassuoli più produttivi. Due contesti quindi molto diversi in cui le due specie si accomunano per la collocazione sub-montana e montana e le valenze di protezione territoriale che ne derivano, soprattutto in Sardegna, dove i cedui di leccio sono anche la copertura forestale residuale più rilevante. In questo quadro, la post-coltura realizza l’opportunità del ripristino di sistemi forestali più complessi e strutturati per il maggiore tempo di permanenza del soprassuolo.
I boschi di origine cedua si presentano oggi in condizioni molto diversificate in funzione della fertilità iniziale, del numero di ceduazioni subite, dell’intensità e qualità della coltivazione. Dove il bosco ha mantenuto continuità e il suolo fertilità sufficiente, il mancato periodico azzeramento della massa epigea ha consentito di occupare e articolare uno spazio di crescita superiore. Si va così consolidando una fase successiva in cui queste strutture assumono attributi qualitativi nuovi per i processi bio-ecologici collegati al maggiore tempo di sviluppo. Questi tipi sono a oggi studiati fino ad età massime non superiori a due, tre volte quelle del turno tradizionale ([8]).
Le maggiori biomasse per unità di superficie sono il risultato della prolungata ripresa dell’accrescimento registrata in queste strutture successivamente alla prima culminazione incrementale di poco seguente le età della tradizionale raccolta ([3], [4], [5], [6]). Il contemporaneo accumulo di necromassa legnosa è il prodotto dell’elevato livello di competizione che avviene fino dalle stesse età. La produzione sostenuta di biomassa, la sua trasformazione in necromassa e il suo progressivo decadimento nel suolo significano sequestro e accumulo di carbonio, e sono quindi espressione della funzione ambientale emergente di mitigazione, non più condizionata dalle utilizzazioni del soprassuolo ripetute a turni brevi ([41]).
Se la componente biomassa è stata oggetto di diversi contributi che riportano modelli allometrici appositamente sviluppati per queste tipologie ([4], [55], [54], [11], [89], [23], [67], [16], [40], [77], [26], [83]), soltanto da pochi anni la necromassa è diventata oggetto di indagine negli stessi tipi ([49], [25], [97], [19], [66], [78], [21]).
L’interesse per questa componente nasce dai molteplici significati della necromassa sulla fisiologia e sull’evoluzione delle popolazioni, delle comunità, degli ecosistemi ([45]). Una definizione recente di necromassa è quella del Global Forest Resources Assessment ( [44]): “necromassa è tutta la biomassa legnosa non vivente non contenuta nella lettiera, in piedi, a terra e nel suolo” ([81]). La necromassa comprende alberi interi morti in piedi e a terra, rami, frammenti di legno, ceppaie ([70]). La presenza di massa legnosa morta è rilevante per la funzionalità ([63], [62], [100], [80]) e la produttività delle foreste ([52], [46], [95]), ed è collegata al mantenimento di un ampio spettro di diversità biologica, in quanto microhabitat di centinaia di specie di invertebrati, funghi, briofite, licheni, anfibi, piccoli mammiferi e uccelli ([84], [103], [32], [75], [97], [71]), allo stoccaggio e al rilascio graduale del carbonio e dei nutrienti nel suolo ([64], [98], [68], [56], [61], [73]), al mantenimento di condizioni favorevoli alla rinnovazione naturale e alla creazione di substrati adatti alla germinazione ([51], [96], [48], [104]), alla conservazione del suolo e della stabilità dei versanti, limitando l’erosione per azione battente dell’acqua, trattenendo l’umidità e offrendo un’efficace protezione dal congelamento ([87], [43], [90], [50], [22] [72], [93]). Per questi motivi, la necromassa è tra gli indicatori di Gestione Forestale Sostenibile (Criterio 4: mantenimento, conservazione e sviluppo della diversità biologica negli ecosistemi forestali - [80]).
La dinamica accelerata dei cedui di medio-buona fertilità nella fase di post-coltura e l’entità delle superfici occupate da queste tipologie rende questa funzione rilevante, perché biomassa e necromassa, insieme a lettiera e suolo, rappresentano pool accreditabili ai fini di Kyoto ([99]) e quindi elementi di contabilità ambientale.
Nei cedui, soprassuoli giovani formati da dendrotipi medio-piccoli, predomina la mortalità per competizione (regular mortality - [86]) e la componente prevalente della massa legnosa morta, soprattutto a terra, è costituita da elementi di dimensioni molto ridotte e frammentati.
Quasi tutti i lavori in letteratura rappresentano tuttavia la condizione di fustaie mature e vetuste caratterizzate dalla fase terminale di elementi dominanti di medie e grosse dimensioni. I metodi di censimento fissano di conseguenza soglie diametriche minime di rilievo relativamente alte. Le linee guida del Protocollo di Kyoto suggeriscono di inglobare nella lettiera tutto il materiale inferiore alla soglia di 10 cm ([60], [81]). Questo è il limite inferiore più utilizzato per il campionamento del legno morto ([65], [47], [82], [84], [44]); soltanto in pochi casi lo stesso scende a 5 o 2.5 cm ([94], [88]). La soglia di 10 cm divide, in molte analisi, necromassa grossa (CWD) e fine (FWD). I frammenti di necromassa legnosa di piccole dimensioni vengono di regola considerati parte integrante della lettiera se inferiori a 2.5 cm di diametro ([101], [81]). Altri autori ([53]) li classificano invece nella categoria necromassa molto fine (VFWD). La dimensione diametrica è un fattore rilevante per qualità e quantità della diversità biologica ospitata e si collega al processo di decadimento, ai tempi di decomposizione, al contenuto nutrizionale ([105]).
Obiettivi del lavoro sono: (i) la stima delle densità di massa legnosa viva e di necromassa in piedi e a terra, senza limiti dimensionali minimi di censimento e di raccolta per approssimare la sua determinazione alla quantità reale presente; (ii) la definizione dei rapporti tra stati della necromassa (in piedi/a terra) e massa viva; (iii) la ripartizione della necromassa a terra in classi di decadimento; (iv) l’analisi di due siti diversi per collocazione geografica e composizione, ma simili per storia colturale, età e fototemperamento specifico.
Materiali
I casi di studio sono rappresentati da un ceduo di faggio del pre-Appennino toscano e da un ceduo a prevalenza di leccio della Sardegna sud-occidentale, entrambi in fase di post-coltura (Tab. 1 e Tab. 2, Box 1). I due siti sono parte dei protocolli permanenti realizzati e monitorati dal Centro di ricerca per la Selvicoltura di Arezzo (CRA-SEL).
Tab. 1 - Descrizione stazionale.
| Sito | Coordinate geografiche | Quota (m s.l.m.) | Esp. | Giacitura | Precipitazione media annua estiva (mm) | Temp. media annua mese + caldo (°C) |
|---|---|---|---|---|---|---|
| Catenaia (a) | 43°40’N 11°55’E |
1000 | SO | alto versante/pendenza moderata | 1170 172 |
9.3 19.4 |
| Is Cannoneris (b) | 39°03’N 08°50’E |
900 | SE | alto versante/pendenza moderata | 1000 35 |
15 21 |
Tab. 2 - Parametri dendrometrici (fonte: [18], [19]).
| Sito | Età anni | Ceppaie vive (n ha-1) |
Polloni vivi (n ha-1) |
Polloni/ceppaia(n) | G (m2 ha-1) | I m. G(m) | dm (cm) | ddom (cm) | hdom (m) | Im hdom (m) |
|---|---|---|---|---|---|---|---|---|---|---|
| Catenaia (a) | 57 | 744 | 2580 | 3.5 | 45.3 | 0.8 | 15 | 33 | 25.1 | 0.44 |
| Is Cannoneris (b) | 55 | 2813 | 6000 | 2.1 | 50.6 | 0.9 | 11.7 | 21 | 13.9 | 0.25 |
Box 1 - La storia colturale dei due soprassuoli
Le informazioni di archivio riportano situazioni diverse per le due foreste, esemplificative di forme consolidate del governo a ceduo e dell’uso multiplo associato, pascolo soprattutto; nel secondo caso, anche dell’inversione relativamente recente nel rapporto ceduo/fustaia avvenuto tra il 1868 e il 1911 ([1]).
I boschi dell’Alpe della Catenaia, attualmente gestiti dalla C.M. del Casentino, sono così descritti da Di Tella ([31]) nel Piano di Assestamento del 1915: “Tutta la superficie era compresa nell’estesa proprietà privata detta Tenuta di Valenzano. Nella fascia del faggio, i soprassuoli erano governati a ceduo con turni di 25-26 anni, pari al raggiungimento di diametri medi dai 6 ai 10 cm per la produzione di carbone di qualità“cannuolo”, la più remunerativa allora. Tre le classi di produttività corrispondenti ad incrementi medi di maturità da 3 a 1.5 m3 ha-1. Tutti i boschi erano a dotazione e ripartiti tra i poderi di collina e di montagna e sottoposti a un moderato pascolo ovino e bovino. Conseguentemente, i tagli del ceduo erano regolati in modo che nella superficie assegnata a un podere essi si seguissero a intervalli di almeno tre o quattro anni. In tal modo, mentre una sezione cadeva al taglio, l’altra attigua poteva riaprirsi al pascolo che veniva così a disporre costantemente della stessa estensione di bosco”.
L’archivio AFDRS ([33]) descrive gli anni successivi alla seconda metà dell’800 per la foresta demaniale di Pula che, come alcune delle principali foreste di leccio dell’isola, si era mantenuta ad alto fusto nonostante gli usi civici collettivi di legnatico, ghiandatico ed erbatico. “Con l’avvento del Regno di Sardegna prima e poi del Regno d’Italia e le leggi promulgate tra il 1863 e il 1865 che abolivano i diritti degli “ademprivi” (usi civici, caratteristici della Sardegna, consistenti nel godimento collettivo della terra, specialmente del pascolo), la superficie che costituisce il nucleo originale della foresta fu assegnata alla Compagnia Reale delle Ferrovie Sarde (1864) che la tenne fino al 1870 tra mille controversie e liti tra quanti ne pretendevano il possesso; fu quindi restituita al Demanio che la vendette, nel 1881, a tale Tonietti, imprenditore boschivo. Questi utilizzò tutto il soprassuolo a taglio raso senza riserve per ricavarne legname, carbone e scorza da tannino. L’utilizzazione massiccia in pochi anni fu resa possibile dalla costruzione di un’apposita strada ferrata che consentiva il trasporto del materiale fino alla costa. Terminato il taglio nel 1887, il Tonietti cedette la proprietà a un privato locale che utilizzò il suolo forestale per pascolo. Rifiutatosi il proprietario di eseguire le opere idrauliche sistematorie, il fondo ritornò allo Stato nel 1905 per devoluzione. All’atto dei primi lavori di ripristino, la superficie era popolata da lentisco, fillirea e corbezzolo con poche ceppaie di leccio, danneggiate dagli incendi e dal pascolo. Con la Legge Luzzatti del 1910, la stessa fu trasferita all’Azienda demaniale come bene suscettibile di sola coltura forestale”. In soli due decenni (1881-1905), avvenne così la completa demolizione dell’originaria copertura forestale. Un articolo su l’Alpe ([59]) ripercorre gli ultimi secoli di utilizzazione di queste foreste e riferisce dello stato miserevole dei boschi in provincia di Cagliari e dei problemi della loro ricostituzione all’inizio del secolo scorso.
- Sito (a). Ubicato nel complesso forestale (2360 ha) Alpe di Catenaia (Arezzo), che prosegue il rilievo orografico oltre i monti della Verna e divide Casentino e alta Valtiberina, località Buca Zamponi. Stazione pre-appenninica montana su terra bruna non pienamente evoluta da scisti argillosi alternati a marne e arenarie fini. Suolo mediamente profondo, fertilità buona. Clima umido, mesotermico, con deficit idrico estivo ridotto.
- Sito (b). Foresta di Pula (9500 ettari) nel complesso montuoso che chiude a Ovest il Golfo di Cagliari, località Sa Spinarba (Is Cannoneris). Stazione sub-costiera montana su terre brune mediterranee delle foreste xerofile e mesofile. Substrato di rocce granitiche a struttura porfirica. Fertilità buona. Clima sub-umido con marcato deficit idrico estivo mitigato dalla giacitura/ esposizione e dalla presenza notturna anche estiva di umidità atmosferica per intercettazione delle nebbie marine.
Oggi, a distanza di quasi sessanta anni dall’ultima ceduazione, i parametri descrivono soprassuoli di età da doppia a tripla degli ultimi turni applicati. La consistenza delle popolazioni (polloni e ceppaie vive), il numero dei polloni per ceppaia, i valori di area basimetrica e altezza dominante, il rapporto diametro medio/dominante, esprimono la fase di post-coltura osservata. Per approfondimenti sui siti e sui temi di ricerca sviluppati, si rimanda a [9], [3], [10], [18], [29] (faggio); [12], [13], [14], [15], [37], [38], [39], [27] (leccio).
Metodi
Per entrambe i siti, sono state considerate le aree di controllo (evoluzione naturale) del disegno sperimentale originale. ([12] [13], [9]). Nel sito (a) la tesi di controllo è rappresentata da un’unica parcella di 5000 m2 (50 x 100 m); nel sito (b) la stessa tesi è inserita in un disegno a blocchi randomizzati con tre repliche e aree di 1600 m2 (40 x 40 m).
Determinazione della biomassa epigea e della necromassa in piedi
I rilievi dendrometrici sono consistiti nella misurazione della circonferenza a 1.30 m degli alberi vivi e morti di tutte le specie presenti. Sito (a): misura campionaria delle altezze per la popolazione polloni vivi e morti in piedi, interi, cimati e stroncati; sito (b): costruzione della relazione ipso-diametrica soltanto per i polloni vivi di leccio, dato che quelli morti in piedi si mantengono in genere integri e comprensivi di cimale fino alla caduta e sono assimilabili ai dendrotipi vivi.
Le densità di biomassa e di necromassa in piedi, espresse in peso secco (Mg ha-1), sono state calcolate tramite relazioni allometriche specifiche costruite su alberi modello misurati nei due siti ([11] per il faggio; [23], [40] per il leccio). I modelli forniscono i valori di: volume (dm3) e peso (kg) del fusto + rami grossi (>3 cm) e dei rami sottili (≤ 3 cm); il peso totale legnoso epigeo. Per le determinazioni sul corbezzolo, unica altra specie arborea di rilevanza dendrometrica nel sito (b), l’analisi si è limitata alle relazioni tra le diverse espressioni della biomassa arborea e il diametro. Il portamento prostrato della specie sconsiglia infatti l’impiego dell’altezza dendrometrica tra le variabili esplicative nei modelli di previsione ([23]).
Per la determinazione del volume dei polloni morti in piedi di faggio cimati e stroncati (sito a), sono stati calcolati i coefficienti di riduzione per classi di diametro e altezze di rottura diverse e quindi il peso secco via densità basale. I rilievi sono stati condotti nel periodo invernale in assenza di foglie. La produzione annuale di massa fogliare è stata calcolata per campionamento con il metodo della raccolta tramite trappole ([28]). Nel sito (b), la massa fogliare è stata determinata per separazione campionaria delle componenti rami sottili e foglie e la produzione annuale misurata tramite trappole. La massa epigea calcolata, così come per casi analoghi ([21]), è considerata comprensiva della massa fuori terra delle ceppaie.
Determinazione della necromassa a terra
La componente necromassa legnosa a terra è stata determinata per campionamento sistematico in funzione del disegno sperimentale. Nel sito (a) sono stati realizzati 3 allineamenti paralleli a metà del terzo superiore, medio e inferiore dell’area e individuate su ciascuno 5 aree elementari di 5.4 m2 (15 in totale) Nel sito (b), sono state rilevate 4 aree di raccolta di 6.75 m2 isodisposte sulle diagonali di ciascuna parcella (12 in totale). La superficie complessiva di campionamento risulta così eguale in entrambi i siti e pari a 81 m2 secondo il criterio già utilizzato in rilievi dello stesso tipo ([21]), che ha privilegiato la ripetizione della raccolta su aree piccole ma numerose per controllare la variabilità di accumulo del materiale a terra.
Dato l’obiettivo del lavoro di censire il materiale legnoso senza limiti dimensionali minimi (coarse → medium → fine woody debris - [69]), la raccolta ha compreso tutti gli elementi legnosi ancora riconoscibili sopra e nello strato di lettiera per ottenere una stima quanto più possibile accurata.
Determinazione delle classi di decadimento
Il decadimento del legno è funzione di caratteristiche specifiche, dimensioni, stato al momento della caduta, tempo trascorso, condizioni micro-ambientali (radiazione, temperatura e umidità ), che determinano il livello di attività dei decompositori e della diversità biologica (comunità di organismi) associata ai vari stadi del processo. La classificazione adottata è quella di Hunter ([57]) modificata riunendo in tre categorie le cinque originali (Tab. 3). Questo raggruppamento ha consentito di adattare le classi alla tipologia di materiale e di semplificare e rendere meglio replicabile il criterio di attribuzione. L’ordinamento si basa su precisi parametri fisionomici - presenza-assenza di corteccia, presenza-assenza di gemme e/o rametti - e caratteristiche distinguibili al tatto - grado di consistenza del legno.
Tab. 3 - Definizione delle classi di decadimento e corrispondenza con le classi originali di Hunter ([57]).
| Classe | Definizione | Classi Hunter |
|---|---|---|
| classe A | corteccia intatta, rametti e gemme presenti (anche foglie), tessitura intatta. | 1 |
| classe B | corteccia presente - tracce di corteccia - assenza di corteccia, rametti e gemme assenti, legno di consistenza dura. | 2+3 |
| classe C | tracce di corteccia - assenza di corteccia, legno di consistenza morbida e tessitura molto friabile (polverosa) | 4+5 |
Sono stati quindi misurati e calcolati: il peso allo stato “fresco” per classe e totale per ciascuna area elementare e per la superficie complessiva di campionamento.
Per ciascuna classe sono stati formati due campioni: un campione (a) tramite estrazione casuale semplice (n = 30) ; un campione (b), formato dagli elementi con forma regolare e ancora apparentemente intatta (cilindriformi), in numero variabile da 10 a 30 in proporzione alle quantità presenti in ciascuna classe. I campioni stati sottoposti alle seguenti determinazioni di laboratorio:
- peso “fresco” (approssimazione 0.1 g - a);
- volume per via geometrica (superficie ortogonale mediana x lunghezza - b);
- peso secco in stufa ventilata alla temperatura di 102°C, fino a peso costante (in media 72 ore - a+b).
Sulla base delle analisi di laboratorio, sono stati quindi calcolati:
- rapporto ponderale (a);
- densità basale (b);
- peso secco per classe e per superficie di campionamento;
- densità di necromassa in peso secco e volume (Mg ha-1 e m3 ha-1).
Il calcolo della densità basale ha permesso di trasformare il valore di necromassa totale (peso secco) in volume e quindi il confronto con i valori in letteratura, in genere espressi in m3 ha-1.
Tutti i valori di biomassa e necromassa espressi in sostanza secca sono traducibili in contenuto di C applicando un coefficiente di conversione pari a 0.5 ([24]) o pari al valore determinato sperimentalmente per specie e tipologia di massa legnosa variabile da 0.4895 a 0.494 per le querce e da 0.4914 a 0.493 per il faggio ([79]).
I dati di distribuzione della necromassa a terra e i rapporti ponderali, per sito e classe, sono stati mediante analizzati con l’analisi della varianza (ANOVA con test post-hocTukey’s honest significance test). I valori di densità basale per sito sono stati invece confrontati con il test t di Student. Le elaborazioni sono state eseguite con il software statistico open source R ([91]).
Risultati
Parametri dendrometrici
I valori dendrometrici (Tab. 2) evidenziano, a età circa eguali, i caratteri dei due soprassuoli. Il tipo (a), quasi puro di faggio, si articola su un numero molto inferiore di ceppaie e di polloni e comunque mantiene un rapporto polloni/ceppaie più elevato. Il tipo (b), a prevalenza di leccio (71%) e con presenza complementare di corbezzolo (28%) e accessoria di fillirea, ginepro, erica arborea, ha una densità molto superiore. I valori di area basimetrica complessiva, elevati in rapporto alle età ([42], [18], [20]), sono poco diversi tra le due popolazioni e descrivono densità colme e l’occupazione totale dello spazio di crescita. L’incremento medio annuo di area basimetrica, di poco inferiore a 1 m2 anno-1, esprime livelli di fertilità medio-elevati. Il diametro medio si differenzia coerentemente alle densità correnti e in entrambi i soprassuoli ha un valore pari circa alla metà rispetto al diametro dominante. L’altezza dominante è quasi doppia nel sito a (faggio) rispetto al sito b (leccio).
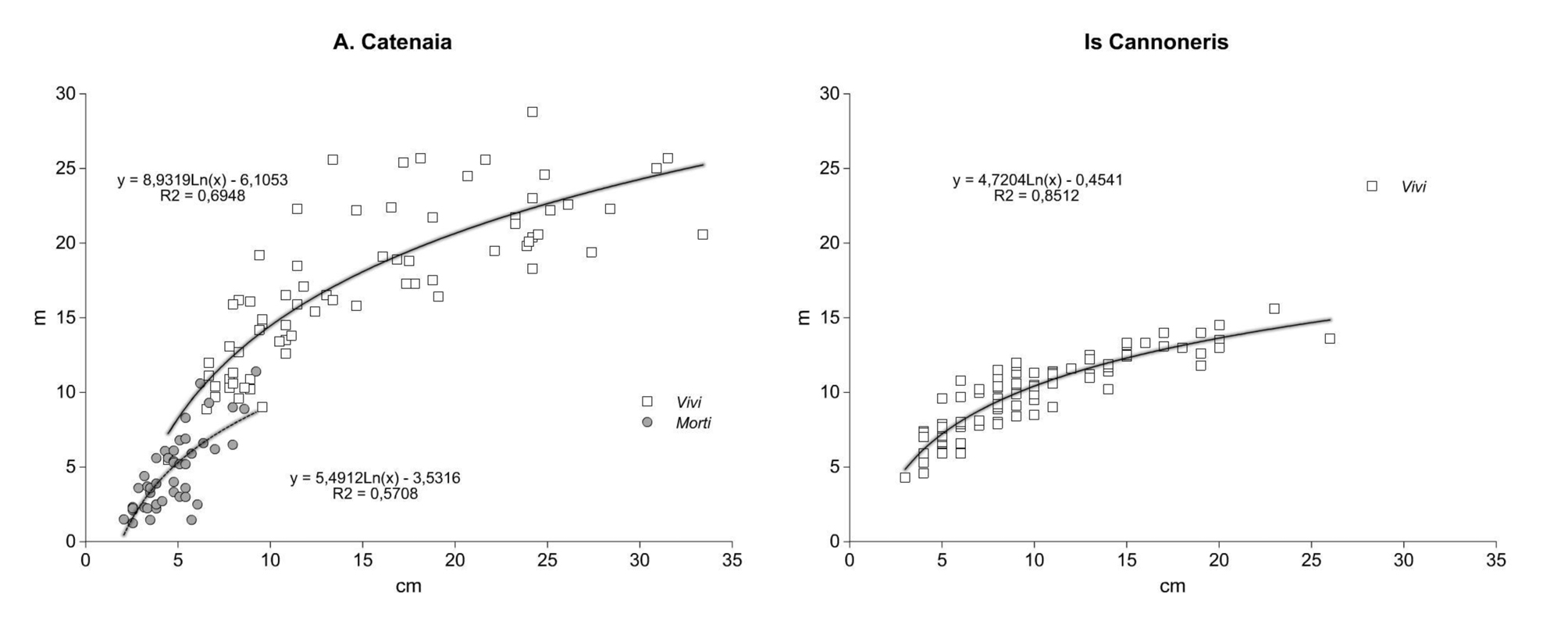
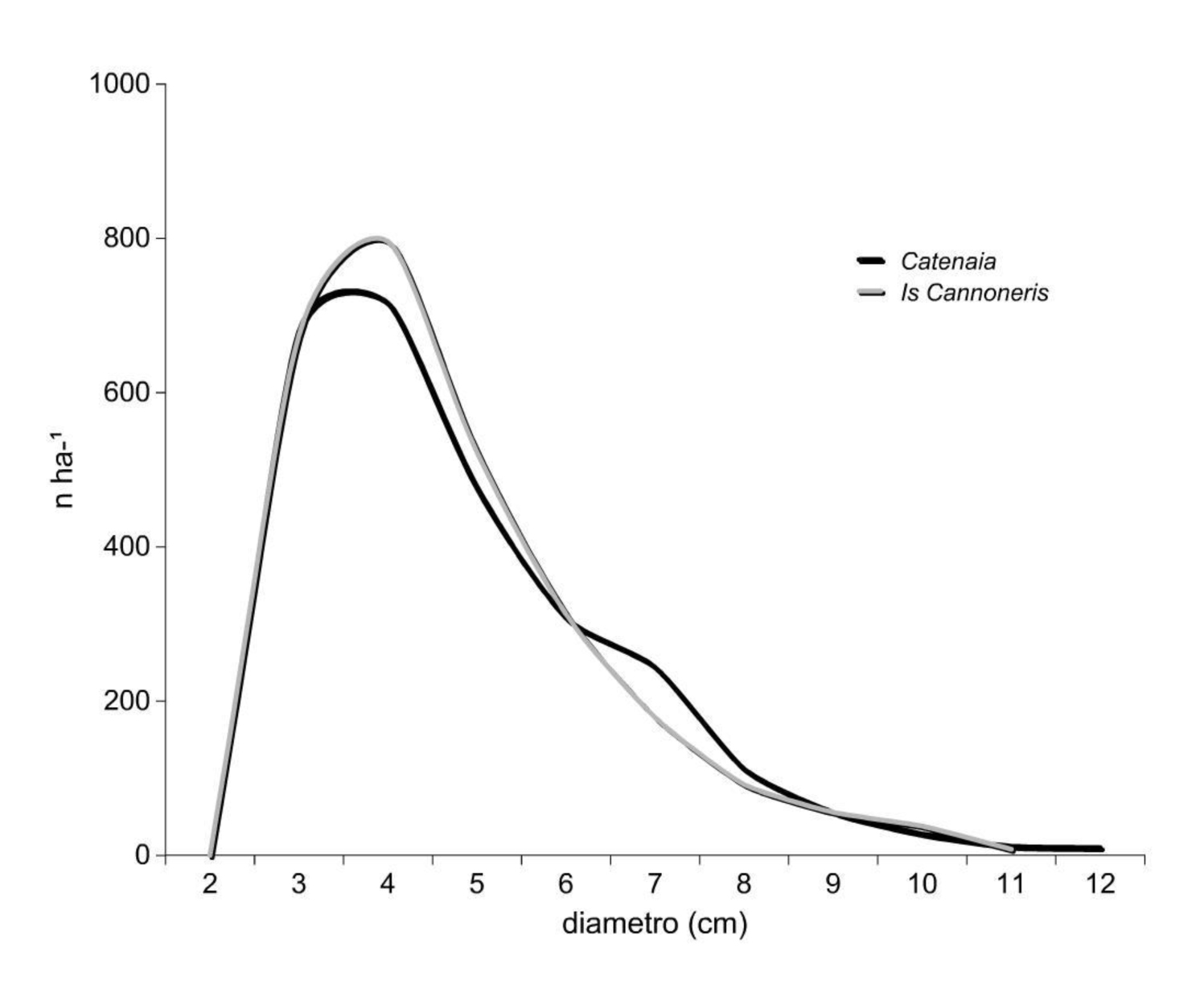
Le curve ipsometriche dei polloni vivi (Fig. 1) hanno pendenza diversa risultante della maggiore stratificazione verticale delle altezze nel sito (a), in cui anche la dispersione dei valori misurati è più ampia nel campo diametrico intermedio. Nello stesso sito, le altezze di stroncamento dei polloni morti in piedi sono molto variabili per i diametri piccoli-intermedi (2-7 cm) e limitate alla parte terminale nei soggetti di diametro maggiore (fino a 10 cm). Nel sito (b) la relazione ipso-diametrica è stata costruita solo sui polloni vivi (vedi metodo).
Le relazioni tra i valori di biomassa e necromassa e i parametri dendrometrico/descrittivi sono riportate in Fig. 2 e Fig. 3.
Fig. 2 - Relazioni tra i valori di biomassa e necromassa ed i parametri dendrometrico/descrittivi nei due siti.
Fig. 3 - Relazioni tra i valori di biomassa e necromassa ed i parametri dendrometrico/descrittivi nei due siti.
Densità di biomassa e necromassa in piedi e a terra
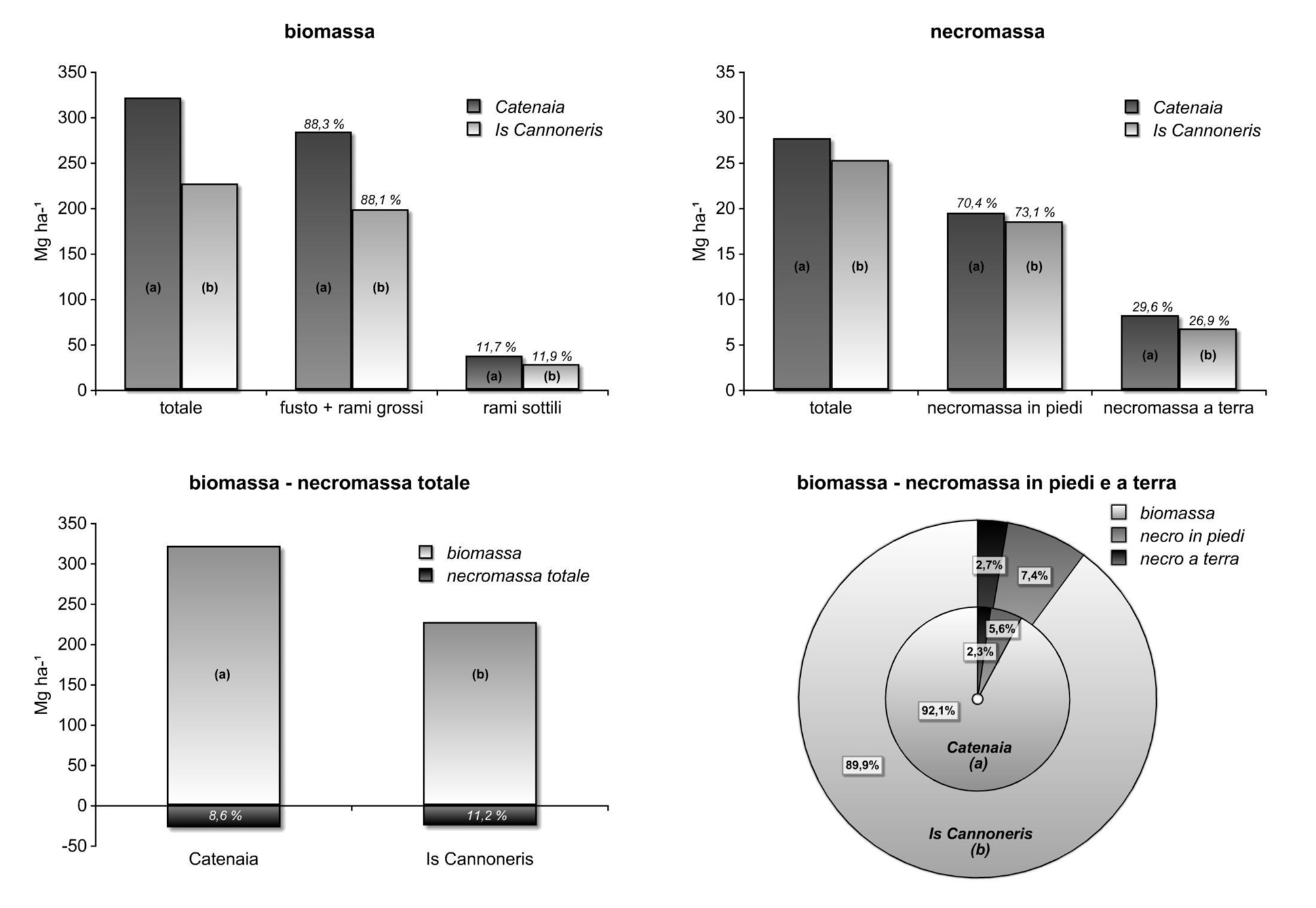
I due soprassuoli (Tab. 4) hanno valori di biomassa pari a 322 e 225 Mg ha-1. In entrambi la massa del fusto e dei rami grossi costituisce l’88% del totale (Fig. 4). I valori di incremento medio di biomassa (4.1-5.6 Mg ha-1 anno-1) indicano una dinamica di accrescimento sostenuta. La massa fogliare è quasi doppia nella specie sempreverde (7.3 contro 3.8 Mg ha-¹), la produzione annuale è pari a 3.2 Mg ha-¹ e il suo tempo di turnover è di 2.3 anni. La produzione media annuale di lettiera totale è pari a 5.2 (a) e 4.5 Mg ha-1 (b) ([12], [29]). Il rapporto massa fogliare/massa dei rami sottili, variabile da 0.10 (a) a 0.27 (b), e quello massa fogliare/massa legnosa totale (x100), 1.18 (a) e 3.24 (b), differenziano la specie caducifoglia dalla sempreverde.
Tab. 4 - Densità di biomassa e di necromassa, incrementi e allocazioni relative. Valori espressi in peso secco (Mg ha-1 e Mg ha-1 a-1). (1) [29]; (2) [12].
| Tipo | Parametro | Catenaia (a) | Is Cannoneris (b) |
|---|---|---|---|
| Età anni | 57 | 55 | |
| Biomassa legnosa | Fusto + rami grossi | 284 | 198.6 |
| Rami sottili | 37.6 | 26.7 | |
| Totale | 321.6 | 225.3 | |
| Im biomassa legnosa | 5.6 | 4.1 | |
| Biomassa fogliare | Massa fogliare | 3.8 (1) | 7.3 (2) |
| Massa fogliare / rami sottili | 0.1 | 0.27 | |
| Massa fogliare / legn. tot. (x100) | 1.18 | 3.24 | |
| Necromassa legnosa | In piedi | 19.5 | 18.5 |
| A terra | 8.2 | 6.8 | |
| Totale | 27.7 | 25.3 | |
| Accumulo medio necromassa legn. totale | 0.5 | 5 |
I valori di necromassa totale sono simili: 27.7 (a) e 25.3 (b) Mg ha-1; l’accumulo medio annuale è eguale e pari a 0.5 Mg ha-1anno-1. La necromassa totale rappresenta circa il 9 (a) e 11% (b) della massa viva (Fig. 4) nei due siti. I rapporti percentuali necromassa in piedi/a terra sono 70/30 (a) e 73/27 (b).
Il numero dei polloni morti in piedi (Tab. 5) è simile nei due siti: 2658 (a), 2690 (b); il diametro medio (6 cm) e i valori modali (4 cm) sono eguali; l’escursione diametrica è quasi coincidente (Fig. 5). Entrambe le distribuzioni hanno asimmetria positiva. L’area basimetrica rappresentata dalla necromassa morta in piedi è compresa tra i 6 e i 7 m2 ha-1.
Tab. 5 - Statistiche dendrometriche relative alla popolazione dei polloni morti in piedi.
| Parametro | Catenaia (a) | Is Cannoneris (b) |
|---|---|---|
| Età anni | 57 | 55 |
| Polloni morti (n ha-1) | 2658 | 2690 |
| dm (cm) | 5.7 | 5.5 |
| G (m2 ha-1) | 6.77 | 6.4 |
| Valore modale (cm) | 4 | 4 |
| Campo var. diam. (cm) | 3-12 | 3-11 |
Necromassa a terra e classi di decadimento
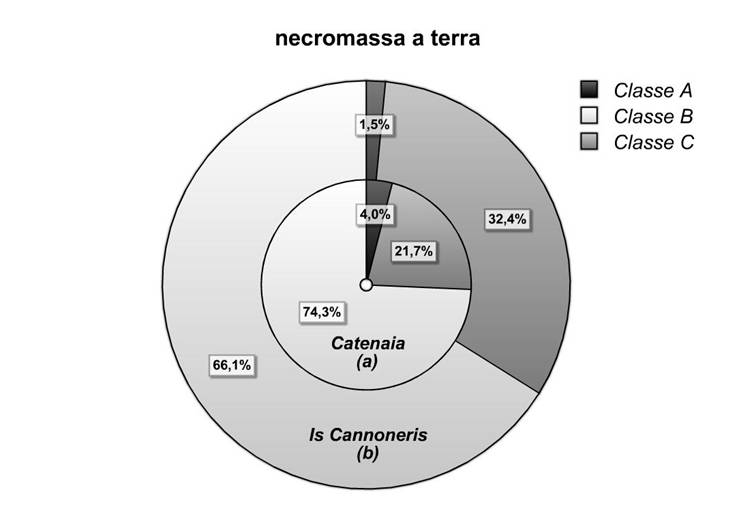
La distribuzione della necromassa a terra (Tab. 6 e Fig. 6) indica (a) - (b) la prevalenza della classe B (74-66%); seguono, molto distanziate, la classe C (22-32%) e la A (4-1.5%).
Tab. 6 - Valori di densità della necromassa a terra e valori rilevati nelle aree di campionamento, per classe di decadimento.
| Sito | Età | Necromassa a terra (Mg ha-1) | Media (d.s.) per aree elementari (Kg) | ||||
|---|---|---|---|---|---|---|---|
| Classe A | Classe B | Classe C | Classe A | Classe B | Classe C | ||
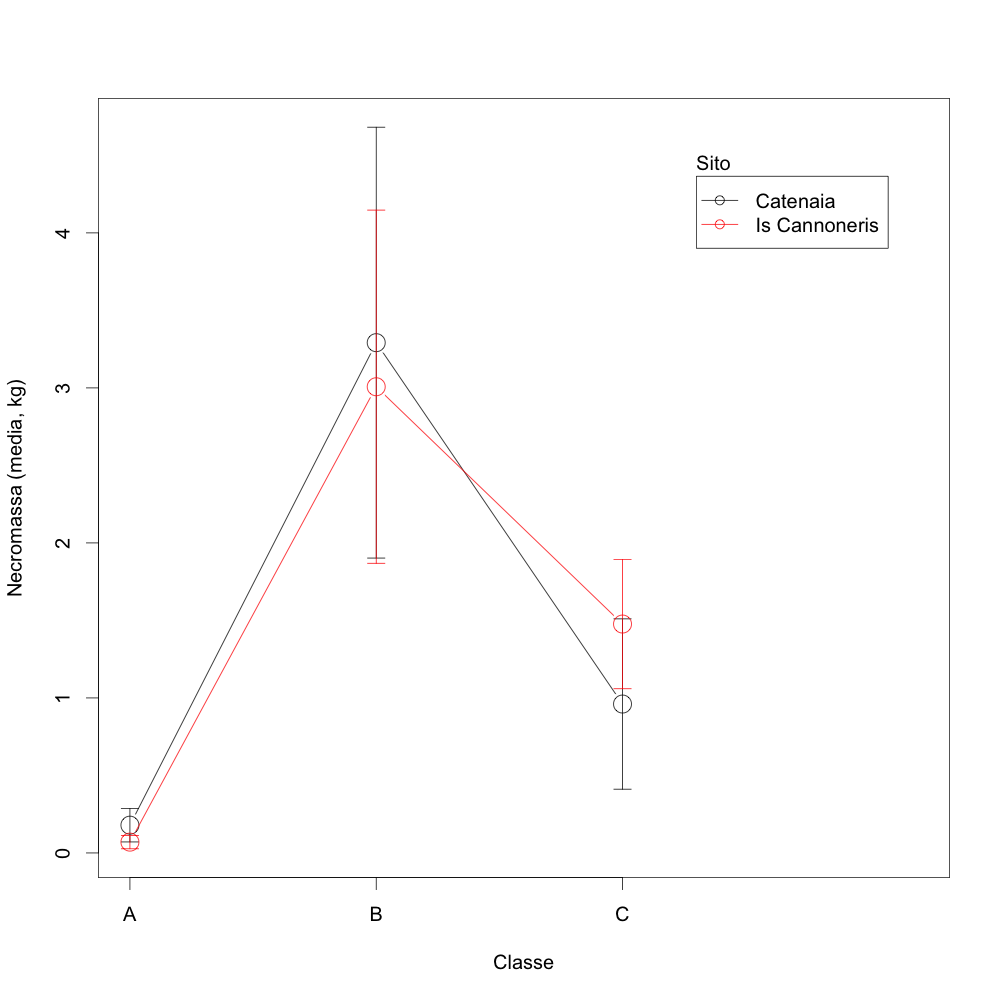
| Catenaia (a) | 57 | 0.33 | 6.10 | 1.78 | 0.2 ± 0.2 | 3.3 ± 2.5 | 1 ± 1 |
| Is Cannoneris (b) | 55 | 0.10 | 4.46 | 2.19 | 0.07 ± 0.07 | 3.0 ± 1.8 | 1.5 ± 0.7 |
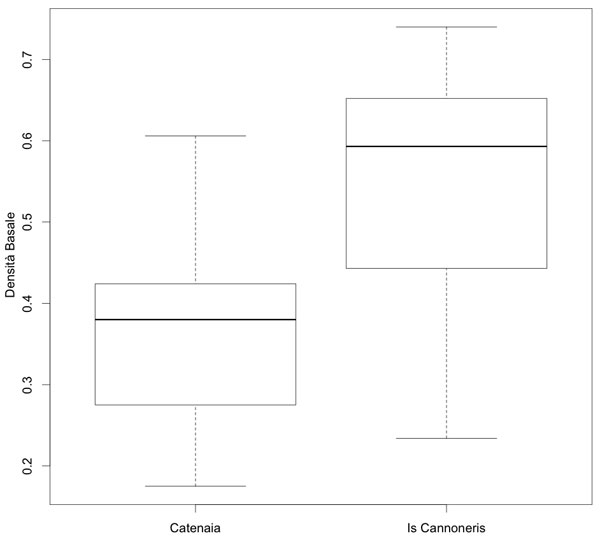
I valori medi di densità basale e rapporto ponderale (Tab. 7) variano secondo le caratteristiche specifiche del legno (leccio > faggio). Il volume della necromassa in piedi varia da 53 (a) a 34 (b), di quella a terra da 22 (a) a 12 (b), della necromassa totale da 75 a 47 m3 ha-1.
Tab. 7 - Valori degli indici di conversione e determinazione del volume della necromassa in piedi e a terra.
| Sito | Densità basale media | Volume (m ha-1) | Rapporto ponderale necromassa a terra | |||
|---|---|---|---|---|---|---|
| (gdm-3) | in piedi | a terra | tot. | (peso secco / peso fresco) | ||
| Catenaia (a) | 0.37 ± 0.13 | 52.7 | 22.2 | 74.9 | classe A | 0.72 ± 0.04 |
| classe B | 0.55 ± 0.06 | |||||
| classe C | 0.40 ± 0.04 | |||||
| media | 0.56 ± 0.14 | |||||
| Is Cannoneris (b) | 0.54 ± 0.14 | 34.3 | 12.5 | 46.8 | classe A | 0.77 ± 0.11 |
| classe B | 0.76 ± 0.05 | |||||
| classe C | 0.67 ± 0.07 | |||||
| media | 0.73 ± 0.09 | |||||
I rapporti ponderali diminuiscono, come atteso, all’aumentare della classe di decadimento, in misura molto meno sensibile nel caso del leccio.
L’analisi della varianza sui valori di necromassa a terra per classe di decadimento indica analogia tra i due siti. Risulta invece significativa la differenza tra le classi, particolarmente tra la classe B e le altre due (Fig. 7, Tab. 8, Tab. 9).
Fig. 7 - Confronto tra la quantità di necromassa per classe di decadimento. Le barre indicano gli intervalli di confidenza.
Tab. 8 - Analisi della varianza della distribuzione di necromassa.
| Componente | df | SS | MS | F value | p-value |
|---|---|---|---|---|---|
| Sito | 1 | 0.033 | 0.033 | 0.0175 | 0.0175 |
| Classe | 2 | 128.115 | 64.058 | 33.6822 | 3.65e-11 *** |
| Sito x Classe | 2 | 2.361 | 1.181 | 0.6207 | 0.5403 |
| Residui | 75 | 142.637 | 1902 | - | - |
Tab. 9 - Analisi della varianza della distribuzione di necromassa. Test post-hoc di Tukey HSD.
| Classi | diff | lwr | upr | P-adj |
|---|---|---|---|---|
| B - A | 3.034855 | 2.1373870 | 3.932324 | 0.0000000 |
| C - A | 1.059427 | 0.1619588 | 1.956896 | 0.0165950 |
| C - B | -1.975428 | - 2.8728966 | - 1.077960 | 0.0000039 |
I due siti hanno densità basali statisticamente differenti (p = 0.004092).
L’analisi dei rapporti ponderali mostra invece differenze significative sia tra i siti che tra le classi. I test post-hoc mostrano che le tre classi sono significativamente diverse tra loro (Fig. 8 e Tab. 10).
Tab. 10 - Analisi della varianza dei rapporti ponderali.
| Componente | df | SS | MS | F | p-value |
|---|---|---|---|---|---|
| Sito | 1 | 0.62385 | 0.62385 | 157.516 | <2.20e-16*** |
| Classe | 2 | 0.68077 | 0.34038 | 85.944 | <2.20e-16*** |
| Sito x Classe | 2 | 0.18203 | 0.09101 | 22.98 | 1.64e-08*** |
| Residui | 75 | 0.29704 | 0.00396 | - | - |
Discussione
Dinamica dendro-auxometrica e comportamento auto-ecologico
La capacità di interazione della specie con l’ambiente di crescita, il livello quindi di corrispondenza caratteristiche stazionali - ecologia specifica, la qualità del sito (fertilità ), gli effetti del trattamento pregresso e la durata della sua applicazione, rappresentano la base e condizionano lo sviluppo successivo all’interruzione della coltivazione. Il maggiore tempo di permanenza del soprassuolo e l’apporto continuo di sostanza organica prodotta da una massa epigea crescente non più azzerata periodicamente dal taglio, si riflettono nell’andamento auxologico positivo. In entrambi i siti, la densità colma, l’assenza di vuoti nella copertura, i valori dei parametri altezza dominante, area basimetrica e i relativi incrementi, esprimono condizioni di buona fertilità e una sensibile capacità di recupero in condizioni stazionali che storicamente ospitavano la vegetazione naturale delle due specie ([12], [18]).
La densità nel sito (b), a prevalenza di leccio ma con presenza complementare di corbezzolo e accessoria di fillirea, ginepro, erica arborea, è molto superiore per la diversità specifica che ha la capacità di saturare in modo estremamente efficace lo spazio di crescita. Il comportamento sociale delle specie complementari, corbezzolo soprattutto, è infatti opportunista e la strategia adottata è mirata a individuare e occupare, con portamento spesso prostrato, i vuoti anche minimi esistenti nella copertura. Data l’altezza dei polloni dominanti di leccio relativamente ridotta (14 m), le altre specie riescono a essere ancora competitive e a mantenere un accesso superiore anche minimo che ne consente la sopravvivenza. Il “peso” relativo dei polloni di leccio aumenta secondo il descrittore utilizzato (numero → area basimetrica → massa epigea → massa fogliare → produzione annuale di lettiera), per la prevalenza nel piano dominante ([13]).
Il modello di sviluppo dimensionale delle popolazioni è descritto dall’andamento del rapporto diametro medio/dominante ([42], [18]). La relazione confronta il valore medio per l’intera popolazione con quello della sub-popolazione dominante che utilizza l’ambiente di crescita epigeo e ipogeo più favorevole.
I rapporti diametrici nei due siti pari a 0.45 (a) e a 0.56 (b) rivelano una fase di selezione avanzata ed esplicitano la differenziazione tra una sotto-popolazione principale e una recessiva, che occupa il piano inferiore della struttura verticale e che sopravvive con incrementi prossimi allo zero per le ridotte esigenze di luce.
L’altezza dominante molto superiore a parità di età nel sito a (faggio), è espressione della maggiore capacità di accrescimento specifica, ma soprattutto della fertilità stazionale e del clima locale, soggetto a un minore stress idrico estivo.
I parametri relativi alla popolazione dei polloni morti in piedi sono molto simili nei due soprassuoli e la loro area basimetrica, sommata a quella della massa viva, produce i valori di 52.1 e 57.0 m2 ha-1 che rappresentano la densità della massa totale in piedi all’età osservata. Le due componenti sono espressione biologica: (i) della capacità portante della stazione; e (ii) della occupazione corrente dello spazio epigeo da parte della mortalità recente. Quest’ultima varia dal 14.9% (a) al 12.6% (b) dell’area basimetrica viva ed è minore dove l’occupazione dello spazio di crescita è più efficiente (caso b).
Dinamica della mortalità e auto-tolleranza specifica
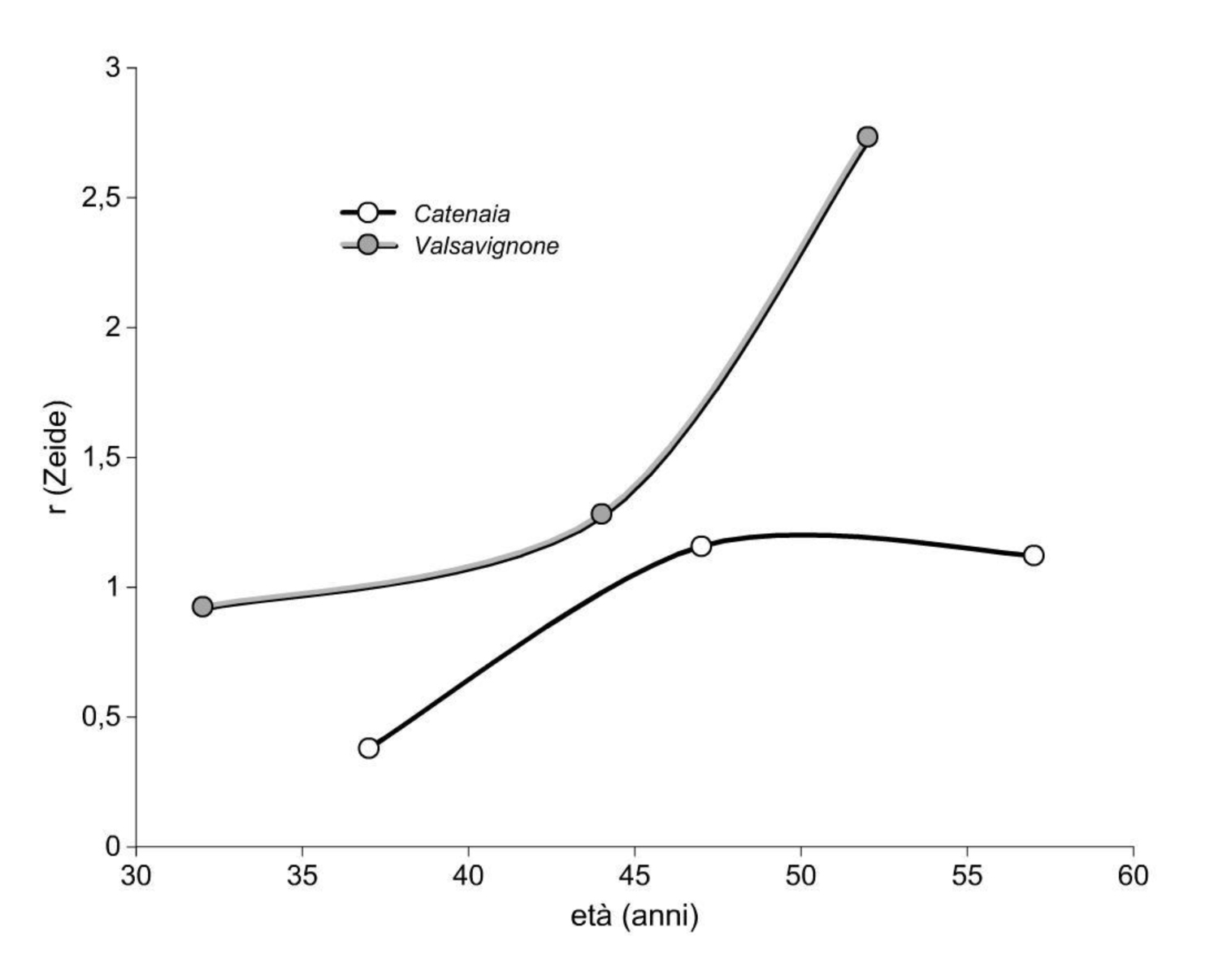
La densità colma e i valori dei parametri correlati sono funzione del fototemperamento di faggio e leccio, che permette loro una sopravvivenza prolungata. Questo attributo auto-ecologico ha effetto sul mantenimento in vita degli alberi, ma non sul loro accrescimento ([106]). Sulla base di questo assunto, Zeide ha formulato l’indice r sensibile all’auto-tolleranza o capacità competitiva intraspecifica (eqn. 1):
come rapporto tra la mortalità (Δn/N) e l’incremento del diametro medio (Δd/D) misurati in un intervallo di tempo. Minore è il rapporto r meno sono gli alberi che muoiono a parità di incremento diametrale,e più tollerante è la specie. A livello specifico, il valore di r varia secondo l’origine del bosco, la struttura, l’età del soprassuolo.
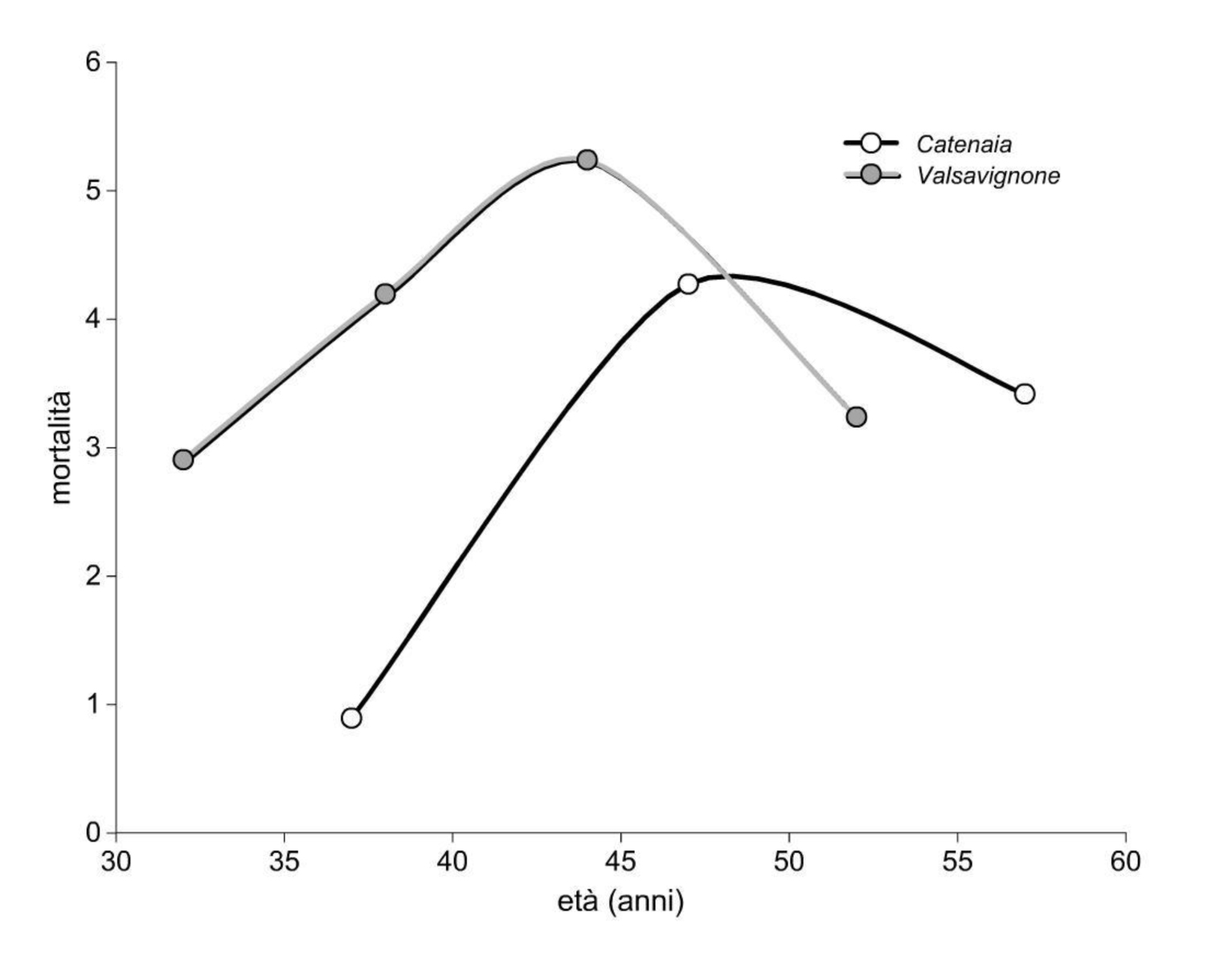
Un esempio applicativo di utilizzo dell’indice di Zeide per la verifica del differente comportamento tra specie sciafile e eliofile si ottiene dal confronto tra il sito di faggio (a) e un ceduo a prevalenza di cerro ([17]). Si riportano (Fig. 9) le età di culminazione della mortalità e gli andamenti dell’indice (Fig. 10) e si evidenziano: (i) la culminazione più precoce della mortalità nella quercia eliofila rispetto al faggio; (ii) l’andamento opposto dell’indice (r) dalle età comprese tra i 40 e i 50 anni, in cui il faggio stabilizza la sua auto-tolleranza mentre il cerro continua viceversa a ridurla in modo deciso. Negli andamenti di culminazione e di (r) relativi al sito di confronto (cerro), è da considerare la presenza complementare di carpino nero, non isolata nei dati di complesso della popolazione, che ritarda l’età di culminazione e aumenta la tolleranza relativa nel primo periodo, rispetto a un soprassuolo monospecifico di quercia.
Fig. 9 - Dinamica della mortalità dei polloni in funzione dell’età del soprassuolo in popolazioni a prevalenza di cerro (Valsavignone) e di faggio (Catenaia). La mortalità calcolata come velocità media di variazione = n/(N t)100 (Odum ([85]).
Fig. 10 - Andamento dell’indice r di Zeide negli stessi siti in popolazioni tolleranti dell’ombra (faggio) e esigenti di luce (cerro).
Formazione della biomassa e della necromassa, rapporti relativi e confronto con soprassuoli di querce eliofile
Massa viva e necromassa iniziano a formarsi con l’ultimo taglio (1945-1948), salvo i polloni e le poche matricine rilasciati dal ciclo precedente. L’utilizzo per produzione di carbone (la presenza di aree carbonili è ancora bene riconoscibile in entrambi i siti) e il confezionamento delle fascine ripulivano la superficie di taglio dai residui legnosi e dalla frasca.
I valori di massa arborea (322 e 225 Mg ha-1) e di incremento medio (5.6 e 4.2 Mg ha-1 a-1) confermano quanto già verificato in soprassuoli cedui di buona fertilità e età simile in fase di post-coltivazione a prevalenza di cerro (313 e 239 Mg ha-1; 5.7 e 4.6 Mg ha-1 a-1 - [21]).
Il modello di sviluppo evidenzia la ripresa dell’accrescimento successivamente alla prima culminazione dell’incremento medio di massa totale registrata dalle tavole alsometriche per i cedui a regime e circa coincidente con le età della tradizionale ceduazione. L’allocazione prevalente della massa è nel fusto e rami grossi. La massa fogliare, elevata in rapporto alle età, spiega il livello sostenuto di accrescimento. I rapporti massa fogliare/massa dei rami sottili e massa fogliare/massa legnosa totale sono pari a circa 1/3 nel faggio rispetto al leccio.
I valori di necromassa totale sono simili (25→28 Mg ha-1) e compresi nel campo di variazione già osservato per i soprassuoli di cerro (22→30 Mg ha-1), così come i valori medi di accumulo: 0.5 (faggio-leccio) vs. 0.4-0.5 Mg ha-1anno-1 (cerro).
Il rapporto necromassa a terra/in piedi varia da 1/2 a 1/3 in misura opposta a quanto osservato nei soprassuoli di cerro, per lo sviluppo più precoce e la culminazione anticipata della mortalità nella quercia eliofila, ma anche per la minore durabilità in piedi del legno morto della stessa specie. Anche il range dimensionale della mortalitàè diverso: il diametro medio dei polloni morti in piedi è eguale a 6 cm (faggio-leccio) contro gli 8-11 cm in soprassuoli di età simile di cerro. La differente auto-ecologia è ancora il determinante dei tempi di formazione e di trasferimento a terra della necromassa.
Il rapporto percentuale necromassa/biomassa è superiore nel sito a prevalenza di leccio e suggerisce la proporzionalità diretta tra mortalità e densità in origine più elevate, anche se la mortalità, nella fase corrente, è simile in entrambe le popolazioni.
La diversa durabilità del legno di faggio e di leccio influisce sui valori di necromassa legnosa misurati soprattutto a terra. Secondo Leibundgut (in [30]), la scarsa quantità di necromassa rilevata nei boschi naturali di faggio è da ricondurre alla velocità di decomposizione di questa specie (10-30 anni), analogamente a quanto avviene in altri boschi di latifoglie a legno dolce. Nelle specie con durame sviluppato come le querce i tempi di decomposizione possono viceversa durare anche più di 45 ([102]) e fino a 90-100 anni ([2]), particolarmente in specie con legno a densità elevata come il leccio. Nelle due stazioni non sono stati registrati eventi estremi recenti di particolare entità come quello verificato in siti di leccio del Gargano riferito da Marziliano ([78]), che hanno contribuito con crolli diffusi a incrementare in modo sensibile la quantità di necromassa rilevata.
Classi di decadimento della necromassa a terra
La velocità di decadimento del legno dipende da un complesso di fattori: specie legnosa, dimensioni e tipo del materiale, cause di morte, ambiente (quota, esposizione, microclima), diversità, consistenza e livello di attività metabolica della comunità dei decompositori specializzati nelle diverse fasi di demolizione. Risulta per questo complesso definire una durata media del processo ([30], [102], [92]) e i dati in letteratura sono carenti. La velocità di decomposizione aumenta al contatto del terreno consentendo agli organismi del suolo di partecipare alla degradazione del legno. In climi caldi e umidi è superiore rispetto a climi freddi e secchi mentre, in ambienti montani, la quota può costituire un rallentamento. La frammentazione da parte di insetti lignivori velocizza molto il processo rispetto a quando questo è dovuto prevalentemente ad attività fungina. L’assenza o il numero ridotto di specie saproxiliche in foreste coltivate da lungo tempo, può aumentare i tempi di decomposizione rispetto a foreste naturali ([102]).
Nel caso in esame, il criterio di formazione delle classi definisce lo stato del materiale legnoso: da “fresco” (A), a perdita parziale delle parti esterne e consistenza ancora evidente (B), a disfacimento medio-avanzato (C). Quest’ultima classe non contabilizza la quantità ulteriormente trasformata e incorporata nel suolo. La stessa definizione di classe implica tempi di permanenza diversi e quindi quantità rilevate differenti. La forte frammentazione del materiale associato alla classe C facilita e accelera la fase terminale di decomposizione.
La classe A (4 -1.5%) è quella meno rappresentata e include il materiale caduto nell’anno o in quelli immediatamente precedenti, essenzialmente per frizione di parti della chioma verde e sollecitazioni meccaniche del vento o schianti di porzioni di fusto e rami per neve o gelo. La quantitàè tre volte superiore nel sito di faggio dove le rotture per eventi meteo sono superiori anche per le altezze e il coefficiente di snellezza maggiori.
Le quantità in classe B (74-66%) sono prodotte dall’occorrenza dei successivi cicli di mortalità e dal rifornimento annuale del legno già morto in piedi. I valori di necromassa sono qui largamente prevalenti perché l’apporto della massa epigea morta in piedi avviene già in questa classe e per il tempo di permanenza nella stessa relativamente lungo. Il prolungato mantenimento di polloni interi in piedi (leccio vs. faggio) può influire sulla quantità di necromassa a terra.
In classe C (22-32%) è presente materiale di età databile all’età assoluta del soprassuolo (ultimo taglio) o inferiore. La minore durabilità del legno di faggio rispetto a quello di leccio rende maggiore per la prima specie la frazione legnosa già incorporata nel suolo e quindi non più determinabile con il tipo di rilievo condotto. La maggiore densità del legno (leccio vs. faggio) si riflette nei valori specifici medi di densità basale e rapporto ponderale.
Comparazione con i dati di necromassa legnosa in letteratura
I lavori in letteratura utilizzano dimensioni minime di campionamento del legno morto in piedi e a terra variabili secondo la tipologia di soprassuolo, gli obiettivi, le determinazioni nazionali ([76]). Non esiste una definizione dimensionale comune di legno morto e questo preclude in grande misura i confronti possibili ([105]).
Si riportano in Tab. 11 i limiti dimensionali minimi e le densità di necromassa rilevate in studi diversi condotti in Europa e in Italia su soprassuoli di leccio e di faggio, sia gestiti che non gestiti. I limiti dimensionali variano da 2.5 a 12 cm per il legno morto in piedi; da 2.5 a 10 cm per quello a terra. I valori rilevati, molto variabili, dipendono dalla strategia di campionamento adottata, dal livello di accuratezza fissato, dalla soglia minima del protocollo di rilievo, particolarmente in soprassuoli giovani e produttori di mortalità quasi esclusiva di elementi di ridotte dimensioni.
Tab. 11 - Comparazione dei protocolli di rilievo e dei dati di densità di necromassa dalla letteratura.
| Tipologia/specie | Paese | gestione si/no |
d. min. camp. in piedi (cm) |
massa morta in piedi (m ha-1) |
d. min. camp. a terra (cm) |
massa morta a terra (m ha-1) |
necromassa totale (m ha-1) |
Fonte bibliografica |
|---|---|---|---|---|---|---|---|---|
| Ceduo matricinato di faggio | Svizzera | no | ≥ 12 | 13.8 | ≥ 5 | 28.3 | 42.1 | [49] |
| Ceduo di leccio | Italia (Toscana) |
no | - | - | d ≥ 10 +10 > d ≥ 5 | 8.3 | - | [97] |
| Italia (Sardegna) |
no | - | - | d ≥ 10 +10 > d ≥ 5 | 3.6 | - | [97] | |
| Cedui invecchiati di leccio | Italia (Puglia) |
no | d ≥ 2.5 | 19.1 | 2.5 | 14.8 | 33.9 | [78] |
| Ceduo invecchiato di faggio | Italia (Emilia) |
no | d ≥ 3 | 18.9 | d ≥ 3 | 5.9 | 24.8 | [19] |
| Cedui invecchiati di leccio | Italia (Toscana 1) |
no | d ≥ 3 | 16.0 | d ≥ 3 | 13.0 | 29.0 | [19] |
| Italia (Toscana 2) |
no | d ≥ 3 | 20.0 | d ≥ 3 | 25 | 45.0 | [19] | |
| Italia (Sardegna) |
no | d ≥ 3 | 27.0 | d ≥ 3 | 0 | 27.0 | [19] | |
| Italia (Lazio) |
no | d ≥ 3 | 5.0 | d ≥ 3 | 1.0 | 6.0 | [19] | |
| Boschi alti di faggio | Italia (Toscana) |
- | d ≥ 4.5 | 7.4 | d ≥ 9.5 | 1.7 | 10.8 | [58] |
| Italia | - | d ≥ 4.5 | 4.0 | d ≥ 9.5 | 1.8 | 7.6 | [58] | |
| Boschi alti di leccio | Italia (Sardegna) |
- | d ≥ 4.5 | 1.2 | d ≥ 9.5 | 0.5 | 2.1 | [58] |
| Italia | - | d ≥ 4.5 | 1.7 | d ≥ 9.5 | 0.4 | 2.9 | [58] |
Le densità di necromassa variano per i soprassuoli di faggio da 13.8 a 18.9 m3 ha-1 (in questo lavoro: 52.7 m3 ha-1 in piedi), da 5.9 a 28.3 m3 ha-1 (22.2 m3 ha-1 a terra) e da 24.8 a 42.1 m3 ha-1 (74.9 m3 ha-1 totale). Il valore medio secondo l’INFC ([58]) è di 10.8 (Toscana) e di 7.6 m3 ha-1 (nazionale). Per i soprassuoli di leccio da 5 a 27 m3 ha-1 (in questo lavoro: 34.3 m3 ha-1 in piedi), fino a 25 m3 ha-1 (12.5 m3 ha-1 a terra) e da 6 a 45 m3 ha-1 (46.8 m3 ha-1 totale). Il valore medio inventariale è di 1.2 (Sardegna) e di 1.7 m3 ha-1 (nazionale).
Valori generali di riferimento per la densità di necromassa legnosa calcolata secondo i criteri FAO ([44]), sono di 9.9 m3 ha-1 (da 0.9 a 23 media europea) e di 12.3 m3 ha-1 (media nazionale), di cui 8.3 m3 ha-1 a terra e 4 m3 ha-1 in piedi ([80]).
Conclusioni
Biomassa e necromassa legnosa sono stati funzionali diversi che condividono per un tempo variabile lo stesso spazio. La prima rappresenta la dinamica di formazione e accumulo, la seconda l’uscita dalla produzione corrente e il rientro nel pool complessivo della sostanza organica prodotta e poi trasformata nel sistema. Data la definizione convenzionale di massa viva (la maggiore parte dei fusti è formata da legno morto di supporto ai tessuti viventi - [106]), biomassa e necromassa legnosa esprimono insieme la parte più rilevante della produttività biologica del sistema forestale. I dati analizzati escludono la lettiera prodotta annualmente, la biomassa legnosa ipogea e la necromassa già incorporata nel suolo. Sono parimenti esclusi il turnover delle radici fini e la dismissione di interi settori e branche radicali, particolarmente attiva nei soprassuoli di origine cedua per affrancamento dal sistema originale. I valori rilevati sono quindi per difetto di una quota di produzione che diventa importante in prospettiva dei cicli successivi, soprattutto per il tempo di residenza molto superiore nel suolo. Approfondimenti previsti riguardano il contenuto della sostanza organica e la determinazione del C nel suolo rispetto alla baseline dei cedui a regime, dopo alcuni decenni di accumulo indisturbato e a seguito di un modello di accrescimento positivo fino alle età osservate.
L’auto-ecologia simile di faggio e leccio (tolleranza dell’ombra), dimostra essere il determinante dell’andamento simile dello sviluppo della massa vivente e della necromassa, la diversità relativa rimanendo limitata ai parametri correlati allo stato di sempreverde e caducifoglia. Le differenze viceversa evidenti con soprassuoli a prevalenza di querce eliofile (cerro - stesse tipologie ed età simili), convalidano ulteriormente la tesi del fototemperamento come elemento discriminante la dinamica di formazione e di trasferimento da biomassa a necromassa e da massa morta in piedi a terra.
Queste tipologie e classi di età, sempre più diffuse nelle foreste già governate a ceduo, dimostrano in modo chiaro il risultato del mutamento o interruzione della gestione tradizionale - da intensiva e mirata alla produzione diretta di combustibile (legna e carbone) - alla fase attuale di post-coltivazione. Gli stessi soprassuoli assumono valenze importanti di conservazione e mitigazione per l’accumulo e per la capacità elevata di sequestro corrente di C. In questo senso, l’evoluzione descritta si può definire come un autonomo adattamento pro-attivo a esigenze oggi prioritarie e lontane da quelle prevalenti solo alcuni decenni orsono.
Diventa basilare per la gestione conservare questo stato “virtuoso”, tenendo presente che il modello di sviluppo osservato a età da doppie a triple della tradizionale ceduazione descrive soltanto una fase della dinamica complessiva nel ciclo di vita del soprassuolo. Alcune vulnerabilità sono già percepibili: la più evidente è la suscettibilità agli incendi, particolarmente in aree sensibili e accorpate per la presenza di elevati stock di necromassa. Un’altra è rappresentata dalla presenza continua di legno di morte recente, habitat utile per la colonizzazione di insetti potenzialmente dannosi per la successiva pullulazione su piante vive. Il primo appare il rischio più importante a breve termine, dato l’effetto distruttivo immediato del fuoco che può compromettere su ampie superfici alcuni decenni di formazione, sviluppo e accumulo di sostanza organica. La riduzione del danno possibile attraverso opere di difesa e prevenzione attive va compreso, riconosciuto, condiviso e valutato in rapporto al valore indiretto di copertura e protezione del suolo insieme alla capacità di mitigazione svolta. Queste appaiono oggi le funzioni emergenti, concretamente contabilizzabili in termini di difesa ambientale e di attenuazione degli effetti del cambiamento climatico.
La buona gestione forestale deve prevedere anche la possibilità di rottura dell’equilibrio ecologico creatosi in questa prima fase di post-coltivazione per le forze agenti, l’insorgenza di possibili fattori limitanti, le retroazioni naturali. Il governo di questi sistemi, che trovano oggi motivo coerente di esistere alternati a quelli coltivati secondo le forme tradizionali e in avviamento ad alto fusto, implica azioni coordinate di monitoraggio, ricerca e sperimentazione, formulazione e confronto di soluzioni mirate ad anticipare e risolvere nel senso voluto le dinamiche future, nell’insieme quindi l’applicazione di strumenti di gestione di tipo adattativo.
La mancanza di modelli di riferimento per queste strutture di neoformazione può realisticamente ipotizzare l’occorrenza di fasi più avanzate apparentemente caotiche e molto diverse dalle precedenti esperienze “ordinate” di coltivazione, e tuttavia perfettamente naturali. Sapere interpretare questi fenomeni e risolvere eventuali criticità, soprattutto nello stadio maturo di crollo, insediamento e affermazione della rinnovazione, significherà aver saputo concludere con successo la fase dinamica di trasformazione in atto.
Ringraziamenti
Il lavoro è stato svolto nell’ambito del progetto “Ri.Selv.Italia” sottoprogetto 3.2 “Selvicoltura, funzionalità e gestione sostenibile dei cedui nell’area appenninica e mediterranea”.
Si ringraziano i due referee per l’attenta revisione che ha consentito di migliorare la stesura finale del lavoro.
References
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar