Bird diversity in Turkey oak (Quercus cerris) coppices and transitory stands in the northern Apennines
Forest@ - Journal of Silviculture and Forest Ecology, Volume 9, Pages 185-197 (2012)
doi: https://doi.org/10.3832/efor0697-009
Published: Jul 23, 2012 - Copyright © 2012 SISEF
Research Articles
Abstract
In the last decades, socio-economical changes occurred in Italy have deeply affected woodland, particularly coppices. Although most of them, above all in public land, are being converted to high forests, in the last years coppices have been experiencing an increase in their use. The claimed need to reconcile silviculture and biodiversity conservation calls for a better understanding of the effects of coppice management practices on the different components of biodiversity. Using birds as environmental indicators, we studied differences in species composition and diversity of bird communities in coppices and “transitory stands” (ex-coppices recently converted in high stands) in the Alpe della Luna forest (Arezzo), in Tuscan Apennines. Relative frequency of each species and the mean abundance and richness at point level were compared among forest typologies. To test the effects of different management types on bird communities, descriptive models (GLM) have been applied using stand age and the amount of non-forest habitats as predictors. Our results show that 34.4% of the species (57.1% considering only forest species) are affected by the forest management type: 9 species (7 considering only forest species) were more common in transitory stands, while only two (of which one considered forest species) in coppices. Overall, richness is higher in transitory stands, where species of mature forests have been found; on the contrary, coppices did not host any open habitat species, as stated in other studies. Richness in forest species is positively related to stand age for both coppice and transitory stands; the amount of open habitats is positively correlated with number of open-habitat species, but it did not negatively affect richness in forest species that apparently did not suffer for any boundary effect.
Keywords
Birds, Coppice, Conversion into high forest, Turkey oak, GLM
Introduzione
Il ceduo è un elemento importante del paesaggio forestale italiano: è governata a ceduo più della metà dei boschi italiani ([20]) e in alcune regioni, soprattutto dell’Italia centrale, la percentuale di boschi cedui sul totale della superficie forestale è molto più elevata (oltre l’85% in Toscana - [39]). I cambiamenti che hanno interessato il paesaggio dell’intero territorio nazionale ([26]) ed in particolare, nel breve e nel lungo periodo, i paesaggi montani ([71], [3]), hanno avuto importanti ripercussioni anche nelle forme di gestione degli ambienti forestali ([2]) e profonde trasformazioni hanno interessato anche i boschi cedui. I boschi cedui hanno raggiunto la massima estensione probabilmente all’inizio del ’900 ([1]) e nel corso dell’ultimo secolo in parte sono stati abbandonati, in parte sono stati interessati da interventi di avviamento all’alto fusto, e in parte invece sono ancora governati a ceduo. Anche in questi ultimi, comunque, una serie di modificazioni nel trattamento, che vanno dall’allungamento del turno all’abbandono dell’utilizzo multifunzionale (pascolo, produzione di assortimenti particolari), hanno determinato profondi cambiamenti nella struttura dei soprassuoli rispetto al passato ([54], [38]).
Ancora oggi comunque i cedui a regime sono, almeno in alcune regioni italiane, una importante realtà produttiva ([56], [25]) e anzi, di fronte a nuovi sviluppi di mercato ([52]), si sono anche registrate tendenze all’incremento nelle utilizzazioni ([30]). Nel frattempo si è molto accresciuta anche l’attenzione agli aspetti più strettamente naturalistici, e in generale la gestione del bosco ceduo rimane un argomento di importante attualità ([37]). La politica forestale degli ultimi decenni ha notevolmente incoraggiato la conversione dei cedui in fustaia, soprattutto nelle aree montane ([17]), ottenendo in termini di superficie risultati concreti in molte regioni: ad esempio, in Toscana le fustaie transitorie coprono superfici ormai molto estese ([39]) con una tendenza all’aumento confermata anche nell’ultimo decennio ([5]). Di fronte ad una realtà così estesa e ancora molto dinamica, e anche in considerazione di altri importanti fenomeni come i mutamenti climatici in atto ([28], [42]), le problematiche relative alla gestione di questi soprassuoli vanno inquadrate in un contesto ampio che tenga nella dovuta considerazione anche gli aspetti legati alla biodiversità, soprattutto all’interno delle aree protette ([16], [62]).
La ricerca sulla conversione dei cedui in fustaia, iniziata da alcuni decenni, ha affrontato soprattutto gli aspetti strutturali e produttivi, con una crescente attenzione pure alle più moderne questioni della sostenibilità e della biodiversità ([24], [17]). Molti studi riguardano in particolare la componente vegetale della biodiversità ([8], [45], [47]), mentre minor attenzione è stata riservata agli aspetti faunistici, e in particolare alla fauna vertebrata. L’interesse per quanto riguarda i rapporti con la fauna vertebrata si è tradizionalmente concentrato sugli ungulati selvatici, per i quali il governo a ceduo è in genere considerato positivamente, in quanto il bosco nei primi anni dopo il taglio è in grado di fornire alimento e rifugio per gli ungulati stessi ([13], [36]), sebbene il problema dei danni alla rinnovazione, che ha assunto importanza crescente anche in ambito appenninico ([50]), sia arrivato ad interessare in misura rilevante anche il bosco ceduo ([27]). Nonostante alcuni recenti studi sulla biodiversità nei cedui abbiano incluso anche la componente faunistica, o almeno una sua parte ([49]) e questa sia considerata, almeno nella teoria, un elemento importante nelle scelte di gestione ([43], [37]), i rapporti tra fauna e foreste sono stati in generale poco studiati in Italia dove esiste un gap di conoscenze solo in parte colmabile con studi svolti all’estero (ad es., [22]), in realtà dove il ceduo è in genere assente o ha un ruolo molto marginale, almeno in termini di estensione.
Un ruolo particolare tra le componenti della fauna vertebrata rivestono gli uccelli: la comunità ornitica mostra infatti una risposta alle trasformazioni degli ambienti forestali pronta e evidente: se cambia la struttura del bosco, cambia in maniera rapida e in genere molto chiara anche la comunità di uccelli che vi è ospitata ([40]). Anche in ambito appenninico è stata messa in evidenza una risposta molto chiara della comunità ornitica a mutamenti nella struttura del bosco, nel caso specifico quelli determinati dal generale invecchiamento dei soprassuoli ([66]), ed è verosimile che anche l’avviamento all’alto fusto dei cedui, negli stessi ambiti, possa comportare profonde modificazioni nella composizione e nella struttura delle comunità ornitiche. Comprendere l’entità e la qualità di questi cambiamenti, dato il possibile impiego degli uccelli come indicatori per il monitoraggio di alcuni aspetti riguardanti la biodiversità ([35]), sembra quindi di notevole importanza trattandosi di una dinamica, quella delle conversioni all’alto fusto, che riguarda estese superfici, soprattutto di boschi pubblici, il cui ruolo nella conservazione è ormai riconosciuto di primaria importanza ([16]).
Di fronte a questi elementi di potenziale interesse, le informazioni disponibili sugli effetti del trattamento dei cedui sull’avifauna sono ad oggi estremamente frammentarie e, laddove non sono limitate a dati di tipo aneddotico ([15], [44]), sembrano fornire indicazioni contrastanti o difficilmente interpretabili ([14], [60], [51], [49]), verosimilmente in funzione anche dei metodi di indagine utilizzati e delle diverse specificità dei contesti indagati.
Il territorio della Valtiberina toscana è interessato da grandi estensioni di cerrete ([7]), pressoché tutte ceduate nel recente passato e oggi in parte utilizzate a ceduo e in parte avviate all’alto fusto in anni recenti ([4]). L’area suddetta fornisce un’ottima situazione “sperimentale”: la compresenza di queste due forme di gestione, in ambienti tra loro simili per condizioni edafiche e climatiche e differenti solo nel regime proprietario (le conversioni all’alto fusto interessano quasi esclusivamente proprietà pubbliche), è ideale per indagare gli effetti della forma di utilizzazione sulle componenti del sistema, e in particolare sull’avifauna. Lo scopo di questo lavoro è di indagare possibili differenze tra le comunità di uccelli nidificanti nelle due forme attuali di utilizzazione della cerreta (ceduo in conversione e ceduo a regime). A tal fine si sono analizzate sia le variazioni a livello di composizione specifica, sia i mutamenti nella struttura e nella biodiversità tra le due “forme di utilizzazione”, tenendo conto anche del contesto paesaggistico nel quale si inseriscono le situazioni studiate.
Materiali e metodi
Area di studio
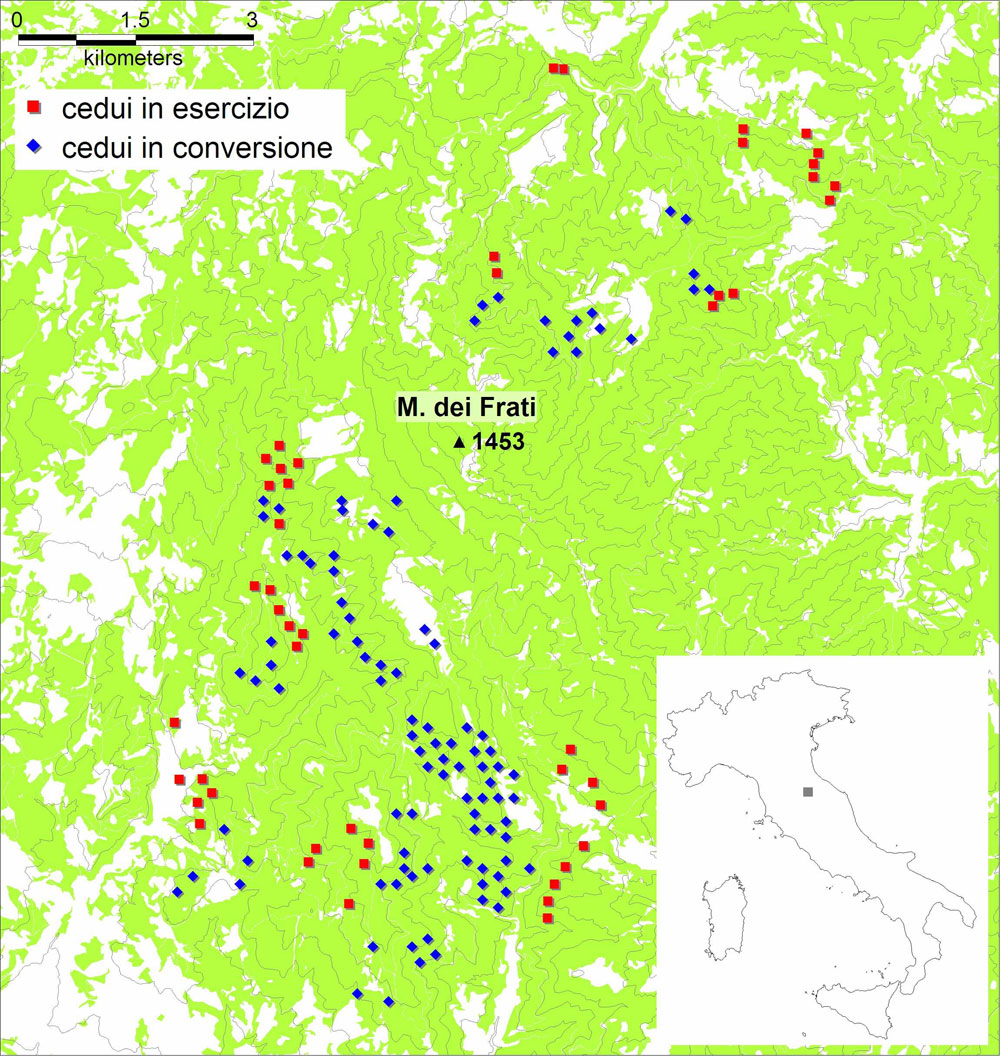
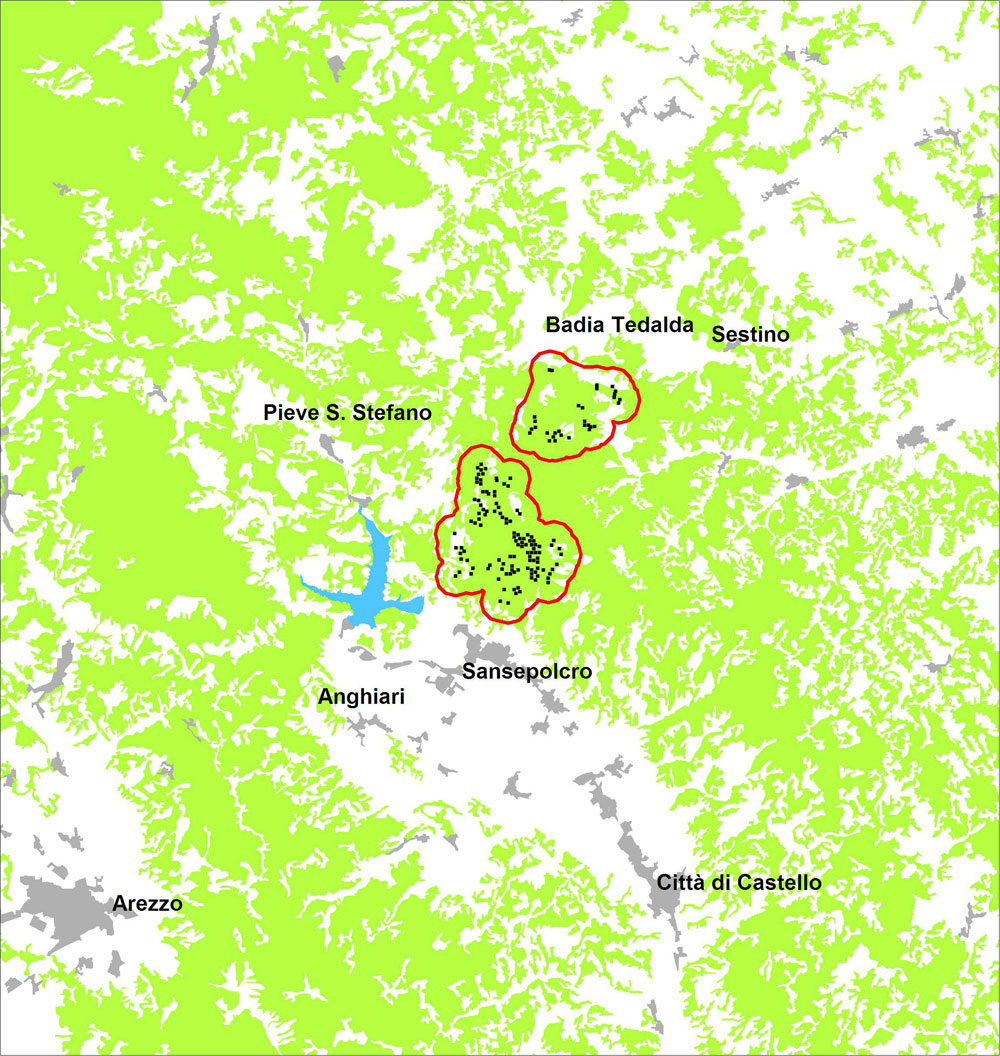
Lo studio ha riguardato i boschi puri o a prevalenza di cerro (Quercus cerris L.) dell’Alpe della Luna, situati sia sul versante occidentale, sia su quello orientale del massiccio omonimo, nella Valtiberina toscana (provincia di Arezzo). I rilievi sono stati condotti sia nelle cerrete del Complesso Forestale “Alpe della Luna”, di proprietà della Regione Toscana e gestito dalla Comunità Montana della Valtiberina ([19]), sia nelle cerrete di proprietà privata limitrofe al complesso forestale stesso (Fig. 1). Il contesto è un paesaggio con una matrice decisamente forestale e ambienti non forestali frammentati e molto ridotti in estensione (Fig. 2).
Fig. 1 - Area di studio e localizzazione spaziale a scala di dettaglio dei 149 punti di censimento, suddivisi tra cedui a regime (in esercizio) e cedui in conversione.
Fig. 2 - Localizzazione spaziale a scala vasta dei 149 punti di censimento (vedi Fig. 1).
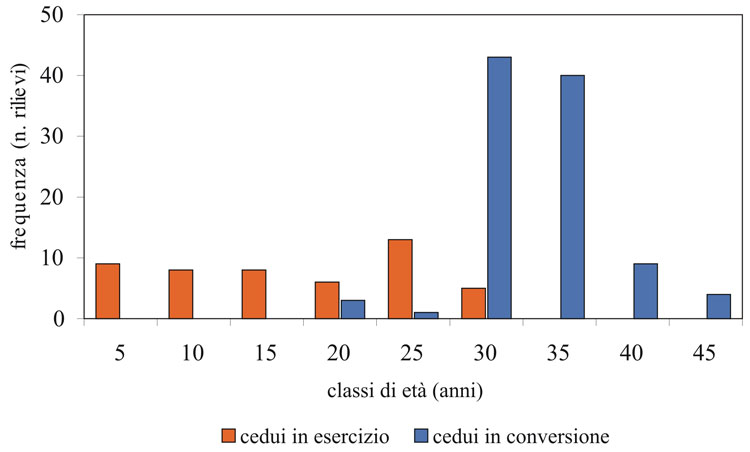
Le cerrete in conversione studiate sono tutte incluse nel Complesso Forestale “Alpe della Luna” e hanno una distribuzione in classi d’età che va dai 20 ai 45 anni, con una netta prevalenza dei soprassuoli delle classi 35 e 40 anni; il campione dei cedui a regime, quasi per intero ubicato nelle proprietà private limitrofe al complesso, comprende classi d’età dai 5 ai 30 anni (Fig. 3).
Fig. 3 - Distribuzione in classi d’età del bosco dei punti di censimento nei cedui in conversione e nei cedui a regime.
Raccolta e analisi dei dati
Il metodo utilizzato per il censimento dell’avifauna nidificante è quello delle stazioni puntiformi di ascolto ([11]), di durata 10 minuti; i rilievi sono stati eseguiti in giornate senza precipitazioni e con vento assente o debole (< 3 secondo la scala di Beaufort), nelle prime 3.5 ore dopo l’alba, dal 17 maggio al 21 giugno 2003. Tutte le stazioni di ascolto sono state georiferite e sono stati contati, in ciascuna di esse, tutti gli uccelli osservati e sentiti, escludendo soltanto quelli contattati a grande distanza (> 100 m), e le specie che si alimentano in ambiente aereo (Apodiformes e Hirundinidae).
Le stazioni di ascolto sono in totale 149, di cui 100 in cedui in conversione e 49 in cedui a regime, distanti tra loro almeno 200 m. Le stazioni dei due diversi gruppi (cedui in conversione e cedui a regime) sono distribuite in sistemi di paesaggio simili (quanto a dimensione delle patches e coefficiente di boscosità), così da minimizzare un eventuale effetto di altri parametri differenti da quelli determinati dalle due diverse forme di governo del bosco.
In prima istanza è stata confrontata la composizione specifica e la struttura dei popolamenti ornitici dei cedui in conversione e dei cedui in esercizio. Per la composizione specifica è stato utilizzato il test χ2 applicato alla frequenza relativa delle specie. Per quanto concerne la struttura, è stata analizzata la sola ricchezza, indice che funziona in genere molto bene almeno con gli uccelli ([23]). E’ stato considerato sia il numero complessivo di specie per punto, sia il numero di specie per punto appartenenti a tre raggruppamenti ecologici o guilds: specie forestali, specie non forestali e specie ubiquitarie, definiti in base alle conoscenze sull’ecologia degli uccelli in Appennino ([64]). Il gruppo delle specie forestali (F) comprende specie che si rinvengono generalmente esclusivamente in ambienti forestali; le specie non forestali (NB) sono quelle che non nidificano in ambienti formati da solo bosco, quelle ubiquitarie (UB) nidificano indifferentemente nel bosco e al di fuori di esso. Le due forme di gestione sono state confrontate mediante test parametrici (t di Student) e non parametici (U di Mann-Whitney), utilizzando questi ultimi dove le variabili non sono risultate normalmente distribuite (test di Kolmogorov-Smirnov) e la varianza non omogenea (test di Levene - cfr. [61], [72]). E’ stato inoltre considerato un indice di abbondanza utilizzando il numero complessivo di individui rilevati per punto, previa trasformazione in log[x+1] ([70]).
Allo scopo di verificare se le differenze nei parametri di struttura e abbondanza del popolamento ornitico tra i due tipi di bosco dipendessero anche da caratteristiche differenti del bosco e dalla sua collocazione nel paesaggio, sono stati elaborati alcuni modelli che includevano variabili in grado di descrivere anche questi aspetti. Sono stati applicati modelli GLM (Generalized Linear Models) che permettono di analizzare l’effetto di differenti variabili con una notevole elasticità e sono pertanto ampiamente impiegati nelle analisi ecologiche ([58]). E’ stata considerata una distribuzione poissoniana della variabile dipendente con una funzione link di tipo log, e scegliendo la migliore combinazione di variabili, cioè il modello migliore, in base al criterio di Akaike che permette di ottenere l’insieme di variabili di minor dimensione, mantenendo l’informazione contenuta nel modello ([48]). Le variabili considerate, calcolate per ciascuna stazione, sono: (i) l’età del soprassuolo, intrinseca al bosco; e (ii) la superficie di ambienti non forestali, riguardante il paesaggio in cui questo è inserito. L’età del soprassuolo, ricavata dal Piano di Gestione del Complesso Forestale “Alpe della Luna” per i cedui in conversione, rilevata direttamente per i cedui a regime, è misura diretta del grado di maturità del sistema, che condiziona in modo determinante struttura e composizione del popolamento di uccelli ([29], [40]). La superficie di ambienti non forestali, calcolata in due intorni circolari del punto (rispettivamente di 150 metri di raggio, pari a una superficie di 7.07 ha e 300 metri di raggio, pari a 28.27 ha), ha un effetto molto importante nel determinare la struttura e la composizione del popolamento di uccelli ([6], per l’Appennino [68]), soprattutto in paesaggi complessi come quelli mediterranei, dove molto strette sono le relazioni tra bosco ed altri elementi del paesaggio ([41]).
Risultati
Le specie rinvenute in quest’indagine sono state in totale 38 (Tab. 1). Per quanto riguarda la composizione del popolamento, il confronto ha riguardato 32 specie, mentre per sei specie i valori di frequenza sono risultati troppo bassi per procedere alle analisi. Su 14 specie forestali per le quali è stato possibile fare il confronto, otto (57.1%) mostrano differenze significative tra le due forme di governo; sette di queste (colombaccio, picchio rosso maggiore, fiorrancino, cinciarella, picchio muratore, rampichino comune e fringuello) hanno frequenza maggiore nei cedui in conversione, mentre una sola (luì piccolo) risulta più presente nei cedui a regime. Tra le specie di ambienti non forestali (11 poste a confronto), una soltanto (9.1%), lo zigolo muciatto, mostra una differenza significativa con maggiore frequenza nei cedui a regime. Tra le specie ubiquitarie (sette poste a confronto), due (28.6%), capinera e cinciallegra, registrano differenze significative, entrambe più frequenti nei cedui in conversione. In totale, nove specie risultano più frequenti nei cedui in conversione, due nei cedui a regime. Pertanto, la forma di governo della cerreta influenza la presenza di 11 specie su 32 (34.4%), sebbene siano poche le specie presenti esclusivamente in una delle due tipologie: nessuna è risultata esclusiva dei cedui a regime, quattro specie invece (sparviero, luì verde, picchio rosso minore e codirosso comune) sono state rinvenute solo nei cedui in conversione. Tutte queste quattro specie sono state rilevate con frequenze molto basse anche se, considerando la loro ecologia in Appennino ([67], [46], [53]), è verosimile una effettiva selezione per i boschi di maggiore sviluppo.
Tab. 1 - Elenco delle specie ornitiche rilevate. Le specie sono state raggruppate in tre gruppi ecologici (guild): (F): specie forestali; (NF): specie non forestali; (UB): specie ubiquitarie. Per ciascuna specie sono fornite: abbondanza (n. individui rilevati/10 stazioni) nei due tipi di bosco (abbFU per i cedui in conversione; abbCE per i cedui a regime); frequenza relativa (% di punti con presenza della specie) nei due tipi di bosco (F_FU per i cedui in conversione; F_CE per i cedui a regime), ed esiti dei confronti tra le suddette frequenze, mediante il test . (***): p<0.001; (**): p<0.01; (*): p<0.05; (ns): non significativo.
| Specie | Nome scientifico | guild | abbFU | abbCE | F_FU | F_CE | Confronto |
|---|---|---|---|---|---|---|---|
| Sparviero | Accipiter nisus | F | 0.2 | - | 2% | - | - |
| Colombaccio | Columba palumbus | F | 3.6 | 0.82 | 34% | 8% | *** |
| Scricciolo | Troglodydes troglodytes | F | 5.3 | 4.49 | 50% | 39% | ns |
| Pettirosso | Erithacus rubecula | F | 11.7 | 12.45 | 80% | 84% | ns |
| Tordo bottaccio | Turdus philomelos | F | 1.8 | 0.82 | 18% | 8% | ns |
| Lui’ bianco | Phylloscopus bonelli | F | 2.3 | 3.06 | 22% | 31% | ns |
| Lui’ verde | Phylloscopus sibilatrix | F | 0.7 | - | 7% | - | - |
| Lui’ piccolo | Phylloscopus collybita | F | 6.9 | 15.51 | 56% | 90% | *** |
| Fiorrancino | Regulus ignicapilla | F | 3 | 1.02 | 29% | 10% | * |
| Codibugnolo | Aegithalos caudatus | F | 8.2 | 10.2 | 41% | 49% | ns |
| Cincia bigia | Poecile palustris | F | 3.9 | 3.27 | 34% | 31% | ns |
| Cinciarella | Cyanistes caeruleus | F | 11.5 | 3.67 | 78% | 35% | *** |
| Fringuello | Fringilla coelebs | F | 13.3 | 2.04 | 78% | 20% | *** |
| Picchio rosso maggiore | Dendrocopos major | F | 3 | 1.02 | 27% | 10% | * |
| Picchio rosso minore | Dendrocopos minor | F | 0.6 | - | 6% | - | - |
| Picchio muratore | Sitta europaea | F | 4.7 | 0.82 | 38% | 8% | *** |
| Rampichino comune | Certhia brachydactyla | F | 4.6 | 0.82 | 43% | 8% | *** |
| Tortora selvatica | Streptopelia turtur | NF | 2.2 | 2.65 | 21% | 27% | ns |
| Tottavilla | Lullula arborea | NF | 2.6 | 3.67 | 22% | 29% | ns |
| Prispolone | Anthus trivialis | NF | 0.5 | 0.41 | 5% | 4% | - |
| Ballerina bianca | Motacilla alba | NF | 0.7 | 0.61 | 6% | 6% | ns |
| Codirosso | Phoenicurus phoenicurus | NF | 0.2 | - | 2% | - | - |
| Sterpazzolina di Moltoni | Sylvia subalpina | NF | 0.6 | 0.82 | 6% | 8% | ns |
| Rigogolo | Oriolus oriolus | NF | 1.3 | 1.63 | 13% | 16% | ns |
| Storno | Sturnus vulgaris | NF | 2.4 | 3.88 | 6% | 6% | - |
| Verzellino | Serinus serinus | NF | 0.7 | 1.22 | 7% | 10% | ns |
| Verdone | Carduelis chloris | NF | 1.3 | 1.22 | 12% | 12% | ns |
| Cardellino | Carduelis carduelis | NF | 1 | 1.22 | 9% | 8% | ns |
| Fanello | Carduelis cannabina | NF | 0.8 | 1.02 | 7% | 8% | ns |
| Zigolo nero | Emberiza cirlus | NF | 1.1 | 1.84 | 11% | 18% | ns |
| Zigolo muciatto | Emberiza cia | NF | 0.7 | 2.45 | 7% | 24% | ** |
| Poiana | Buteo buteo | UB | 0.6 | 0.82 | 6% | 8% | ns |
| Cuculo | Cuculus canorus | UB | 3 | 3.88 | 29% | 39% | ns |
| Picchio verde | Picus viridis | UB | 1.3 | 0.61 | 12% | 6% | ns |
| Merlo | Turdus merula | UB | 8.6 | 11.63 | 65% | 80% | ns |
| Tordela | Turdus viscivorus | UB | 2 | 1.63 | 19% | 16% | ns |
| Capinera | Sylvia atricapilla | UB | 12.6 | 8.37 | 89% | 67% | ** |
| Cinciallegra | Parus major | UB | 7 | 4.29 | 58% | 37% | * |
Per quanto riguarda la struttura dei popolamenti ornitici, ci sono differenze significative tra i due tipi di bosco per quasi tutti i parametri considerati (Tab. 2). Il popolamento nei cedui in conversione è significativamente più ricco considerando tutte le specie (ricchezza complessiva). In particolare è significativamente maggiore la ricchezza in specie forestali mentre la componente di specie non forestali non differisce tra le due forme di governo. Nei cedui in conversione anche l’abbondanza risulta significativamente maggiore rispetto ai cedui a regime.
Tab. 2 - Statistiche descrittive ed esiti dei confronti tra i due tipi di bosco per i principali parametri strutturali dei popolamenti ornitici. Per ricchezza complessiva e ricchezza in specie forestali sono presentate le medie e le deviazioni standard, per l’indice di abbondanza (numero di individui rilevati per punto) il confronto ha riguardato i valori trasformati in log[x+1] ([70]; [31]), ma vengono presentati medie e intervalli ± deviazione standard dopo trasformazione inversa. Per le ricchezza in specie non forestali, a causa della non normalità delle distribuzioni di frequenza, sono presentate le mediane (e l’intervallo interquartile del 50%). I primi tre confronti sono stati eseguiti mediante il test t (sui valori trasformati per l’indice di abbondanza), l’ultimo mediante il test U di Mann-Whitney.
| Indice | Cedui in conversione | Cedui a regime | Significatività |
|---|---|---|---|
| Ricchezza complessiva | 10.6 (± 2.95) | 8.61 (± 2.77) | 0.000 |
| Indice di abbondanza | 14.2 (10.9-18.4) | 11.8 (8.7-16.1) | 0.001 |
| Ricchezza in specie forestali | 6.43 (± 1.97) | 4.31 (± 1.43) | 0.000 |
| Ricchezza in specie non forestali | 1 (0-2) | 1 (0-2) | 0.173 |
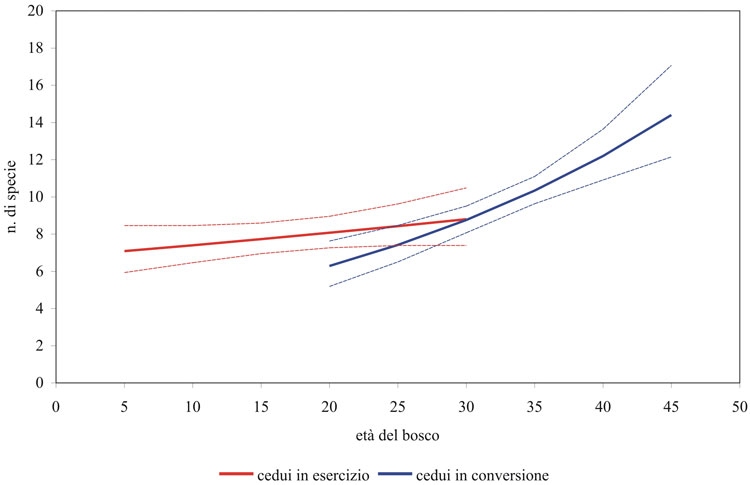
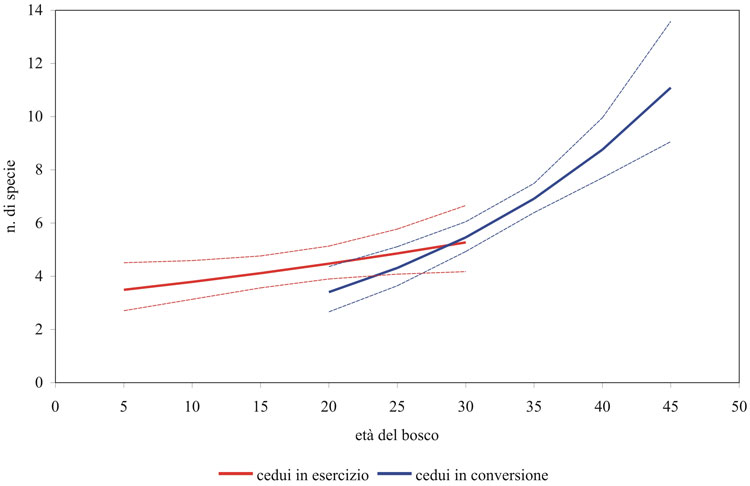
Nella Tab. 3 sono sinteticamente presentati i risultati dei modelli ecologici elaborati per verificare l’effetto di fattori differenti dalla forma di governo. I modelli elaborati per la ricchezza totale e per la ricchezza in specie forestali sono molto simili, se si eccettua l’effetto positivo della presenza di ambienti aperti, in questo caso entro un raggio di 150 metri, registrato solamente sul modello per il totale delle specie. In entrambi, l’effetto maggiore (positivo) è quello dell’età del bosco (popolamenti di uccelli più ricchi all’aumentare dell’età dei soprassuoli); l’effetto della tipologia di bosco “cedui in conversione” è negativo (cioè ci sono meno specie nei cedui in conversione rispetto ai cedui a regime), in apparente contrasto con i risultati dei confronti sui parametri di struttura, mentre la variabile composta “ceduo in conversione x età”, che entra nei modelli con un peso confrontabile rispetto a “cedui in conversione”, con effetto positivo, indica come all’aumentare dell’età i popolamenti più ricchi si trovano proprio nei cedui in conversione. Le Fig. 4 e Fig. 5 chiariscono l’effetto combinato di queste variabili evidenziando una ricchezza maggiore nei cedui a regime nella fascia di età compresa, indicativamente, tra i 20 e i 30 anni, quella cioè in cui sono rappresentate entrambe le tipologie di bosco ed è quindi possibile il confronto; la ricchezza aumenta in entrambi i casi all’aumentare dell’età ma lo fa in maniera decisamente maggiore nei cedui in conversione che arrivano poi ad ospitare popolamenti decisamente più ricchi.
Tab. 3 - Elenco delle variabili inserite nei quattro modelli ecologici realizzati per i parametri di struttura dei popolamenti ornitici. Per ciascun parametro è indicato il segno, positivo o negativo, dell’effetto, la statistica di Wald, indicativa dell’importanza relativa della variabile, e la significatività dell’effetto.
| Variabile dipendente | Parametro | Effetto | Stat. di Wald | p |
|---|---|---|---|---|
| Ricchezza complessiva | cedui in conversione | negativo | 8.081 | 0.004 |
| età | positivo | 21.08 | 0.000 | |
| aree aperte entro 150 m | positivo | 30.80 | 0.000 | |
| cedui in conversione x età | positivo | 7.431 | 0.006 | |
| Indice di abbondanza | cedui in conversione | positivo | 22.14 | 0.000 |
| aree aperte entro 150 m | positivo | 57.43 | 0.000 | |
| Ricchezza in specie forestali | cedui in conversione | negativo | 6.843 | 0.009 |
| età | positivo | 28.38 | 0.000 | |
| cedui in conversione x età | positivo | 6.598 | 0.010 | |
| Ricchezza in specie non forestali | aree aperte entro 150 m | positivo | 5.789 | 0.016 |
| aree aperte entro 300 m | positivo | 8.645 | 0.003 |
Fig. 4 - Andamento della ricchezza totale prevista dal modello rispetto all’età del bosco nei cedui a regime e in quelli in conversione. Sono riportati gli intervalli di confidenza al 95%.
Fig. 5 - Andamento della ricchezza in specie forestali prevista dal modello rispetto all’età del bosco nei cedui a regime e in quelli in conversione. Sono riportati gli intervalli di confidenza al 95%.
La ricchezza in specie non forestali, come del resto era logico attendersi, risulta positivamente influenzata dalla presenza di ambienti aperti, considerando sia un raggio di 150 metri che di 300 metri. Il modello relativo all’abbondanza evidenzia invece un effetto positivo dei cedui in conversione e, ancora, della superficie di ambienti aperti in un intorno di 150 metri di raggio.
Discussione
La struttura e la composizione del popolamento di uccelli nidificanti nelle cerrete sono risultate notevolmente differenti a seconda della forma di governo. In particolare, è evidente come i cedui in conversione ospitino popolamenti più ricchi e diversificati, sia che si prendano in considerazione tutte le specie di uccelli nidificanti, sia che si considerino solo le specie tipiche di ambienti forestali (Tab. 2). Tra queste ultime, una sola (luì piccolo) risulta più abbondante nei cedui a regime, mentre ben sette sono più frequenti nei cedui in conversione. La differenza tra i cedui in conversione e i cedui a regime che, in termini di composizione specifica si riassume in una maggior presenza di specie tipiche dell’ambiente forestale, non avviene comunque a scapito di altre specie (con l’eccezione del luì piccolo e, tra le specie non forestali dello zigolo muciatto), ma è un vero e proprio arricchimento determinato verosimilmente dal maggiore numero di nicchie ecologiche disponibili e, forse, anche da una maggiore stabilità del sistema. La tendenza ad ospitare comunità tanto più ricche e diversificate quanto più il bosco è maturo è del resto uno degli assunti classici dell’ecologia dei popolamenti di uccelli forestali ([29], [23]), che ha trovato anche conferma nelle recenti trasformazioni dei boschi in ambito appenninico ([66]). I risultati di questo studio dimostrano che anche boschi che si trovano ancora in una fase relativamente giovanile, come i cedui in conversione di questo studio di età sempre inferiore ai 50 anni (le fustaie di cerro sono considerate mature in senso selvicolturale a 100-120 anni e in senso biologico a età molto più avanzate - [10]), hanno comunque comunità ornitiche più ricche e diversificate rispetto a sistemi meno evoluti come sono i cedui a regime (Tab. 2). A conferma della maggiore complessità delle comunità di uccelli dei cedui in conversione si pone anche il fatto che le specie che si nutrono sui tronchi e nidificano in cavità (picchio rosso maggiore, picchio muratore, rampichino comune), tipiche e caratterizzanti anche nell’Appennino dei boschi maturi ([64], [66]), risultano in questo studio quasi assenti o marginalmente presenti nei cedui a regime, ma sono invece una componente significativa del popolamento nei cedui in conversione. A questo si può aggiungere anche la presenza del picchio rosso minore, anch’esso considerato specie forestale molto esigente ([65]), esclusiva dei cedui in conversione, dov’è stato rilevato con frequenze basse ma significative, data la sua relativa rarità ([12]).
La ricchezza del popolamento ornitico aumenta comunque all’aumentare dell’età anche nei cedui a regime, come rilevato anche in cedui di querce di altre aree della Toscana ([49]). I modelli evidenziano addirittura una maggiore ricchezza nei cedui a regime rispetto ai cedui in conversione nella fascia di età compresa indicativamente tra i 20 e i 30 anni, ovvero quella in cui compaiono entrambe le tipologie di bosco ed è quindi possibile il confronto (Fig. 4 e Fig. 5). Questa situazione deriva dal fatto che proprio in questa fascia di età i cedui a regime sono al termine del loro turno, e quindi indisturbati da molti anni, mentre i cedui in conversione hanno da poco subìto i tagli di avviamento che costituiscono evidentemente un fattore di disturbo. D’altro canto, tale disturbo si esaurisce nel giro di pochi anni, con la ricchezza che aumenta rapidamente fino a valori molto superiori a quelli raggiunti dai cedui a regime, anche al termine del turno. Le differenze tra le due forme di governo, al crescere dell’età dei cedui in conversione, sono quindi prevedibilmente destinate ad un notevole incremento.
Anche l’habitat, in particolare la presenza di ambienti non forestali in aree adiacenti, ha un effetto sulla ricchezza complessiva e anche sull’abbondanza. Tali parametri infatti risultano positivamente influenzati dalla compresenza in aree limitrofe di ambienti aperti ad una scala piuttosto ridotta (entro un raggio di 150 metri): come atteso, questo incremento riguarda in particolare le specie non forestali (Tab. 2), a conferma di quanto già riportato sempre sull’Appennino anche per altri tipi di bosco ([68]). Il dato più interessante in questo senso è però l’assenza di un effetto negativo degli ambienti non forestali (cioè della frammentazione del bosco) sulla presenza delle specie forestali, che sembra pertanto indipendente dall’estensione del bosco stesso. Questo dato, che contrasta nettamente con quanto noto sugli effetti della frammentazione del bosco in paesaggi caratterizzati da una boscosità residuale ([6]) e verificato anche in alcuni casi nell’Italia centrale ([9]), è invece in linea con quanto trovato in aree ad elevata boscosità ([59]), come ad esempio le colline della Toscana occidentale ([69]). Tale evidenza indica chiaramente l’importanza positiva (e solo positiva in termini di biodiversità, almeno di biodiversità ornitica) delle interruzioni nel manto forestale, che aumentando le nicchie disponibili favoriscono la presenza di specie di ambienti non forestali, ma allo stesso tempo non riducono la presenza di specie spiccatamente forestali.
Pare invece molto ridotta nell’area di studio l’importanza del ceduo a regime per il mantenimento di specie di uccelli non forestali, che sarebbero in grado di utilizzare le prime fasi seguenti il taglio periodico, come è ben documentato in altri contesti ([34], [32]), ma solamente supposto in ambienti mediterranei. Tra le specie di ambienti non forestali infatti, il solo zigolo muciatto sembra preferire i cedui a regime. Alcune osservazioni raccolte anche in altri contesti geografici ([67]) sembrano effettivamente dimostrare che in alcuni casi questa specie sia in grado di colonizzare i cedui durante le prime fasi seguenti l’utilizzazione. Se si considera che lo zigolo muciatto costruisce il nido a terra, in situazioni caratterizzate da una densa copertura erbacea, e che la sua alimentazione è costituita soprattutto da semi di Gramineae, si può supporre che la colonizzazione del ceduo sia subordinata alla presenza e allo sviluppo di un denso strato erbaceo, come ad esempio avviene nei cedui posti nelle stazioni più acclivi e meno fertili. Sebbene non siano state raccolte informazioni dettagliate sulla struttura del sottobosco nei siti indagati, anche nell’Alpe della Luna la specie frequenta proprio i cedui a regime (ma talvolta anche i cedui in conversione) situati nelle stazioni aventi queste caratteristiche.
I risultati di questo studio sembrano quindi indicare che, per quanto riguarda gli uccelli, per lo meno con le attuali forme di utilizzazione, i cedui a regime non siano affatto in grado di surrogare la scomparsa o il deterioramento degli ambienti non forestali, risultando idonei, a fronte di una decisa e inequivocabile ricchezza che caratterizza i popolamenti degli ambienti aperti dell’area studiata ([21]), al solo zigolo muciatto. E’ possibile che questa situazione non possa essere generalizzata, né a paesaggi ove il bosco occupa una parte minore del territorio, né a situazioni o epoche nelle quali l’uso multifunzionale del bosco e del paesaggio risultava più articolato. Quanto al primo punto, infatti, sebbene manchino specifici studi al riguardo, la presenza regolare di specie di arbusteto come l’usignolo (Luscinia megarhynchos) in boschi situati in paesaggi collinari dove la frammentazione del bosco è accentuata ([63]), sembra indirettamente confermare che in queste situazioni, il bosco può ospitare regolarmente specie di arbusteto, generalmente migratrici trans-sahariane, analogamente a quanto verificato in Gran Bretagna ([33]). Se poi, in questi contesti, la forma di utilizzazione del bosco abbia importanza decisiva nel regolare la presenza di queste specie, è un’ipotesi che rimane da dimostrare. Ancora più complessa appare l’analisi della situazione in epoche e contesti distanti nel tempo. E’ noto comunque che ancora oggi in aree europee dove l’uso multifunzionale del territorio è ancora attivo, i paesaggi sono in grado di ospitare popolamenti di uccelli straordinariamente ricchi di specie, sia forestali che non forestali ([57]). E’ verosimile che cedui a turno più frequente, inframmezzati da coltivazioni effimere e più o meno regolarmente pascolati, come dovevano essere in passato quelli dell’Appennino ([55], [71]), offrissero possibilità assai maggiori delle attuali alla colonizzazione di specie di uccelli non forestali. Indirettamente questa possibilitàè dimostrata dalle raccomandazioni ad adottare un turno relativamente breve ed ininterrotto per la conservazione della biodiversità nei cedui inglesi, sia per quanto concerne gli uccelli, ma soprattutto per la conservazione di emergenze floristiche ([33]).
Conclusioni
I risultati dell’indagine indicano chiaramente che, con le attuali forme di utilizzazione (turni lunghi ed assenza di uso multifunzionale del bosco), i cedui a regime hanno una minore capacità rispetto ai cedui in conversione di sostenere popolamenti di uccelli ricchi e diversificati (sia quanto a struttura e abbondanza, sia quanto a composizione specifica), almeno per quanto riguarda le cerrete in paesaggi caratterizzati da una elevata boscosità. Allo stesso tempo, i cedui a regime, con le modalità con cui sono oggi utilizzati, non paiono in grado di surrogare gli ambienti non forestali (pascoli, coltivi e arbusteti) come habitat per specie caratteristiche di questi ultimi. La presenza di specie non forestali è consentita, con una sola eccezione, solo dalla presenza di ambienti non forestali, la cui importanza in termini di contributo alla biodiversitàè quindi decisiva. In contesti come quello oggetto di studio, dove c’è una netta prevalenza del bosco, le specie non forestali non hanno comunque influenza negativa sulle specie forestali, nemmeno su quelle in altri contesti considerate più esigenti (interior species).
E’ interesse notare come, confrontando i cedui a regime al termine del turno di taglio con quelli in conversione che hanno da poco subito i tagli di avviamento, i primi ospitino un numero effettivamente maggiore di specie. Questa situazione, destinata come riportato sopra a mutare già dopo pochi anni, dovrebbe essere attentamente considerata quando si vuole confrontare l’effetto di differenti forme di gestione forestale sulla biodiversità; un disegno sperimentale che non tenesse conto di tali aspetti porterebbe evidentemente a conclusioni fuorvianti.
Data la valenza degli uccelli come indicatori ambientali e vista la loro sperimentata efficacia in questo senso in ambienti forestali ([35], [66]), queste conclusioni offrono utili indicazioni anche per una gestione dei boschi attenta alla conservazione della biodiversità. Sarebbe quindi auspicabile promuovere una conversione di boschi cedui in fustaie, almeno dove i primi risultano prevalenti, a conferma degli orientamenti generali per la selvicoltura nelle aree protette ([18]).
In conclusione, in paesaggi caratterizzati da una copertura forestale continua ed estesa, è solo attraverso la promozione di una selvicoltura che tenda a elevare il grado di diversità strutturale dei soprassuoli che si può mantenere livelli elevati di biodiversità.
References
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar