Germinazione dei semi e sopravvivenza dei semenzali di leccio (Quercus ilex L.) in interventi finalizzati alla rinaturalizzazione delle pinete di pino d’Aleppo (Pinus halepensis Mill.) dell’isola di Pianosa (Arcipelago Toscano, LI): risultati preliminari
Forest@ - Rivista di Selvicoltura ed Ecologia Forestale, Volume 11, Pagine 168-179 (2014)
doi: https://doi.org/10.3832/efor1053-011
Pubblicato: Set 16, 2014 - Copyright © 2014 SISEF
Articoli Scientifici
Abstract
Interventions aimed at promoting Quercus ilex spread in the Island of Pianosa (Tuscan Archipelago National Park) have been carried out within LIFE Nature Project “Tuscan Islands: new actions for sea birds and habitats”. In Pinus halepensis stands from afforestation, 810 acorns have been sown in 9 areas under the pine canopy with different presence of Mediterranean scrub. Germination and seedlings survival, five years after sowing, have been very satisfactory only in areas with a dense shrub layer.
Keywords
Introduzione
Nell’ambito del progetto LIFE Natura “Isole di Toscana: nuove azioni per uccelli marini ed habitat”, conclusosi in dicembre 2007, sono stati svolti alcuni interventi per favorire la diffusione del leccio (Quercus ilex L. 1753) mediante semina di ghiande raccolte da esemplari di leccio presenti sull’isola, finalizzati alla naturalizzazione delle pinete artificiali di pino d’Aleppo (Pinus halepensis Mill. 1768), solo in parte attualmente inquadrabili nell’habitat di interesse comunitario 9540 “Pinete mediterranee di pini mesogeni endemici” ([9]).
I meccanismi di germinazione delle ghiande e di sviluppo e sopravvivenza dei semenzali di leccio sono stati studiati da diversi Autori ([4], [12], [13], [23], [14], [15], [16], [11], [22], [3], [5]). La tecnica della semina diretta è una di quelle maggiormente indicate per il rimboschimento del leccio in stazioni ove è assente il rischio di gelate ([19], [20]).
Gómez ([15]), all’interno di un’area protetta sulla Sierra Nevada in Spagna, ha verificato che per la propagazione di Quercus ilex il seppellimento della ghianda sotto pochi centimetri di suolo ha permesso di ridurre significativamente il tasso di predazione e aumentare quelli di germinazione e di radicamento della plantula. Sempre Gómez ([15]), analizzando 5 tipologie stazionali (microhabitat), ha potuto verificare come all’interno di formazioni, anche artificiali, a dominanza di specie di Pinus sp. e in quelle arbustive (dei generi Prunus e Crataegus), tutte caratterizzate da condizioni elevate di ombreggiamento paragonabili a quelle di una lecceta, si raggiungessero le condizioni migliori per la germinazione, radicamento della plantula e accrescimento del semenzale, rispetto alle altre tipologie considerate (prateria con solo vegetazione erbacea/suffruticosa e lecceta).
Altrettanto significativi, ai fini del presente lavoro, sono i risultati emersi da una ricerca di Gómez-Aparicio et al. ([11]) che hanno permesso di separare, in un contesto mediterraneo caratterizzato da aridità estiva accentuata (Sierra Nevada, Spagna), gli effetti di tipo microclimatico (ombreggiamento, umidità relativa, ecc.) da quelli di tipo pedologico (contenuto sostanza organica, azoto, potassio, ecc.), entrambi esercitati dalla copertura della vegetazione arbustiva, sulla sopravvivenza di semenzali di leccio di un anno. Tali risultati evidenziano come la presenza degli arbusti (con specie appartenenti ai generi Salvia, Ulex e Santolina) abbia avuto effetti determinanti sulla sopravvivenza dei semenzali nei siti di impianto (artusteti vs. praterie) modificando, rispetto alle condizioni di assenza di copertura arbustiva, tanto le caratteristiche microclimatiche quanto quelle pedologiche per quanto riguarda il contenuto di potassio ([11]).
Sulla base anche delle esperienze riportate, lo scopo degli interventi descritti nel presente lavoro è stato duplice: (1) incrementare la diversificazione degli habitat forestali di origine artificiale, favorendo una maggiore stabilità agli ecosistemi presenti che, nel caso specifico di Pianosa, sono il risultato di una intensa e secolare pressione antropica; (2) valutare l’efficacia della semina diretta delle ghiande, quale tecnica semplice e poco costosa, all’interno di due differenti tipologie di pineta di pino d’Aleppo, entrambe ampiamente diffuse sull’isola: (a) pineta artificiale con sottobosco arbustivo rado o assente; (b) pineta artificiale con folta copertura del piano arbustivo.
Inquadramento dell’isola di Pianosa: geografia, geologia, condizioni climatiche e vegetazionali
L’isola di Pianosa ha un estensione di 1026 ha e dista circa 13 km dall’isola d’Elba e circa 57 km dalla costa tirrenica. Fa parte del Comune di Campo nell’Elba (Livorno) ed è interamente compresa all’interno del Parco Nazionale Arcipelago Toscano. È classificata anche come SIC (Sito d’Interesse Comunitario) ai sensi della Direttiva 92/43/CEE e come ZPS (Zona di Protezione Speciale) ai sensi della Direttiva 2009/147/CE. Ha una morfologia completamente piatta; la quota più elevata è di 29 metri (l’isolotto La Scola posto a circa 200 m da Pianosa raggiunge i 32 m). Le coste sono rocciose e prevalentemente basse sul lato orientale, mentre su gran parte dei restanti lati sono alte e strapiombanti. L’isola è costituita da rocce sedimentarie marine e continentali, prevalentemente di natura calcarea e fossilifera; i suoli sono superficiali, talvolta con affioramenti rocciosi ([1]). La disponibilità di acqua dolce superficiale è praticamente nulla e il clima è di tipo mesotermico e semiarido con una temperatura media annuale di 16.9 °C ([1]). I venti dominanti nel corso dell’anno sono quelli che spirano da sud e da nord; il libeccio, pur essendo il vento che spira a velocità più elevata, risulta poco frequente ([2]).
L’attuale fisionomia vegetazionale di Pianosa è il risultato di un’intensa pressione antropica che probabilmente raggiunse il suo apice negli anni ’80 del secolo scorso, quando sull’isola si arrivò al massimo livello di organizzazione ed efficienza della colonia penale e conseguentemente al massimo livello di sfruttamento agro-pastorale ([10]).
Attualmente, dopo oltre un decennio dall’interruzione di ogni tipo di attività agro-pastorale per la chiusura del carcere di massima sicurezza, la vegetazione di Pianosa è dominata dalla presenza di incolti in progressiva fase di chiusura che coprono circa il 50% della intera superficie dell’isola. La vegetazione a maggior grado di naturalitàè presente lungo la cintura costiera, interessata prevalentemente da fitocenosi attribuibili alla classe Crithmo-Limonietea Br. Bl. 1947, in cui l’endemismo Limonium planesiae Pignatti rappresenta una delle specie caratteristiche ([1]), e adiacente ad una fascia interna più o meno profonda in cui è presente una macchia a dominanza di Cistus sp. pl., Rosmarinus o/ficinale L., Arbutus unedo L., Juniperus phoenicea L,. inquadrabile in Rosmarino-Ericion Br. Bl. 1931 ([1]).
Sulla base della recente carta della vegetazione dell’isola di Pianosa redatta da Foggi et al. ([7]), le macchie basse a dominanza di rosmarino coprono circa il 13% della superficie; i mosaici di boscaglie interne o costiere con pino d’Aleppo, arbusti, suffrutici e pratelli il 12%; le formazioni artificiali pure di pino d’Aleppo il 10%; i mosaici di boscaglie a dominanza di ginepro fenicio altre tipologie di macchia mediterranea il 5%.
La presenza di Quercus ilex sull’isola è storicamente documentata. L’agronomo Fonseca nel 1880 scriveva che, ai tempi della visita di Napoleone I del 1814, l’isola “(…) era tutta boscosa, con piante di lecci, ulivi, qualche carrubo, fichi salvatici, lentischi, rosmarini e corbezzoli”. Analoghe considerazioni furono riportate già in precedenza da Zuccagni Orlandini ([27]) in merito a osservazioni probabilmente fatte negli anni ’30 dell’800, descrivendo la vegetazione di Pianosa con “albatri o corbezzoli, sondri o lentischi, lecci, anagiridi, sabine, qualche carrubo, molti rosmarini, grosse scille marittime, porri salvatici in quantità prodigiosa, e piante erbacee di numerose specie e varietà”. Lo stesso autore poi aggiunge che “Non manca a Pianosa il terreno boschivo: in esso i corbezzoli, e i lentischi sono arborei; i lecci stessi non restano piccoli e imbastarditi come all’Elba. Sembra che in antico vi fossero molti pini, poiché un appezzamento di terreno ne serba il nome, ma ne restava una sola pianta e fu tagliata”.
Quasi mezzo secolo più tardi, stando sempre a quanto riportato da Fonseca ([8]), l’isola aveva già perso quasi del tutto ogni formazione arborea spontanea, tanto che l’uso del suolo era così definito:
- Terreno seminativo nudo (ha 218.99)
- Vigna (ha 108.26)
- Orti e giardino (ha 10.46)
- Macchie di lentischi, rosmarini, corbezzoli e ulivi (ha 575.47)
- Terreni rocciosi con poche piante di lentisco (ha 55.65)
- Fabbricati, strade e muri (ha 11.17)
Le uniche piante a portamento arboreo rimaste erano dunque gli ulivi selvatici, che ai tempi di Napoleone I erano stimati in oltre 20 mila esemplari e che invece nel 1880 erano ridotti a circa 3000 a causa dell’intenso uso come legna da ardere “(…) per la cottura di quei mattoni di cui buona parte furono spediti in Sardegna con poco o nessun utile dell’Amministrazione”, come ebbe a lamentarsi l’agronomo. Di tutte le piante di leccio ancora presenti fino agli inizi del XIX sec. ne era rimasta soltanto una all’interno del podere di Sembolello, forse salvatasi dal taglio solo perché di notevoli dimensioni. L’assenza di vegetazione arborea sull’isola aveva condotto all’insorgere di non pochi problemi nei confronti delle coltivazioni e dei pascoli per effetto dell’aumento dell’esposizione delle colture ai venti marini con conseguenti disseccamenti e calo delle produzioni. Il problema, ben lungi dall’essere risolto, fu affrontato nel 1876 dalla Direzione della colonia penale mediante un intervento a carattere sperimentale e molto oneroso in termini economici, consistente nella piantagione di 23 000 m2 di piante “da bosco” appartenenti a specie non meglio precisate (probabilmente lecci e pini d’Aleppo Pinus halepensis). La localizzazione di questo impianto ci è sconosciuta, ma potrebbe in parte coincidere con quella attualmente occupata dalla lecceta più estesa e vecchia dell’isola, presente nei pressi del Cardon con una estensione di circa 4000 m2. Di tale nucleo, la cui origine artificiale è facilmente desumibile dalla regolarità nella disposizione delle piante, non si conosce l’età ma già nel 1945 (foto aeree dell’I.G.M.) appare essere densa e ben strutturata.
Nel resto dell’isola, il leccio è oggi presente in altri 3 settori: in località Belvedere con un modestissimo nucleo e alcune piante sparse tra vecchi ulivi, in alcune piccole aree poste tra Cala del Bruciato e Punta Secca (in località“Poggio alla Quercia”) e, infine, all’interno di un vivaio abbandonato dove risultano ancora presenti alcune file di esemplari ancora giovani, coltivati a scopo di rimboschimento ma mai utilizzati. Gli esemplari di leccio presenti in questi settori risultano tutti di modeste dimensioni, con produzione scarsa di seme e di piccola taglia. Gli esemplari più grossi (la cui altezza comunque è quasi sempre dell’ordine dei 5-6 metri) sono polloni ricresciuti da precedenti interventi di taglio. L’origine di questi nuclei è per il momento dubbia. Infatti, sebbene il toponimo “Poggio alla quercia” suggerisca qui una presenza remota del leccio, da un primo esame sembrerebbe che la disposizione di gran parte delle piante sia regolare e perciò frutto di un impianto.
Per quanto esposto, si ritiene di poter ragionevolmente considerare autoctona la presenza del leccio sull’isola pur nell’incertezza che riguarda l’origine dei nuclei attualmente presenti che potrebbero essere stati propagati tanto con seme locale quanto con seme proveniente dall’Elba o dal continente. L’esigenza di ripristinare, su almeno una parte dell’isola, l’originaria copertura a macchia-foresta di leccio è tale da suggerire l’utilizzo dell’unico seme disponibile in loco anche se di incerta provenienza.
Il leccio è una specie che possiede dispersione barocora (per gravità) e zoocora (per diffusione animale). Questa seconda modalitàè la più rilevante perché è quella che consente a questa specie di recuperare in tempi relativamente brevi le aree perdute per cause antropiche o naturali. Tuttavia la diffusione delle ghiande è affidata esclusivamente ad animali che risultano assenti dall’isola di Pianosa: principalmente la ghiandaia (Garrulus glandarius) e, secondariamente, alcune specie di micromammiferi come, ad esempio, Apodemus sylvaticus ([12], [14], [15]). Risulta pertanto impossibile per il leccio, se non in tempi millenari, recuperare una parte significativa degli spazi perduti senza una azione antropica diretta e compensatrice.
L’intervento di semina delle ghiande di leccio: materiali e metodi
Nell’autunno del 2006 è stato eseguito un intervento preliminare di semina delle ghiande per verificare l’esistenza di una eventuale predazione delle ghiande da parte del ratto nero (Rattus rattus), già riscontrata in modo evidente sull’isola di Giannutri (Sposimo, com. pers.) ed evidenziata anche per altri casi ([19], [12], [15]). La sperimentazione con 300 ghiande distribuite sulla lettiera in 10 plot, di cui la metà protetti da una rete plastica a maglia di 2 cm, ha fornito un tasso di predazione nullo.
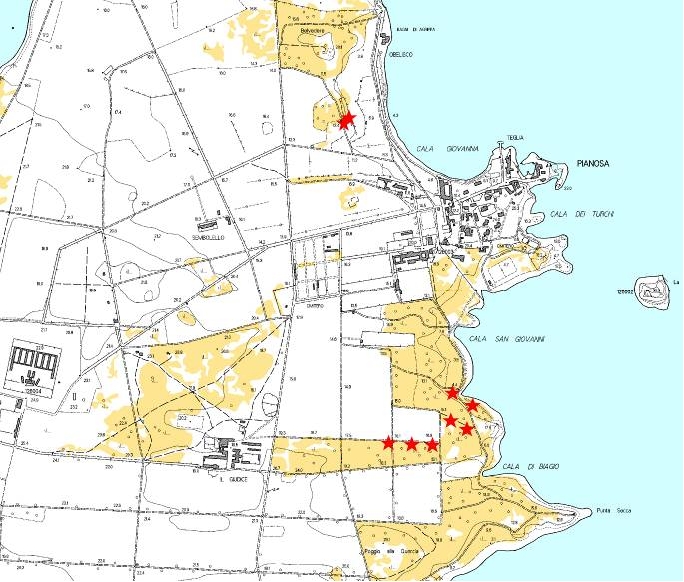
Nell’autunno 2007, si è pertanto proceduto alla raccolta e semina di 810 ghiande in 9 stazioni in ognuna delle quali sono state collocate 90 ghiande distribuite a gruppi di 3, sotto 3-4 cm di terreno, simulando in questo modo la dispersione di Garrulus glandarius, come già sperimentato da Gó mez ([15] - Fig. 1 e Fig. 2).
Fig. 2 - Localizzazione delle 9 stazioni di semina del leccio. In marrone chiaro sono indicate le aree occupate da pinete artificiali di pino d’Aleppo.
Le ghiande raccolte avevano un peso medio di 2.61 grammi. Diverse esperienze hanno provato a dimostrare una correlazione tra il peso dei semi e il tasso di germinazione, arrivando però a risultati contrastanti ([26], [16], [24], [25], [5]).
Nell’ambito del presente lavoro si è deciso di non prendere in considerazione il peso delle singole ghiande quale variabile da valutare in relazione del tasso di germinazione.
Nella Tab. 1 sono sintetizzate le caratteristiche stazionali su cui è stato eseguito l’impianto. Le prime 4 stazioni sono di pineta pura con assenza di specie arbustive. Le stazioni 1 e 2 sono classificabili nella fase di spessina, sebbene l’impianto risalga agli anni ’70. La semina del leccio è stata eseguita su suolo poco ombreggiato (copertura delle chiome tra il 30 e il 70%). Le stazioni 3 e 4 sono qualificabili come fustaie giovani, derivanti da impianti degli anni ’60; la semina è stata eseguita sotto copertura delle chiome quasi completa (copertura 80-100%).
Tab. 1 - Caratteristiche stazionali dei siti di impianto.
| Stazione | Caratteristiche del soprassuolodi pino d’Aleppo | Coperturachiome | Piano arbustivo |
|---|---|---|---|
| 1 | Spessina di circa 40 anni. La semina è stata eseguita in un interfilare | 30-50% | Assente |
| 2 | Spessina di circa 40 anni. La semina è stata eseguita in una chiaria di piccole dimensioni | 30-50% | Copertura < 10% (Pistacia lentiscus) |
| 3 | Fustaia giovane di pino di circa 50 anni a densità colma | 80-100% | Assente |
| 4 | Fustaia giovane di pino di circa 50 anni a densità colma | 80-100% | Assente |
| 5 | Fustaia diradata di pino di circa 50 anni | 50-80% | Copertura > 60% (Rosmarinus officinalis e Pistacia lentiscus) |
| 6 | Fustaia diradata di pino di circa 50 anni | 50-80% | Copertura > 60% (Pistacia lentiscus) |
| 7 | Fustaia diradata di pino di circa 50 anni | 50-80% | Copertura > 60% (Pistacia lentiscus) |
| 8 | Fustaia diradata di pino di circa 50 anni | 30-50% | Copertura 40-50% (Rosmarinus officinalis e Pistacia lentiscus) |
| 9 | Fustaia diradata di pino di circa 50 anni | 50-80% | Copertura > 60% (Pistacia lentiscus) |
Le altre 5 stazioni sono di pineta più rada, risultato di impianti degli anni ’60 ma su cui sono stati eseguiti alcuni interventi di diradamento che hanno favorito l’ingresso massiccio di specie della macchia mediterranea (principalmente Pistacia lentiscus L. e Rosmarinus officinalis L.). Qui le aree di semina sono localizzate sotto copertura intermedia (50-80%) del piano arboreo, ad eccezione della stazione 8 caratterizzata da copertura scarsa (30-50%), a cui si è ampiamente sovrapposta la copertura del piano arbustivo (quasi sempre superiore al 60%).
La germinazione e la successiva sopravvivenza delle plantule nelle diverse stazioni (con o senza piano arbustivo) sono state testate mediante il test t di Student.
Le differenze tra le altezze delle varie plantule è stata esaminata, per i due gruppi di stazioni (1-4 vs. 5-9), attraverso un’analisi della varianza (ANOVA) utilizzando il software R ver. 3.02 ([21]) e, tra tutte le diverse stazioni, mediante i grafici di tipo box-plots e l’analisi con il test post-hoc di Kruskal-Wallis, metodo non parametrico per verificare l’uguaglianza delle mediane di diversi gruppi ([17]).
Risultati
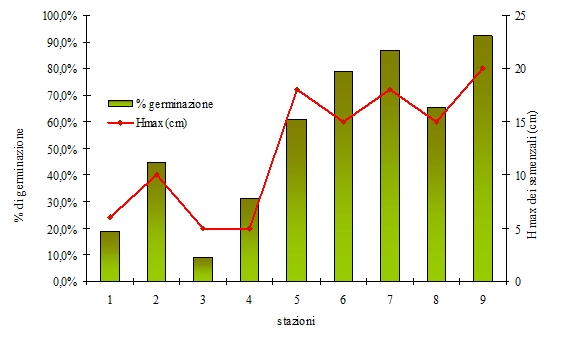
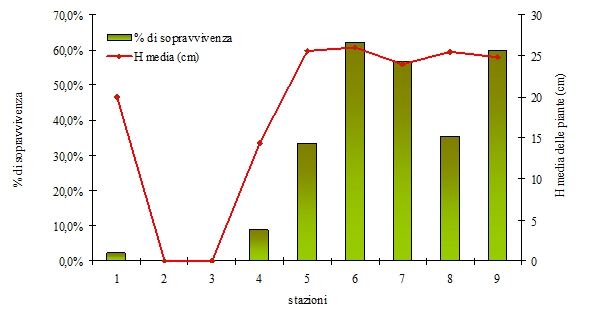
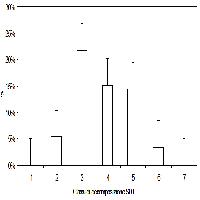
I risultati della semina, valutati a 9 mesi di distanza (luglio 2008), sono sintetizzati nella Tab. 2 e nell’istogramma in Fig. 3. L’analisi dello stato delle giovani piante a giugno 2012 è invece riportata in Tab. 3 e Fig. 4.
Tab. 2 - Risultati a luglio 2008 a distanza di 9 mesi dalla semina delle ghiande. (*): plantule germinate ma seccate successivamente.
| Staz. | Gruppi di germinazione | N plantule germinate |
Plantule seccate* |
Germinazione (%) |
Sopravvivenza (%) |
H max (cm) |
||
|---|---|---|---|---|---|---|---|---|
| 1 plantula | 2 plantule | 3 plantule | ||||||
| 1 | 1 | 2 | 4 | 17 | - | 18.9 | 18.9 | 6 |
| 2 | 7 | 9 | 5 | 40 | - | 44.4 | 44.4 | 10 |
| 3 | 4 | 2 | - | 8 | - | 8.9 | 8.9 | 5 |
| 4 | 5 | 5 | 4 | 27 | 1 | 31.1 | 30 | 5 |
| 5 | 2 | 5 | 14 | 54 | 1 | 61.1 | 60 | 18 |
| 6 | - | 1 | 23 | 71 | - | 78.9 | 78.9 | 15 |
| 7 | 3 | 4 | 22 | 77 | 1 | 86.7 | 85.6 | 18 |
| 8 | - | 6 | 15 | 57 | 2 | 65.6 | 63.3 | 15 |
| 9 | - | 4 | 25 | 83 | - | 92.2 | 92.2 | 20 |
Tab. 3 - Risultati a giugno 2012. (*): Sopravvivenza percentuale rispetto al 2008.
| Staz. | Gruppi di germinazione | N. Tot Semenzali | Sopravvivenza* (%) | Sopravvivenza Tot.(%) | H media (cm) |
H max (cm) |
||
|---|---|---|---|---|---|---|---|---|
| 1 plantula | 2 plantule | 3 plantule | ||||||
| 1 | - | 1 | - | 2 | 11.8 | 2.2 | 20 | 27 |
| 2 | - | - | - | 0 | 0 | 0 | - | - |
| 3 | - | - | - | 0 | 0 | 0 | - | - |
| 4 | 2 | 3 | - | 8 | 29.6 | 8.9 | 14 | 22 |
| 5 | 4 | 7 | 4 | 30 | 55.6 | 33.3 | 26 | 51 |
| 6 | - | 7 | 14 | 56 | 78.9 | 62.2 | 26 | 54 |
| 7 | 4 | 7 | 11 | 51 | 66.2 | 56.7 | 24 | 59 |
| 8 | 3 | 4 | 7 | 32 | 56.1 | 35.6 | 25 | 49 |
| 9 | 3 | 9 | 11 | 54 | 65.1 | 60 | 25 | 55 |
Fig. 4 - Risultati di sopravvivenza delle piantine di leccio a cinque anni dalla semina (giugno 2012).
I risultati dimostrano in modo evidente come i semi abbiano germinato in percentuale diversa nelle stazioni appartenenti ai due gruppi distinti sulla base della presenza/assenza del piano arbustivo (stazioni 1-4 vs. 5-9).
L’analisi statistica dei 9 campioni suddivisi in 2 gruppi (stazioni con o senza piano arbustivo) ha evidenziato, mediante il test t di Student, una differenza molto significativa per il 2008 (Tab. 4). La stessa analisi, effettuata sui risultati al 2012, evidenzia differenze altrettanto significative (Tab. 5).
Tab. 4 - Differenze statistiche tra i due gruppi di stazioni (1-4 e 5-9) analizzate con il test t di Student (situazione a luglio 2008). (STD): Deviazione standard; (SE): errore standard.
| Staz. | N. plantule germinate |
Media | STD | SE | Prob |
|---|---|---|---|---|---|
| 1 | 17 | 23 | 13.74 | 6.87 | 0.00129 |
| 2 | 40 | ||||
| 3 | 8 | ||||
| 4 | 27 | ||||
| 5 | 54 | 68.4 | 12.56 | 5.62 | |
| 6 | 71 | ||||
| 7 | 77 | ||||
| 8 | 57 | ||||
| 9 | 83 |
Tab. 5 - Differenze statistiche tra i due gruppi di stazioni (1-4 e 5-9) analizzate con il test t di Student (situazione a giugno 2012). (STD): Deviazione standard; (SE): errore standard.
| Staz. | N. semenzali | Media | STD | SE | Prob |
|---|---|---|---|---|---|
| 1 | 2 | 2.5 | 3.79 | 1.89 | 0.00037 |
| 2 | 0 | ||||
| 3 | 0 | ||||
| 4 | 8 | ||||
| 5 | 30 | 44.6 | 12.56 | 5.62 | |
| 6 | 56 | ||||
| 7 | 51 | ||||
| 8 | 32 | ||||
| 9 | 54 |
I dati relativi all’accrescimento medio delle piantine, sono riportati in Tab. 6.
Tab. 6 - Altezze medie delle piantine suddivise per stazione e per numero di individui presenti in ogni buchetta (giugno 2012).
| Stazione | Altezza media (cm) | Media tot. |
N. totale piantine |
||
|---|---|---|---|---|---|
| 1 | 2 | 3 | |||
| 1 | - | 20 | - | 20 | 2 |
| 2 | - | - | - | - | 0 |
| 3 | - | - | - | - | 0 |
| 4 | 19.5 | 12.7 | 26.8 | 14.4 | 8 |
| 5 | 24.5 | 24.9 | - | 25.5 | 30 |
| 6 | - | 29.6 | 24.9 | 26 | 56 |
| 7 | 30 | 23 | 23.9 | 24 | 51 |
| 8 | 23.3 | 26.3 | 25.6 | 25.5 | 32 |
| 9 | 26 | 31.9 | 20.1 | 24.9 | 54 |
| Media tot. | 25.4 | 26.2 | 23.8 | 24.7 | 233 |
| n. | 16 | 76 | 141 | 233 | - |
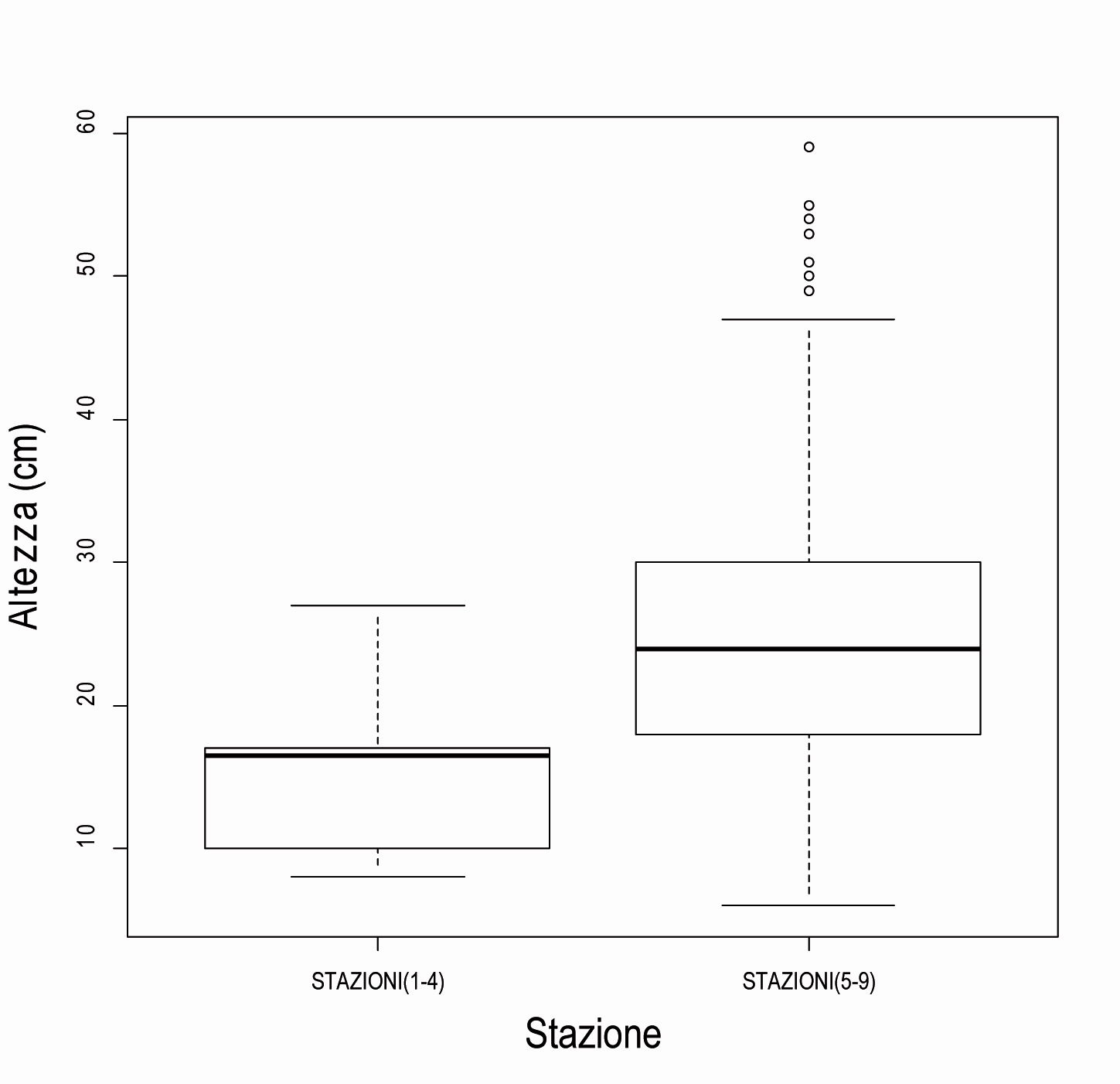
Le altezze medie nelle stazioni 1-4 si attestano a 15.5 cm (n = 10) mentre in quelle 5-9 a 25.1 (n = 223).
L’analisi delle altezze medie condotta attraverso una analisi della varianza (ANOVA) ha evidenziato differenze significative tra i due gruppi di stazioni (P<0.01, si veda Tab. 7 e Fig. 5).
Tab. 7 - Risultati dell’analisi della varianza per le differenze tra le medie delle altezze nelle due macrotipologie stazionali.
| Componente | df | Sum of Squares |
Mean Square |
F value | Pr (>F) |
|---|---|---|---|---|---|
| Stazione | 1 | 886.7 | 886.75 | 8.7827 | 0.003359 |
| Residui | 231 | 23323 | 100.97 | - | - |
Fig. 5 - Variazione dei valori di altezza (cm) nelle due macrotipologie stazionali. Tratto centrale: mediana, Box: 25-75%, baffi: 10-90%, o: estremi; p<0.01 in seguito a ANOVA sulle medie.
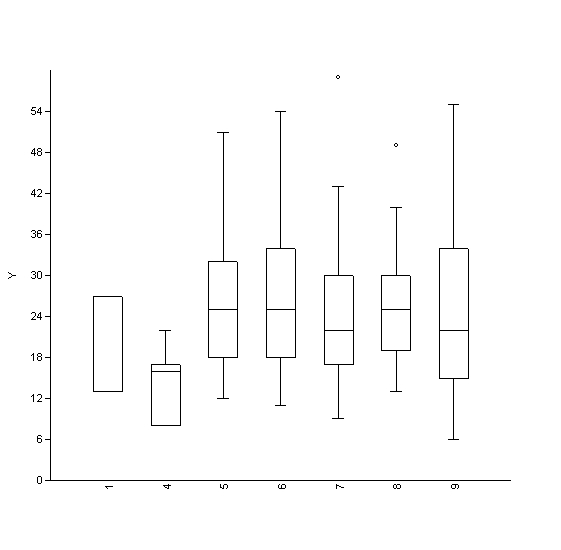
Le plantule della stazione 4 hanno avuto il minor accrescimento rispetto a tutte le altre (Fig. 6); tale variazione risulta significativa (Tab. 8) sulla base del test di Kruskal-Wallis.
Fig. 6 - Grafico box-plot che mostra la variazione del tasso di accrescimento delle varie plantule per le 7 stazioni rimaste a giugno 2012.
Tab. 8 - Risultati del test di Kruskal-Wallis, significativi solo per la stazione 4. (*): p<0.05; (**): p<0.01; (***): p<0.001.
| 0 | 1 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|
| 1 | 0 | 0.5139 | 0.5081 | 0.3596 | 0.544 | 0.3231 | 0.6749 |
| 4 | - | 0 | 0.0025** | 0.0009*** | 0.0055** | 0.0017** | 0.0162* |
| 5 | - | - | 0 | 0.6343 | 0.4998 | 0.8053 | 0.5979 |
| 6 | - | - | - | 0 | 0.2323 | 0.8385 | 0.3224 |
| 7 | - | - | - | - | 0 | 0.3471 | 0.9923 |
| 8 | - | - | - | - | - | 0 | 0.4476 |
| 9 | - | - | - | - | - | - | 0 |
Discussione
I risultati esposti consentono di sviluppare alcune ipotesi sui fattori stazionali che hanno influenzato sia la germinabilità delle ghiande che la successiva crescita dei semenzali.
Il tasso medio di germinazione raggiunto nelle 9 stazioni è pari al 53.6% e sale al 76% se si considerano solo quelle con sottobosco arbustivo (stazioni 5-9). Questi valori sono in linea con le percentuali di germinazione indicate da Piotto & Di Noi ([19]), inferiori rispetto a quelli ottenuti in ambiente controllato da Reyes & Casal ([22]) e Caliskan ([5]), ma più elevati rispetto a quanto verificato da Gómez ([15]) nelle stazioni migliori e da Broncano et al. ([4]).
I semenzali sopravvissuti al quarto anno di età sono il 28.8% di quelli seminati e il 53.7% di quelli germinati, che diventano rispettivamente il 49.6% e 65.2% se si considerano solo le stazioni con sottobosco arbustivo. Tale dato appare molto elevato rispetto a quanto verificato da Gómez ([15]), che nelle stazioni migliori di semina (pinete e arbusteti) ha raggiunto tassi di sopravvivenza dei semenzali (a 2 anni) pari al 10-15% circa delle ghiande seminate.
Il tasso di mortalità registrato tra il 2012 e il 2008 è stato dell’89% nelle stazioni senza arbusti (1-4) ma un utile confronto può essere fatto considerando la percentuale media di copertura delle chiome, ovvero tra le stazioni con minore copertura (stazioni 1 e 2; Fig. 7 - mortalità pari al 96%) e quelle a copertura quasi colma anche se priva di arbusti (stazioni 3 e 4; Fig. 8 - mortalità pari al 77%). I valori di mortalità appaiono molto elevati in entrambi i casi se confrontati con quelli riportati, ad esempio, da Broncano et al. ([4]) i quali registrano tassi di mortalità in condizioni di forte luminosità al suolo pari a circa il 50% e, in condizione di ombreggiamento controllato, pari a circa il 10%. Pertanto il fattore “luce” non è apparso, nel caso esaminato, il solo ad aver influito sulla sopravvivenza dei semenzali sebbene sia noto come l’ombreggiamento favorisca la sopravvivenza dei semenzali di leccio nei primi anni di vita (si veda [4], [18], [15]).
La presenza di arbusti (Fig. 9) è apparsa invece un fattore determinante per la sopravvivenza dei semenzali di leccio in pieno accordo con quanto verificato da Gómez-Aparicio et al. ([11]), i quali hanno potuto verificare come le specie arbustive favorissero il mantenimento di un microclima più idoneo nei mesi di siccità estiva e contribuissero significativamente all’aumento del contenuto di potassio al suolo (elemento che migliora l’efficienza di assorbimento idrico in condizioni di siccità) (Fig. 10).
La presenza di un piano arbustivo potrebbe ragionevolmente essere messa in relazione anche con un maggior contenuto di sostanza organica al suolo. D’Acqui et al. ([6]) hanno rilevato nell’isola di Pianosa che il suolo delle pinete possiede un contenuto di carbonio organico in media significativamente inferiore a quello contenuto nel suolo posto sotto copertura delle specie arbustive di macchia mediterranea.
Conclusioni
Le modalità di semina mediante collocazione delle ghiande sotto 2-4 cm di suolo hanno dato risultati ottimali in relazione ai tassi di germinazione e sopravvivenza di semenzali di leccio riportati in letteratura.
Le condizioni stazionali hanno giocato un ruolo decisivo anche nei primi anni di crescita dei semenzali e non solo durante la fase germinativa del seme e attecchimento della plantula. Questo dato trova conferma nel tasso di mortalità dei semenzali nei quattro anni tra luglio 2008 e giugno 2012 che è perfettamente in linea con il tasso di germinazione e attecchimento registrato nella prima fase. Le quattro stazioni in cui si sono registrati i più bassi tassi di germinazione sono state poi caratterizzate dai più alti tassi di mortalità. Al contrario, le altre cinque stazioni, sebbene a differenti livelli tra loro, hanno mantenuto elevati tassi di sopravvivenza anche nella seconda fase.
Per eventuali futuri interventi di semina potrà convenire seminare una sola ghianda per buchetta, anziché tre, così da aumentare la superficie di intervento a parità di seme raccolto.
Al fine di accelerare lo spontaneo processo di colonizzazione arbustiva all’interno degli impianti puri di pino, si ritiene necessario effettuare diradamenti nelle formazioni più dense e compatte. Tali interventi oltre ad avere l’indubbio vantaggio di migliorare la naturalità dei soprassuoli e accelerare la crescita degli esemplari arborei che non cadranno al taglio, consentirà di ridurre notevolmente il rischio di incendio e, equilibrando i rapporti interspecifici tra le varie specie mediterranee, aumentare la stabilità dell’ecosistema.
Ringraziamenti
Si desidera ringraziare il Parco Nazionale Arcipelago Toscano per aver permesso lo svolgimento degli interventi, il dott. Lorenzo Lazzaro e i referee anonimi per gli utili suggerimenti alla stesura del manoscritto.
Bibliografia Citata
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar