Phenology and distribution of Italian populations of Thaumastocoris peregrinus Carpintero and Dellapé (Heteroptera: Thaumastocoridae)
Forest@ - Journal of Silviculture and Forest Ecology, Volume 11, Pages 105-115 (2014)
doi: https://doi.org/10.3832/efor1184-011
Published: Jun 06, 2014 - Copyright © 2014 SISEF
Short Communications
Abstract
Phenology and distribution of Italian populations of Thaumastocoris peregrinus Carpintero and Dellapé (Heteroptera: Thaumastocoridae). Thaumastocoris peregrinus Carpintero & Dellapè (Heteroptera: Thaumastocoridae) was detected for the first time in Italy in September 2011, on several Eucalyptus species and hybrids. This pest, native of Australia, was the first species of the family Thaumastocoridae found in Europe. In this paper we report data on its current distribution in Italy, where the species is present in Lazio, Campania and Tuscany. Phenological studies allowed to detect the presence of eggs, preimaginal stages and peaks of the flight of the adults. No diapausing stage were detected.
Keywords
Bronze Bug, Eucalyptus spp., Invasive Species, Biology, Natural Enemies
Introduzione
Nel settembre 2011, in diverse località del Lazio sono stati individuati piccoli focolai e, in qualche caso, imponenti infestazioni di Thaumastocoris peregrinus Carpintero & Dellapé (Heteroptera: Thaumastocoridae), la “Cimicetta della Bronzatura dell’Eucalitto” ([21], [22]). La specie è l’unico rappresentante della famiglia dei Thaumastocoridae finora segnalata per l’Europa e il Bacino del Mediterraneo, e per l’elevata dannosità a carico di diverse specie di Eucalyptus, compresi gli ibridi interspecifici, e su Corymbia citriodora subsp. citriodora ([34]), è stata recentemente inserita tra le specie da quarantena dell’European and Mediterranean Plant Protection Organization ([12]).
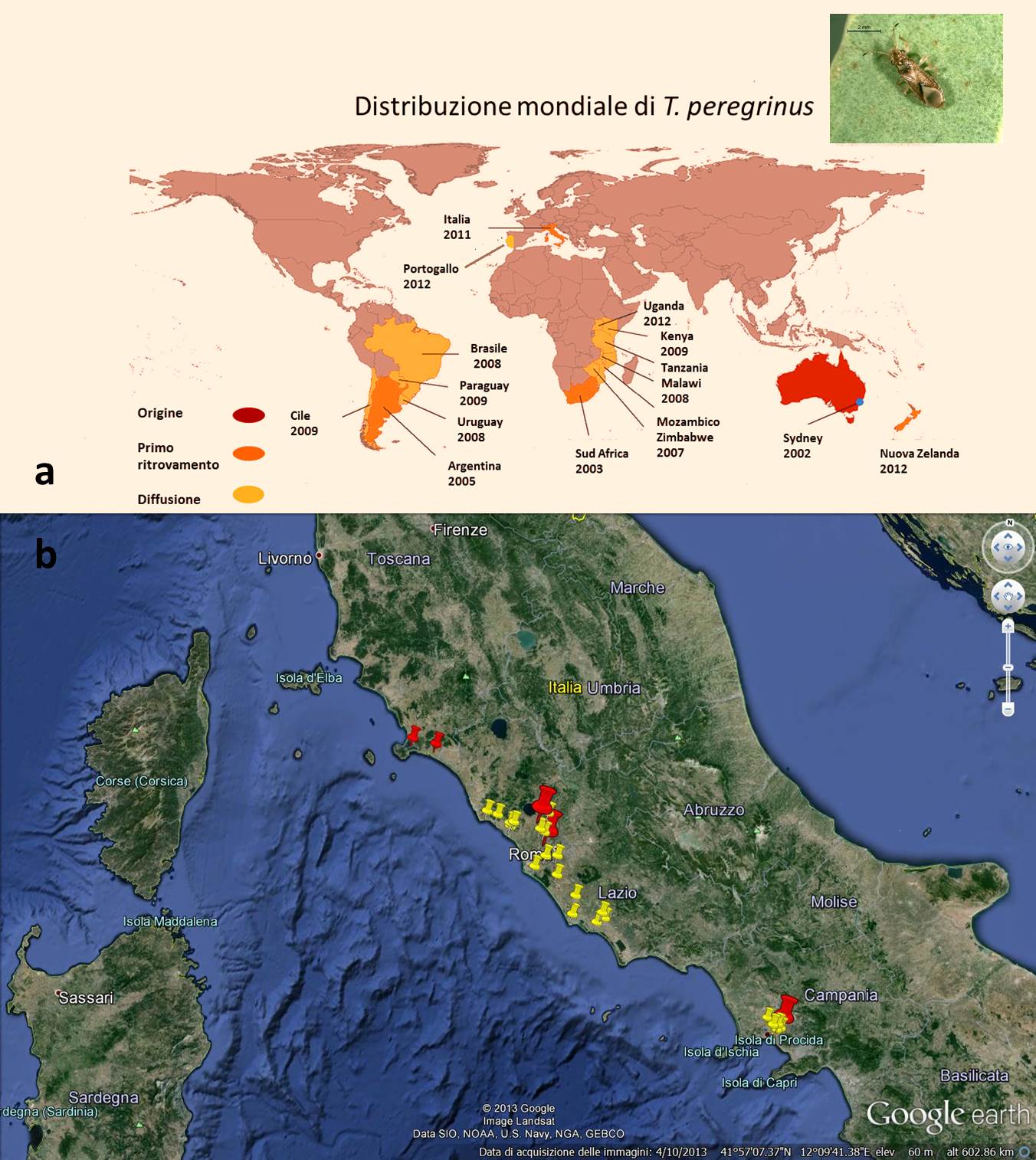
Al pari della pianta ospite, T. peregrinus è originario dell’Australia dove è stato segnalato come specie dannosa solo a partire dal 2002 a seguito di una estesa infestazione delle alberature stradali della Conca di Sydney ([31]). Oltre che in Italia ([21]), la specie risulta invasiva in Argentina, Brasile, Cile, Uruguay e Paraguay ([7], [32], [26], [17], [41], [37], [38]), Kenya, Sud Africa, Malawi e Zimbabwe ([19], [15]), Uganda (Bicep - ⇒ http://bicep.net.au/), Nuova Zelanda ([39]) e recentemente in Portogallo ([14] - Fig. 1a). L’attuale distribuzione è con ogni probabilità dovuta principalmente alla capacità di diffusione passiva di tipo accidentale. Localmente la specie risulta favorita dalla capacità di individuare ospiti non ancora attaccati e per questo preferiti. Ciò avviene grazie alla ricezione delle sostanze volatili quanti-qualitativamente differenti rispetto a quelle prodotte da piante già infestate ([6]). Secondo Dicke & Van Loon ([11]) questo comportamento, che favorisce la dispersione, è dovuto a una strategia di adattamento finalizzata alla sopravvivenza della prole favorendo allo stesso tempo la diffusione attiva dell’insetto. Dal punto di vista morfologico, gli adulti di T. peregrinus (Fig. 2a, Fig. 2b) sono caratterizzati da corpo allungato e appiattito dorso ventralmente. Sono lunghi circa 3 mm, di colore marrone chiaro con aree più scure, antenne di quattro articoli di cui quello apicale più scuro e caratteristiche mandibole appiattite e fortemente ricurve. Il maschio presenta l’organo copulatore asimmetrico con l’apertura sul lato destro del corpo (Fig. 2b). L’uovo è robusto, sculturato, di colore nero lucido, di forma ovale, depresso centralmente e provvisto di opercolo sul polo anteriore (Fig. 3e, Fig. 3f). Lo sviluppo avviene attraverso tre stadi di neanide e due di ninfa. La neanide di prima età ha colorazione paglierina con corpo esile, lunga circa 0.6 mm, e occhi rossi ben evidenti (Fig. 3f). I due stadi ninfali sono di colore marrone chiaro con aree più scure ed evidenti abbozzi alari (Fig. 3g).
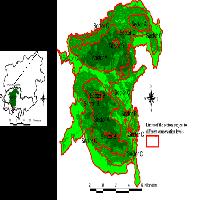
Fig. 1 - (a) mappa di distribuzione mondiale di Thaumastocoris peregrinus; (b) mappa di distribuzione in Italia di T. peregrinus. In rosso i siti di primo ritrovamento, in giallo la successiva diffusione (Da: Google Earth®)
Fig. 3 - Uova di Thaumastocoris peregrinus. (a) gruppo di uova deposto su foglia; (b) uova deposte su ferite prodotte da larve di Gonipterus scutellatus; (c) uova deposte in prossimità di galle di Ophelimus maskelli; (d) uova deposte in prossimità di uova di Glycaspis brimblecombei; (e) uovo singolo di Thaumastocoris peregrinus; (f) neanide di I età di Thaumastocoris peregrinus; g) ninfa di Thaumastocoris peregrinus.
Poco è noto su fenologia e biologia della cimicetta. Il maschio di T. peregrinus produce un feromone di aggregazione ([16]) e su una stessa foglia si rinvengono generalmente numerosi adulti di entrambi i sessi e stadi giovanili (Fig. 2a). Le uova sono deposte isolate o in gruppi anche cospicui sulle foglie o sui giovani rami prevalentemente in corrispondenza di screpolature, rugosità, ferite di vario genere o depressioni (Fig. 3, Fig. 4). I dati di laboratorio, raccolti in condizioni standard di temperatura (17-20 °C) e fotoperiodo (12L:12D), indicano che le femmine possono deporre fino a 60 uova, e 1.8-2.1 uova al giorno. La longevità delle femmine, nelle stesse condizioni, è di 4-40 giorni (media: 15 ± 12 giorni) e compiono una generazione in circa 20 giorni ([33]). Non sono note le modalità di svernamento.
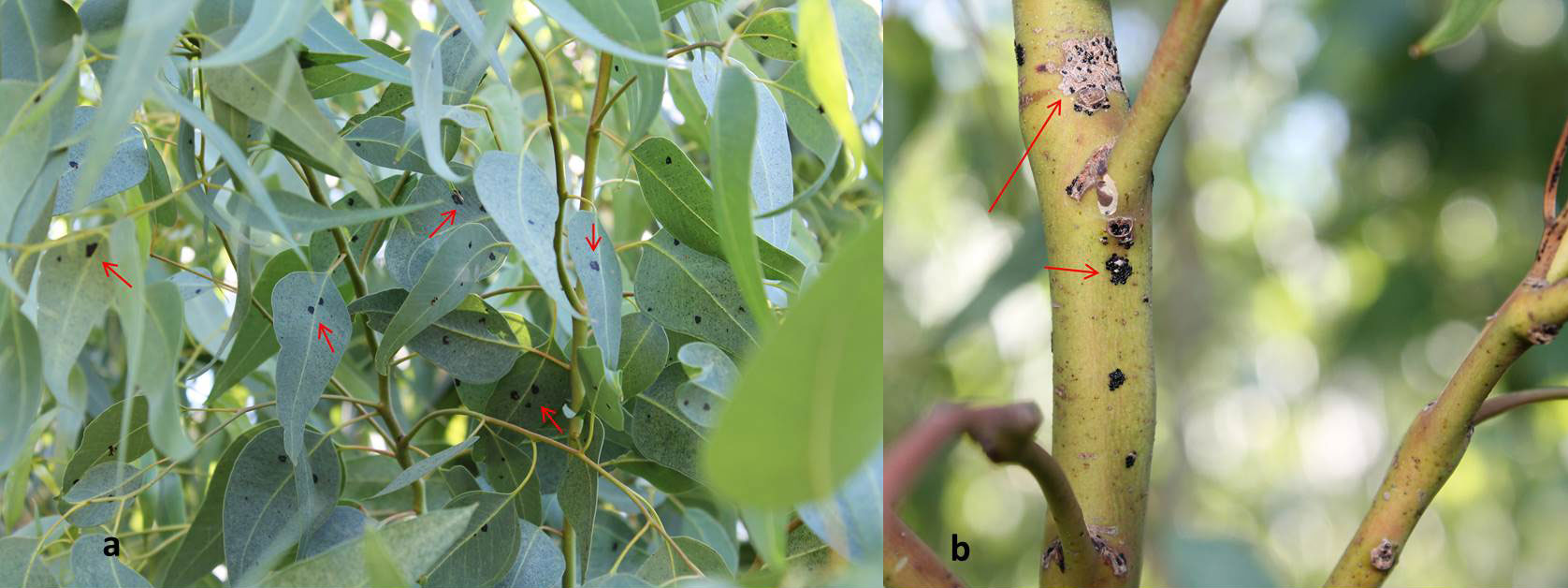
Fig. 4 - Caratteristiche sintomatiche dell’attacco di Thaumastocoris peregrinus. (a) argentatura fogliare; (b) bronzatura fogliare.
Il danno provocato dall’insetto è di diversa entità a seconda dell’intensità dell’infestazione. L’attività trofica è svolta, sia in età giovanile sia da adulto, a carico del mesofillo fogliare con l’inserimento degli stiletti boccali attraverso le aperture stomatiche di foglie mature e completamente sviluppate. In una fase iniziale le foglie attaccate manifestano sintomi di argentatura (Fig. 4a) e in seguito assumono un colore marrone-rossastro molto caratteristico e visibile anche a distanza, da cui il nome comune “Cimicetta della bronzatura” (Fig. 4b). Le foglie danneggiate presentano una progressiva riduzione dell’attività fotosintetica spesso seguita da essiccazione e conseguente filloptosi ([8]). Lo stress provocato dall’attacco di T. peregrinus favorisce l’azione di altri fitofagi, in particolare xilofagi, tra cui molto comune Phoracantha recurva Newman (Coleoptera: Cerambycidae). La reiterazione dell’attacco può condurre alla morte l’albero nel giro di 2-3 anni (Fig. 5). Nei confronti dell’uomo sono infine segnalati problemi di natura sanitaria per induzione di eritemi da puntura ([19]). La dannosità del fitofago è strettamente correlata alla coltivazione, diffusione e sfruttamento antropico degli ospiti. Nel 2008 le piantagioni di eucalitto presenti a livello mondiale erano stimate in poco meno di 20 000 000 ettari, di cui 1 300 000 in Europa, principalmente concentrate in Portogallo (647 000 ha) e Spagna (640 000 ha - [18]).
Fig. 5 - Alberi di eucalitto completamente defogliati in seguito all’attacco di Thaumastocoris peregrinus.
In Italia l’eucalitto è presente con circa 72 000 ettari; le specie più comuni sono E. camaldulensis Dehnh., E. globulus Labill. e E. occidentalis Endl utilizzate in piantagioni a scopo protettivo-produttivo e per fasce frangivento. Le prime, concentrate principalmente nell’Italia meridionale, hanno assolto positivamente la funzione idrogeologica di protezione dei suoli dall’erosione. Le fasce frangivento sono state invece costituite a seguito delle grandi bonifiche idrauliche nel Lazio (Agro Pontino), in Sardegna (Bonifica di Arborea), nella Maremma Laziale e Toscana e in Campania sul litorale Casertano e Salernitano ([28]). Attualmente l’uso prevalente è per legna da ardere e cippato ([13]). Intorno alle attuali piantagioni e fasce frangivento, soprattutto del Lazio e della Sardegna, si è inoltre affermata la produzione di miele monoflora di eucalitto. Infine, la fronda di E. bridgesiana Baker, è usata per composizioni floreali ed esportato in Germania e Olanda.
Nella presente nota si forniscono informazioni relative all’area di distribuzione attuale di T. peregrinus in Italia nonché i primi dati di fenologia nel nuovo ambiente colonizzato.
Materiali e Metodi
Distribuzione
Sono stati effettuati rilievi puntuali nel Lazio, Campania e Toscana nelle aree con presenza dell’ospite vegetale. Le osservazioni sono state condotte a partire dalla prima segnalazione fatta al Servizio Fitosanitario della Regione Lazio nel settembre 2011 fino al novembre 2013, su un totale di ventidue località (Tab. 1). I controlli sono stati effettuati nei mesi di luglio e novembre di ogni anno, su piante isolate e alberature presenti sia in ambiente urbano che in aree agricole. La presenza del fitofago è stata verificata mediante campionamenti visivi e per scuotimento della parte terminale dei rami precedentemente inserita in sacchetti di plastica di colore bianco. Gli adulti raccolti nelle diverse aree campionate sono stati identificati utilizzando la chiave di Noak et al. ([34]) con l’allestimento di preparati a secco permanenti e vetrini. Inoltre, è stata computata l’assenza del fitofago sulle diverse specie di eucalitto rinvenute al fine di valutarne la resistenza.
Tab. 1 - Località di rinvenimento di T. peregrinus. (*): prima segnalazione nella Regione Lazio e in “Europa”. (**): prima segnalazione nella Regione Campania; (***): prima segnalazione nella Regione Toscana.
| Data | Località | Specie ospite | Coordinate | ms.l.m. | Classe di infestazione |
|---|---|---|---|---|---|
| *07/09/2011 | Casalotti (RM) | E. globulus, E. viminalis, E. camaldulensis | 41°54’33.87’’N 12°21’41.10’’E | 79 | Classe 3 |
| *07/09/2011 | Casaccia (RM) | E. camaldulensis, E. globulus | 42°02’35.05’’N 12°18’00.34’’E | 148 | Classe 3 |
| 23/09/2012 | Santa Marinella (RM) | E. camaldulensis | 42°02’20.57’’N 11°52’21.90’’E | 9 | Classe 3 |
| 10/09/2012 | Ladispoli (RM) | E. camaldulensis | 41°57’29.29’’N 12°04’01.16’’E | 8 | Classe 3 |
| 23/09/2012 | Marina di Cerveteri (RM) | E. camaldulensis | 41°58’41.42’’N 12°03’49.68’’E | 27 | Classe 3 |
| 21/09/2012 | Cerveteri (RM) | E. camaldulensis | 41°59’08.00’’N 12°05’39.51’’E | 25 | Classe 3 |
| 20/09/2012 | Boccea (RM) | E. camaldulensis | 41°57’19.40’’N 12°18’48.90’’E | 88 | Classe 3 |
| 20/09/2012 | Valle Santa (RM) | E. camaldulensis | 41°56’16.07’’N 12°20’52.12’’E | 48 | Classe 3 |
| 12/09/2012 | Cesano (RM) | E. camaldulensis | 42°03’21.74’’N 12°22’09.31’’E | 151 | Classe 3 |
| 14/09/2012 | Acilia (RM) | E. camaldulensis | 41°47’52.12’’N 12°22’11.59’’E | 7 | Classe 3 |
| 12/09/2012 | Ostia (RM) | E. camaldulensis | 41°43’40.92’’N 12°17’26.00’’E | 8 | Classe 3 |
| 16/11/2012 | Borgo Piave (LT) | E. globulus, E. camaldulensis | 41°28’42.76’’N 12°51’40.55"E | 28 | Classe 3 |
| 14/11/2012 | Anzio (LT) | E. camaldulensis | 41°27’25.07"N 12°37’15.90"E | 30 | Classe 3 |
| 16/11/2012 | Latina | E. camaldulensis | 41°26’48.65"N 12°52’58.77"E | 29 | Classe 3 |
| 14/11/2012 | Pomezia (RM) | E. camaldulensis | 41°41’09.21"N 12°28’29.78"E | 102 | Classe 2 |
| 14/11/2012 | via Acqua Acetosa (RM) | E. camaldulensis | 41°48’10.12"N 12°27’58.95"E | 53 | Classe 3 |
| 16/11/2012 | Borgo Sabotino (LT) | E. globulus, E. camaldulensis | 41°25’06.94"N 12°49’16.98"E | 1 | Classe 2 |
| 14/11/2012 | Aprilia (RM) | E. camaldulensis | 41°34’12.94"N 12°38’11.66"E | 85 | Classe 3 |
| 11/10/2012 | Santa Severa (RM) | E. camaldulensis | 42°01’18.35"N 11°57’33.08"E | 9 | Classe 2 |
| **28/12/2012 | Cercola (NA) | E. camaldulensis | 40°52’12.65"N 14°21’31.10"E | 54 | Classe 1 |
| 7/08/2013 | Ponticelli (NA) | E. camaldulensis | 40°51’58.44"N 14°19’55.44"E | 22 | Classe 3 |
| 12/10/2013 | Barra (NA) | E. camaldulensis | 40°49’57.58"N 14°19’21.25"E | 20 | Classe 3 |
| 15/10/2013 | Scampia (NA) | E. camaldulensis | 40°54’15.54"N 14°14’28.05"E | 99 | Classe 3 |
| 31/10/2013 | San Giorgio a Cremano (NA) | E. camaldulensis | 40°50’36.34"N 14°21’13.34"E | 96 | Classe 3 |
| 31/10/2013 | Poggioreale (NA) | E. camaldulensis | 40°51’36.24"N 14°17’29.75"E | 3 | Classe 3 |
| ***27/11/2013 | Orbetello (GR) | E. camaldulensis | 42°26’28.65"N 11°13’01.35"E | 2 | Classe 3 |
| ***27/11/2013 | Capalbio (GR) | E. globulus, E. camaldulensis | 42°25’02.66"N 11°24’41.01"E | 13 | Classe 3 |
Fenologia
Dal mese di ottobre del 2011 e fino a novembre del 2013, con cadenza quindicinale, sono stati effettuati campionamenti in due località laziali: Casaccia (C.R. ENEA) e Casalotti (Azienda sperimentale del CRA - Roma). Le due aree campionate sono costituite rispettivamente da due filari di otto alberi di E. camaldulensis, e da un impianto sperimentale di 5000 m2 costituito nel 2010 con distanza di impianto di 4 x 0.50 m per un totale di 2400 piante (tra specie pure ed ibridi interspecifici) disposte a blocchi randomizzati di 20 piante l’uno; delle 2400 piante 240 sono rappresentate da E. camaldulensis. In località Casaccia i campioni sono stati raccolti da quattro alberi, dei sedici totali, prelevando quattro rametti di circa 30 cm, uno per lato rispetto ai punti cardinali, a un’altezza compresa tra 2 e 4 m, per un totale di sedici rametti. In località Casalotti i campioni sono stati raccolti da quattro alberi in altrettanti blocchi dei dodici di E. camaldulensis presenti nel campo sperimentale, utilizzando lo stesso metodo descritto in precedenza. In campo veniva stimato con metodo visuale il numero di individui attivi sui campioni, non distinti per stadio di sviluppo ed escluse le uova, attribuendo il livello d’infestazione ad una delle seguenti quattro classi numeriche: classe 0 (assenza individui); classe 1 (individui rari, anche solo un individuo per campione); classe 2 (da 2 a 10 individui per foglia su almeno un rametto campionato); classe 3 (più di 11 individui per foglia per ogni rametto campionato). L’individuazione delle quattro classi d’infestazione ha inoltre consentito una migliore descrizione grafica dell’andamento delle popolazioni. I rametti raccolti sono stati imbustati singolarmente e portati in laboratorio per rilevare la numerosità dei vari stadi di sviluppo del fitofago, distinti in uova, forme giovanili, e adulti, nonché la presenza di eventuali antagonisti.
Le uova così raccolte e non ancora schiuse sono state poste in capsule Petri del diametro di 10 cm contenenti un disco di carta bibula inumidita allo scopo di valutare la loro vitalità. Per ogni sito campionato e per ogni rilievo sono state preparate 5 capsule Petri ognuna contenente da 300 a 500 uova. Il tutto è stato posto in camera climatica a 25 ± 1 °C e controllato quotidianamente al fine di verificare la schiusa e/o la presenza di eventuali ooparassitoidi.
In località Casalotti, nel periodo compreso tra ottobre 2011 e novembre 2013 l’attività del fitofago è stata monitorata anche mediante l’ausilio di tre trappole cromotropiche gialle (21 x 25 cm) fissate ad un’altezza di 1.80 m all’interno della chioma degli alberi ([25]). In entrambi gli anni, le trappole sono state sostituite una volta al mese tra dicembre e fine maggio e ogni 15 giorni nel periodo giugno-novembre. In laboratorio le trappole sono state esaminate allo stereomicroscopio per la conta degli adulti catturati. Sulle trappole è stata valutata anche la cattura di eventuali antagonisti autoctoni riconducibili a T. peregrinus.
Risultati
Distribuzione
Ad un anno dalla prima segnalazione dei due focolai di T. peregrinus, in località Casaccia e Casalotti (Roma - Tab. 1), l’insetto si è ampiamente diffuso in quasi tutta la Regione Lazio: infatti, dei 22 siti monitorati ben 19 manifestano la presenza di T. peregrinus. Nel 2012 è stato rinvenuto un primo focolaio nella Regione Campania, dove sono state monitorate 15 aree, ed anche in questo caso si è assistito ad un rapido aumento delle aree interessate all’invasione del fitofago (Tab. 1, Fig. 1b). Infine, nel corso del 2013 sono state monitorate 7 nuove località nella Regione Toscana, rinvenendo 2 nuovi focolai di T. peregrinus anche in questa Regione (Fig. 1b, Tab. 1).
Fenologia
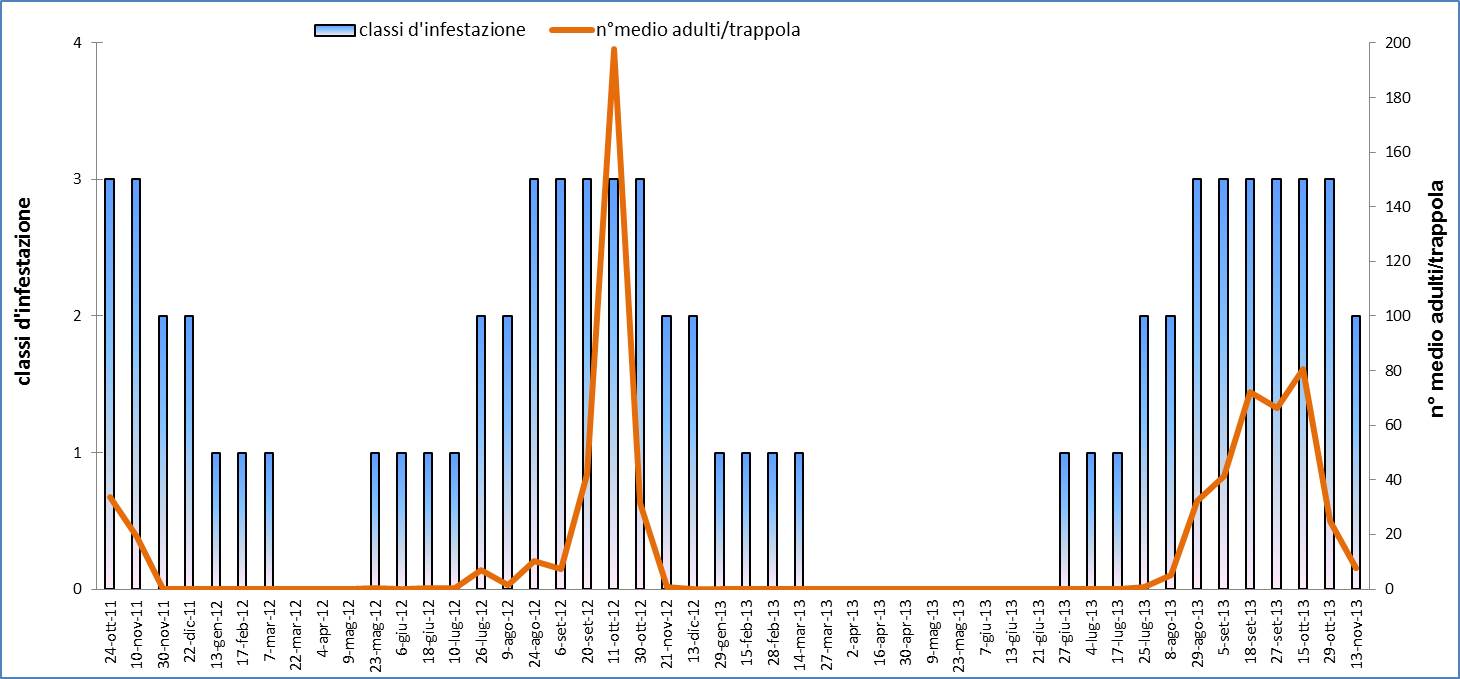
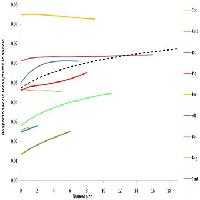
I dati rilevati mediante le trappole cromotropiche evidenziano un picco di cattura nei mesi di settembre-ottobre, una brusca diminuzione già dal mese di novembre con assenza di catture fino a giugno dell’anno successivo (Fig. 6). Il contemporaneo monitoraggio visivo ha rilevato inoltre la coesistenza di tutti gli stadi, uova comprese, della Cimicetta, da fine giugno a tutto gennaio. In particolare, gli adulti si sono sempre rinvenuti da fine maggio fino agli inizi di marzo dell’anno successivo; uova, stadi neanidali e ninfe sono stati sempre rilevati da fine giugno alla prima decade di febbraio dell’anno successivo. Le ovideposizioni sono state rinvenute, in cospicue quantità (Fig. 7), dal mese di luglio e fino a tutto ottobre, più raramente da metà novembre e fino agli inizi di febbraio dell’anno successivo. Tutte le uova integre raccolte si sono mostrate vitali, non diapausanti e sono regolarmente schiuse entro tre giorni, una volta poste in camera climatica a 25 °C. Nel periodo compreso tra fine ottobre e metà novembre si rileva una notevole presenza degli stadi giovanili di T. peregrinus la cui frenetica attivitàè ben visibile sui tronchi degli alberi ormai quasi completamente defogliati (Fig. 5).
Fig. 6 - Curva di volo di adulti di T. peregrinus utilizzando trappole cromotropiche gialle, e classi d’infestazione rilevate mediante campionamento visivo con il seguente schema: classe 0 (assenza individui); classe 1 (individui rari, anche solo un individuo per campione); classe 2 (da 2 a 10 individui per foglia su almeno un rametto campionato); classe 3 (più di 11 individui per foglia per ogni rametto campionato).
Fig. 7 - Uova di Thaumastocoris peregrinus. (a) massiccia ovideposizione su foglie di eucalitto; (b) particolare di ovideposizione su ramo di eucalitto.
Le osservazioni effettuate, inoltre, non hanno evidenziato alcun adattamento di antagonisti autoctoni e anche i predatori generalisti sembrano ignorare la presenza delle colonie. Alcuni adulti morti di T. peregrinus sono stati trovati ricoperti da ife fungine (Fig. 8) attualmente in corso d’identificazione; non è possibile escludere si tratti di specie saprofite.
Conclusioni
A due anni dalla prima segnalazione, T. peregrinus ha completamente colonizzato l’intera Regione Lazio ed è in fase diffusiva in Campania e Toscana. La capacità di colonizzare ambienti anche molto diversi tra loro e soprattutto geograficamente non contigui, ben nota in letteratura ([12]), è amplificata dalla possibilità di una diffusione passiva le cui pathways non risultano al momento del tutto chiare. L’eucalitto, pianta alloctona, in passato ha beneficiato dell’assenza di insetti fitofagi specifici. La diffusione rapida e intensa di merci e la facilità di spostamento dei viaggiatori da un capo all’altro del globo ha determinato, negli ultimi 40 anni, un continuo ingresso dalle aree di origine dell’eucalitto di insetti invasivi che, in condizioni ambientali favorevoli al loro sviluppo e in assenza di antagonisti specifici, hanno spesso determinato ingenti danni ([2], [40], [35], [20], [21], [22]). T. peregrinus è inoltre infeudato a molte specie del genere Eucalyptus e, durante le attività di monitoraggio, la sola specie risultata essere completamente indenne dall’attacco è stata E. populnea F. Muell. Gli studi fenologici condotti suggeriscono che la specie si è ben adattata al clima e sopravvive ai mesi invernali. Nel periodo compreso tra fine gennaio e inizio marzo si rinvengono rari adulti e totale assenza di stadi giovanili. Nonostante il lungo periodo di monitoraggio di campo non è stato possibile individuare con certezza lo stadio o gli stadi svernanti e dunque, non è possibile escludere che l’attività di adulti e stadi giovanili, seppure di popolazioni estremamente rarefatte, non prosegua anche nei mesi invernali.
Per l’Italia, i periodi più propizi per la diffusione della specie in nuovi areali sembrano essere quelli tardo estivi e soprattutto i mesi autunnali, durante i quali la specie si diffonde colonizzando nuove piante/aree; la spinta a diffondersi potrebbe essere dovuta sia al sovraffollamento che al maggior numero di foglie suscettibili di attacco. L’andamento delle catture delle trappole cromotropiche individua in quel periodo la massima mobilità degli adulti e un simile andamento stagionale è riportato anche in Uruguay ([25]). Le trappole catturano adulti in fase di volo. La maggiore numerosità delle popolazioni in questi periodi, oltre ad essere probabilmente dovuta a temperatura e umidità ottimali per lo sviluppo, è attribuibile alla presenza sull’ospite vegetale del maggior numero di foglie completamente sviluppate con stomi aperti e attivi, necessari alla specie per l’attività trofica.
La dannosità potenziale della specie si può attribuire non solo nel danno diretto, ma anche con il richiamo degli insetti xilofagi e con il relativo aumento del rischio di incendio e di schianto ([27]).
Attualmente nessun controllo chimico può essere considerato economicamente valido e compatibile con gli ambienti semi-forestali ed urbani in cui vive la pianta ospite ([42], [41]). Nell’areale di origine di T. peregrinus sono stati individuati, come antagonisti specifici, i parassitoidi oofagi Cleruchoides noackae Lin & Huber (Hymenoptera: Mymaridae) e Stethynium spp. (Hymenoptera: Mymaridae). Il mimaride C. noackae è in fase di introduzione in Africa e in Brasile, poiché attualmente considerato come l’unico agente di controllo biologico potenzialmente efficace ([1], [30], [24]).
Il controllo biologico potrebbe risultare anche in Italia l’unica strada percorribile. Non a caso alcuni storici successi di controllo biologico nel nostro Paese si sono avuti proprio per il controllo di specie invasive dell’eucalitto. Risolutivo è stato in Italia l’uso del parassitoide oofago Anaphes (Patasson) nitens Girault (Hymenoptera: Mymaridae) introdotto in Italia nel 1978 dall’Australia per contenere i danni prodotti all’eucalitto dal Gonipterus scutellatus Gyllenhal (Coleoptera: Curculionidae - [3]). Analoga e più recente esperienza è stata condotta con l’introduzione di Closterocerus chamaeleon Girault (Hymenoptera: Eulophidae) per il controllo del galligeno Ophelimus maskelli Ashmead (Hymenoptera: Eulophidae) in Campania, Sicilia e Sardegna ([23], [36] [5]). Un programma di lotta biologica classica per il controllo di Glycaspis brimblecombei in California si è basato sull’introduzione di Psyllaephagus bliteus Riek (Hymenoptera: Encyrtidae - [9], [10]). Questo parassitoide risulta accidentalmente introdotto anche in Sicilia ([4]), Lazio, Sardegna e Campania.
Le ricerche attualmente ancora in corso riguardano, a partire da quanto già noto in merito alle popolazioni australiane, africane ed americane ([29]), la caratterizzazione molecolare delle popolazioni italiane di T. peregrinus al fine di verificare le possibili pathways di introduzione. Nel rispetto delle normative nazionali è in corso di valutazione la possibilità di introdurre antagonisti naturali dai luoghi di origine.
References
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar