Why do we have to increase deadwood in our forests? How much deadwood does the forest need?
Forest@ - Journal of Silviculture and Forest Ecology, Volume 17, Pages 92-100 (2020)
doi: https://doi.org/10.3832/efor3683-017
Published: Oct 29, 2020 - Copyright © 2020 SISEF
Research Articles
Abstract
Deadwood plays a key role in the functioning and productivity of forest ecosystem and it is an important feature for the conservation of the biodiversity. In the past land-use and forest management have dramatically reduced the amount of deadwood in the European forests and only in the last decades the important role of the deadwood has been studied and recognised. At the political/administrative level the Ministerial Conference on the Protection of Forests in Europe (MCPFE) has recognized the importance of this forest component and the last year Italian Government has requested the regional forest laws and regulations to take into account deadwood and habitat/retention trees in the forest management. It is a current research priority to provide managers of European forests with a baseline of deadwood threshold retention value for decisions for their specific forest type and management target.
Keywords
Deadwood, Coarse Woody Debris (CWD), Retention, Forest Sustainable Management, Biodiversity, Silviculture
Introduzione
La recente Legge n. 141 del 12 dicembre 2019 (conversione in legge del Decreto clima) prevede che “le regioni e le Province autonome di Trento e di Bolzano, in accordo con i principi di salvaguardia della biodiversità, con particolare riferimento alla conservazione delle specie dipendenti dalle necromasse legnose, favoriscono il rilascio in bosco di alberi da destinare all’invecchiamento a tempo indefinito” ([26]).
Le foreste europee sono state gestite intensamente per lunghi periodi e, fino alla fine del 20° secolo, la presenza di legno morto era percepita come un elemento negativo e come indicatore di incuria e cattiva gestione. La presenza di legno morto era anche vista come una potenziale sorgente di patogeni o insetti nocivi e la più frequente indicazione gestionale era la rimozione di questa componente (spesso veniva rimossa assieme agli alberi deperienti nel corso di “tagli fitosanitari”) anche all’interno di Parchi e di Riserve naturali. Queste pratiche, unite alla forte pressione antropica per la raccolta di legna da ardere, hanno portato alla quasi completa rimozione della necromassa nella maggior parte delle foreste italiane ed europee ([34], [25], [42]).
Solo recentemente, grazie alle ricerche svolte nei popolamenti naturali e nelle foreste vetuste (old-growth forests) e alla maggiore diversificazione dei servizi ecosistemici richiesti al bosco, il legno morto o necromassa è stato riconosciuto come una componente fondamentale delle foreste che svolge un ruolo insostituibile sia nei processi naturali che avvengono in foresta e sia nella conservazione della biodiversità ([15]). La presenza di necromassa è quindi passata da indicatore di cattiva gestione ad indicatore di gestione sostenibile e di naturalità della foresta ([9]).
Affinché svolga un significativo ruolo ecologico la necromassa deve però avere dimensioni sufficienti a permettere dei tempi di permanenza in foresta adeguati e lo sviluppo di diversi stadi di decomposizione. Nella terminologia anglosassone si è quindi utilizzata la definizione di “detriti legnosi grossolani” o coarse woody debris (CWD) e per convenzione si assume, che per essere definiti CWD, questi devono raggiungere almeno 10-15 cm di diametro ([59]).
Si possono individuare tre tipi di necromassa o CWD (Fig. 1): gli alberi morti in piedi (snags nella terminologia anglosassone), i tronchi a terra (logs) e le ceppaie (stumps - [61]).
Fig. 1 - Foresta di Lom (Bosnia-Herzegovina). Esempio dei diversi tipi di necromassa presenti in una foresta vetusta. Le ceppaie si differenziano dagli alberi morti in piedi sulla base di una soglia di altezza (ad esempio 1.5 m).
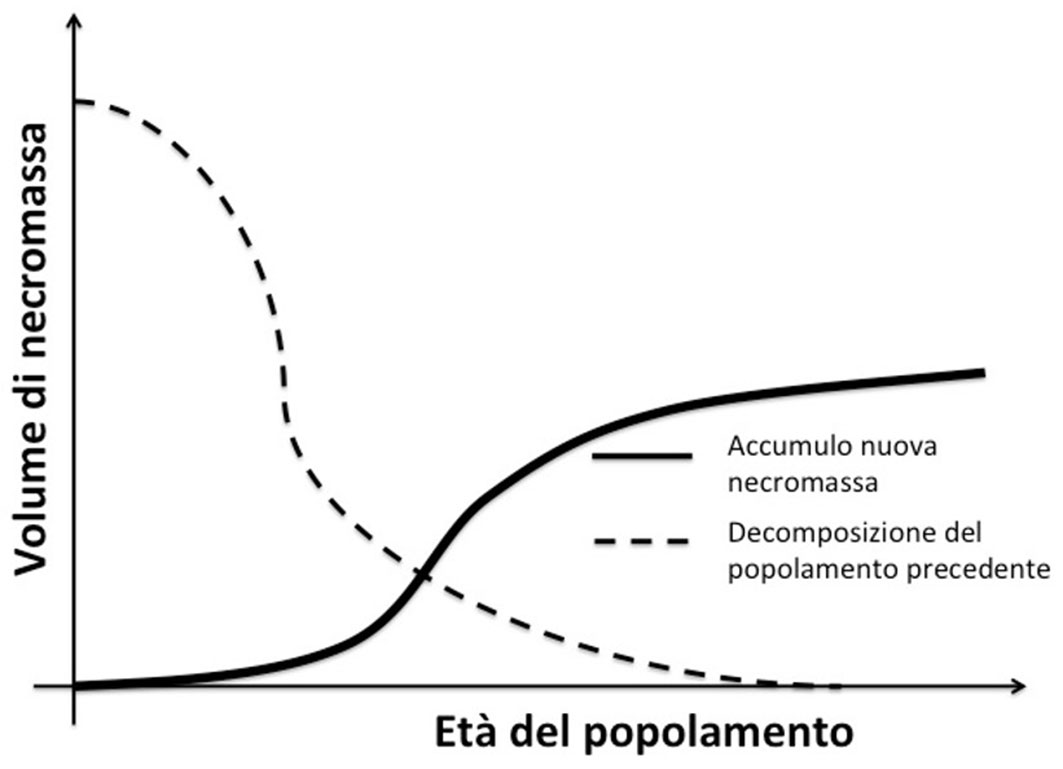
Nelle foreste naturali il più importante input di CWD è rappresentato dai residui dei disturbi che sono all’origine di un nuovo popolamento ([40]). Questo input iniziale varia a seconda del disturbo (fuoco, vento, pullulazione di insetti) in termini quantitativi e qualitativi (tipo di necromassa, volume, grado di decomposizione -[44]). Nel corso della dinamica dei popolamenti forestali la quantità di necromassa apportata dai disturbi iniziali diminuisce in seguito al processo di decomposizione ma ci sono dei nuovi apporti che sono la conseguenza della mortalità da competizione (nelle fasi giovanili e di perticaia) e della mortalità degli alberi adulti nelle fasi mature. In termini di numero di individui, il tasso di mortalità più elevato è quello che si osserva nelle fasi giovanili ed in particolare nella fase di stem exclusion o perticaia ([11]), ma in termini quantitativi l’apporto e l’accumulo di biomassa è maggiore nelle fasi mature, quando la mortalità coinvolge gli alberi del piano dominante (Fig. 2), e raggiunge i valori più alti nello stadio di old-growth o foresta vetusta ([51]).
Fig. 2 - Processo di accumulo e decomposizione di necromassa nel corso della dinamica forestale a partire da un disturbo naturale e fino alla fase di foresta vetusta. Il volume di necromassa iniziale varia quantitativamente e qualitativamente in funzione del tipo di disturbo (da: [51], modificato).
Necromassa e biodiversità
Il legno morto svolge in foresta un ruolo di fondamentale importanza nei confronti della biodiversità ([13]). Una prima constatazione è legata al fatto che in un albero con la chioma verde la percentuale di cellule vive e fisiologicamente attive è circa del 10% (foglie 3%, floema e cambio e raggi midollari 7%); al contrario un fusto o un tronco a terra in avanzato stato di decomposizione (Fig. 3) la percentuale di cellule viventi (prevalentemente funghi ed altri organismi legati al processo di decomposizione) può essere superiore al 30-40% ([11]).
Nelle foreste temperate e boreali la necromassa costituisce un importante habitat per insetti, uccelli, mammiferi, pesci (la necromassa che si trova nei corsi d’acqua) ed ospita un numero elevato di specie di piante, briofite e licheni ([55]). Le specie che vivono, si nutrono o trascorrono almeno una parte del loro ciclo vitale nel legno morto sono definite specie saproxiliche ([50], [43]).
La necromassa può essere classificata sulla base di specie legnosa, tipo di necromassa (snag, log o stump), dimensioni e grado di decomposizione ([52], [17]). Alcune specie, animali e vegetali, nei confronti della necromassa sono generaliste, mentre altre ne richiedono un tipo particolare (ad esempio, specie, tipo, grado di decomposizione). Anche le parti di legno morto o in decomposizione che si trovano all’interno di alberi viventi (Fig. 4) possono essere importanti per la biodiversità ad esempio gli alberi con cavità, tasche di corteccia, grossi rami secchi o parti morte del fusto o della chioma ([19]) e permettono di identificare gli “alberi habitat” ([57], [2]).
Fig. 4 - Foresta di Perućica (Bosnia-Herzegovina). Gli alberi habitat sono alberi in piedi, vivi o morti, che forniscono microhabitat quali cavità, tasche di corteccia, grossi rami secchi, crepe, parti del fusto morte e costituiscono un elemento di fondamentale importanza per una gestione forestale sostenibile.
Necromassa, rinnovazione e ciclo del carbonio
L’importanza della necromassa non è limitata alla biodiversità ma riguarda anche diversi processi che avvengono negli ecosistemi forestali. Tra questi quello che è di maggiore interesse selvicolturale è sicuramente il processo di rinnovazione (Fig. 5). In molti ecosistemi forestali della fascia temperata e boreale la necromassa costituisce il substrato preferenziale di insediamento della rinnovazione forestale ([62], [34], [14], [1]). La necromassa offre alla rinnovazione una posizione privilegiata per avere una maggiore lunghezza della stagione vegetativa (per il precoce scioglimento della neve), per sfuggire alla competizione con le altre specie erbacee ed arbustive e, attraverso il processo di decomposizione, provvede alle sostanze nutritive necessarie all’accrescimento dei semenzali ([14]).
Fig. 5 - (A) Sequoia National Park, USA. Nurse log (tronco a terra, nelle prime fasi del processo di decomposizione) che ospita rinnovazione di Sequoiadendron giganteum. (B) Paneveggio (TN, Italia). Nelle foreste coltivate spesso viene a mancare questo substrato preferenziale ed allora si può osservare la rinnovazione naturale soprattutto sulle ceppaie rilasciate dopo l’utilizzazione o sulle cataste dove sono stati accumulati i fusti dopo i tagli intercalari.
La necromassa rappresenta anche un importante sink di carbonio ([38]). Il carbonio presente negli alberi morti, in seguito al processo di decomposizione, viene restituito al suolo ed all’atmosfera gradualmente nel corso di decenni ([27]). Mentre nel passato questo ruolo della necromassa era trascurato attualmente è considerato di prioritaria importanza per il ruolo di mitigazione che i popolamenti forestali possono svolgere nei confronti delle emissioni di carbonio ([58]). Sotto questo punto di vista è stato evidenziato che la conservazione di foreste vetuste o anche di componenti strutturali vetusti all’interno delle foreste coltivate può svolgere un ruolo più efficace, nei confronti dei flussi di carbonio, anche rispetto a nuovi impianti ([48]). Questo ruolo si riflette anche sulle politiche nazionali: a partire dal 2005 il protocollo di rilievo dell’inventario forestale nazionale prevede anche il rilievo della necromassa, lo stesso Inventario forestale nazionale ha preso il nome di “Inventario nazionale delle foreste e dei serbatoi di carbonio” (⇒ http://www.infc.it/⇒ http://www.infc.it/), così come avviene in molti paesi europei ([6]).
Quanta necromassa è presente nelle nostre foreste?
Nelle foreste la presenza di necromassa è inversamente proporzionale al grado di intensità della selvicoltura ed alla frequenza delle utilizzazioni ([54], [18]). Nel recente passato la necromassa in molte foreste europee era praticamente assente, in quanto c’era una maggiore frequenza di tagli di utilizzazione e intercalari e, spesso, anche una capillare raccolta del materiale di risulta di questi interventi.
Nelle foreste europee la quantità di necromassa è attualmente di circa 15 m3 ha-1 con un range di variabilità tra le diverse nazioni compreso circa tra 5 e oltre 30 m3 ha-1 ([56], [9], [47]). La quantità di biomassa è maggiore in Europa centrale rispetto alle foreste boreali ed alle foreste mediterranee. In Italia secondo l’INFC (2005), il volume medio di CWD presente nei nostri boschi ammonta a 8.8 m3 ha-1 ([45]). Questo quantitativo è maggiore nelle foreste di alto fusto rispetto alle foreste governate a ceduo ed è maggiore nei boschi di conifere rispetto ai boschi di latifoglie.
In questi ultimi decenni la quantità di necromassa nelle foreste europee ed italiane è andata aumentando per la riduzione del prelievo legnoso (soprattutto nell’Europa meridionale), per una maggiore attenzione al ruolo ecologico della necromassa ed anche per l’aumento della frequenza e dell’intensità dei disturbi naturali ([49]). In alcune foreste delle Alpi, sia in fase di abbandono colturale e sia gestite con una selvicoltura naturalistica, i valori di necromassa raggiungono 50-60 m3 ha-1 ([34], [35], [4]) ed il rapporto tra necromassa e volume cormometrico varia tra 5% e 15%. Anche per gli Appennini i valori di riferimento, per le situazioni in cui c’è stata la possibilità di accumulo di necromassa, possono raggiungere il centinaio di metri cubi ad ettaro ([25], [32], [3]) con un massimo di 143 m3 ha-1 in Val Cervara ([24]). Questi valori sono però molto lontani da quelli che si possono osservare nelle foreste vetuste dell’Europa centro-orientale ([35], [33]) dove il volume della necromassa è maggiore di 300 m3 ha-1 ed il rapporto tra volume di necromassa e volume cormometrico è circa del 40% (Tab. 1, Fig. 6). Inoltre nelle foreste italiane nell’attuale necromassa prevalgono le classi di decomposizione più basse (alberi morti in un periodo di tempo relativamente recente) e mancano, o sono più rari, elementi nelle classi di decomposizione più avanzate ([35]), in quanto la necromassa si è iniziata ad accumulare in un periodo relativamente recente ed in foreste del piano montano e subalpino il processo di decomposizione è lento e può durare diversi decenni. Nel processo di decomposizione si possono differenziare tre fasi che corrispondono alla presenza di diverse specie saproxiliche ([53]): (i) una prima fase di colonizzazione (invasione del legno ancora fresco da parte di saproxilici primari); (ii) una fase di decomposizione (ai saproxilici primari si aggiungono i saproxilici secondari); (iii) ed una fase di umificazione (nella quali le specie saproxiliche sono gradualmente sostituite da specie che vivono nel suolo). In foreste che sono state gestite intensamente fino ad alcuni decenni orsono le ultime fasi possono mancare od essere poco rappresentate. In queste ultime foreste si evidenzia anche una importante carenza, tra gli elementi di CWD, di alberi morti in piedi di grandi dimensioni ([35]) che sono importanti per la nidificazione dell’avifauna.
Tab. 1 - Quantità e qualità della necromassa presente in foreste vetuste temperate del piano montano della penisola balcanica e in foreste coltivate con criteri naturalistici o non gestite (riserve o foreste in cui non ci sono stati interventi selvicolturali) da alcuni decenni delle Alpi orientali e degli Appennini settentrionali. (Pa): Picea abies; (Aa): Abies alba; (Fs): Fagus sylvatica. (BiH): Bosnia-Herzegovina; (MN): Montenegro.
| Tipo | Località | Densità (alberi ha-1) |
Area basimetrica (m2 ha-1) |
Diametro medio (cm) |
Volume alberi viventi (m3 ha-1) |
Volume necromassa (m3 ha-1) |
Specie presenti |
Rapporto % tra necromassa e volume alberi viventi |
|---|---|---|---|---|---|---|---|---|
| Foreste gestite (modalità di gestione naturalistica e/o misure PSR finalizzate alla conservazione della biodiversità) |
Amblar (TN) | 544.1 | 44.5 | 32.9 | 621.8 | 32 | Pa, Aa, Fs | 5 |
| Croviana (TN) | 353.7 | 40.5 | 41.2 | 527.6 | 48 | Pa, Aa, Fs | 9 | |
| Santo Stefano Cadore (BL) | 822.1 | 40.6 | 25.7 | 453.1 | 22 | Pa, Aa, Fs | 5 | |
| Verna (AR) | 475 | 45.0 | 29.0 | 657 | 67 | Aa, Fs | 10 | |
| Foreste non gestite da alcuni decenni e Riserve | Ris. Valbona - Area 2 (TN) | 647 | 69.2 | 41.5 | 914.5 | 80 | Pa | 9 |
| Ludrin (TN) | 741 | 45.1 | 29.2 | 533.4 | 70 | Pa, Aa, Fs | 13 | |
| Val Navarza (UD) | 702.8 | 52.4 | 31.6 | 584 | 85 | Pa, Aa, Fs | 15 | |
| Ris. Sasso Fratino (FC) | 235 | 53.0 | 47.9 | 858 | 65 | Aa, Fs | 8 | |
| Foreste vetuste | Lom (BiH) | 637.7 | 61.6 | 35.4 | 763.1 | 327 | Pa, Aa, Fs | 43 |
| Perućica (BiH) | 431.7 | 59.1 | 41.7 | 1031 | 406 | Pa, Aa, Fs | 39 | |
| Biogradska gora (MN) | 411.9 | 60.1 | 43.2 | 1030 | 420 | Pa, Aa, Fs | 41 |
Fig. 6 - (A) Foresta della Verna (AR, Italia) Anche nelle foreste italiane più ricche di necromassa il volume raramente supera alcune decine di metri cubi ad ettaro. Nella foresta della Verna (bosco misto di faggio ed abete bianco) il valore medio di CWD è di 67 m3 ha-1 ([32]); (B) Foresta di Lom (Bosnia-Herzegovina). Nelle foreste vetuste (in questo caso in un popolamento misto di abete bianco, faggio ed abete rosso) il volume medio di CWD supera i 400 m3 ha-1 ([33]).
Necromassa, alberi habitat e selvicoltura
In questi ultimi decenni, sulla base delle conoscenze ecologiche acquisite sull’importanza della necromassa in foresta, è maturata la consapevolezza di selvicoltori e gestori delle risorse naturali dell’importanza di conservare una quota di legno morto anche all’interno delle foreste coltivate ([60], [13]).
La necromassa è stata anche riconosciuta come uno dei principali “Criteri ed indicatori quantitativi di gestione forestale sostenibile” utilizzati nel processo di Helsinki e quindi la succitata Legge n. 141 12 dicembre 2019 è finalizzata anche al rispetto degli accordi internazionali sottoscritti dai governi nazionali. La conservazione di alberi habitat ed elementi di necromassa non è però una novità nel panorama nazionale, in quanto già da diversi anni in alcune Regioni (ad esempio la Regione Lombardia e la Regione Piemonte) la conservazione di alberi morti, se presenti, è obbligatoria in tutti gli interventi selvicolturali ([35]) ed in tutto il territorio nazionale è prevista tra le Misure di Conservazione delle aree appartenenti al network di Natura 2000 ([8]).
Accanto alla conservazione della necromassa è cresciuta la consapevolezza sull’importanza degli alberi habitat che trovano già riconoscimento in molte normative regionali e che sono espressamente citati nel decreto clima che richiede “il rilascio in bosco di alberi da destinare all’invecchiamento a tempo indefinito”. Questi alberi possono contenere parti di fusto o di chioma “morte” e contribuiscono alla conservazione della biodiversità ad all’aumento della necromassa attuale e futura all’interno dei popolamenti forestali (Fig. 7).
Fig. 7 - Albero habitat contrassegnato in quanto sede di nidificazione di un picchio (Paneveggio, TN). Nel passato quest’albero sarebbe stato prelevato per criteri qualitativi e “sanitari” mentre attualmente viene identificato in modo permanente in modo da sottrarlo al taglio.
Un altro importante settore selvicolturale in cui è aumentata la consapevolezza dell’importanza del ruolo della necromassa è quello degli interventi di recupero della foresta dopo un disturbo naturale (fuoco, incendio, pullulazione di insetti). Mentre in passato l’intervento consuetudinario era quello di asportare tutto il legno morto con successivo rimboschimento artificiale, il cosiddetto salvage logging (Fig. 8), in questi ultimi anni l’utilità e l’efficacia di questa pratica sono state messe fortemente in discussione ([22], [23]). Anche in questo caso l’obiettivo di una gestione sostenibile è quello di mantenere una quota di residui del popolamento precedente (le eredità biologiche o legacies nella letteratura anglosassone) in modo da favorire la ricolonizzazione del più alto numero di specie animali e vegetali nel popolamento successivo, limitando così i rischi di perdita di biodiversità e favorendo i processi naturali ([12]). Anche in Italia, ad esempio dopo incendi di elevata estensione o superfici di schianti da vento come quelli provocati da Vaia ([31]), la quantità di necromassa lasciata in bosco è, non solo per motivi di carattere ecologico, significativamente maggiore rispetto a quanto accadeva alcuni decenni orsono.
Fig. 8 - Disentis (Svizzera). Confronto tra salvage logging (a sinistra) e popolamento in cui non si è intervenuti dopo uno schianto da vento (a destra). È evidente la differenza di quantità di legno morto presente al suolo dopo il disturbo rispetto alla superficie dove si è intervenuti.
Un ruolo importante per la crescita di una professionalità più consapevole ed attenta agli aspetti ecosistemici e multidisciplinari, come l’importanza della necromassa, è stata svolta, in questi ultimi anni, dai progetti LIFE come, ad esempio, Fagus, MIPP, ManFor, Carabus ([7], [37], [30]). Spesso, nell’ambito di questi progetti, si è evidenziata l’importanza non solo di sensibilizzare i tecnici e gli operatori sulla conservazione e valorizzazione di questa componente ma anche di svolgere una adeguata informazione ed educazione nei confronti dei proprietari e di tutti i portatori di interesse.
Quanta necromassa dobbiamo rilasciare? Come distribuire la necromassa nel popolamento e nella foresta?
La quota di biomassa da rilasciare dovrebbe rappresentare un compromesso tra l’importanza di conservare biodiversità e processi ecologici e la necessità di limitare i pericoli potenziali relativi a diffusione di patogeni, pullulazioni di insetti o innesco di incendi. In Europa in questi ultimi anni sono aumentate le ricerche finalizzate alla definizione di valori soglia del CWD da rilasciare che sono variabili a seconda della categoria forestale e della specie o del gruppo di specie target da proteggere (insetti saproxilici, avifauna, funghi, muschi, licheni). Questi valori soglia sono stati indicati generalmente in 20-30 m3 ha-1 per le foreste boreali, 30-40 m3 ha-1 per foreste miste del piano montano e 30-50 m3 ha-1 per le foreste planiziali ([36]). In Svizzera i valori soglia sono stati fissati dall’Ufficio Federale per l’ambiente in 20 m3 ha-1 per il Giura, l’Altipiano ed il sud delle Alpi ed in 25 m3 ha-1 per le prealpi e le Alpi Bernesi ([20]). Per le foreste planiziali della pianura padana è stata indicata una soglia prudenziale di 35 m3 ha-1 ([7]); tuttavia in queste foreste è più difficile raggiungere i quantitativi elevati di necromassa che si possono osservare nelle foreste del piano montano e subalpino in quanto la decomposizione è più rapida e, nelle foreste alluvionali più naturali, le piene rimuovono parte della necromassa presente sul suolo forestale. In alcuni casi queste soglie non sono sufficienti a garantire la conservazione di specie più esigenti che possono richiedere quantitativi di necromassa di 100-140 m3 ha-1 ([36]). Per la conservazione di queste specie, oltre alla quantità ed alla qualità della necromassa (grado di decomposizione), è importante garantire anche un’adeguata distribuzione spaziale del legno morto sia a livello di popolamento che a livello di comprensorio forestale ([39], [10]) ed è indispensabile attuare una strategia mirata che può essere realizzata, ad esempio, attraverso la definizione di “isole di invecchiamento” (Fig. 9) che possono costituire delle vere e proprie riserve di necromassa” all’interno delle foreste coltivate ([5], [29], [16]). La definizione e la continuità delle isole di invecchiamento può essere attuata correttamente solo in aree dotate di Piano di Assestamento o di Piano aziendale e questo ne limita l’applicazione, in quanto attualmente solo circa il 15% della superficie forestale italiana ha uno strumento di questo tipo ([28]).
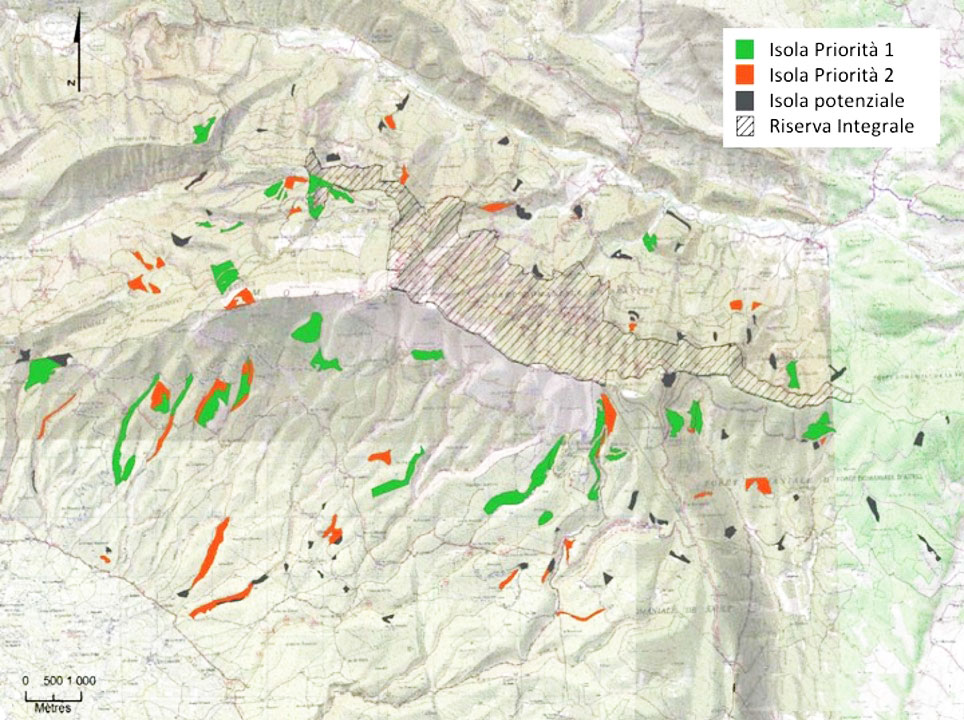
Fig. 9 - Esempio di distribuzione di isole di invecchiamento nella foresta demaniale del Mont Ventoux (Francia). Si tratta di 74 isole, suddivise tra quelle con priorità 1 (quelle che hanno caratteristiche strutturali migliori, adeguata superficie e interessano tipi forestali di particolare interesse), quelle con priorità 2 e quelle potenziali (non attive ma che possono sostituire quelle che invece sono state già individuate). Nella foresta è stata anche individuata un’area di Riserva integrale. Nel complesso l’area interessata dalle isole di invecchiamento è del 3% circa della superficie complessiva (da: [5], modificato).
Conclusioni
La quantità di necromassa nelle foreste italiane ed europee è in continuo aumento, così come la consapevolezza dei gestori dell’importanza di questo componente. L’aumento di necromassa è un fattore legato alla minore pressione antropica nelle foreste coltivate, alla quota di boschi che sono abbandonati e costituiscono delle Riserve di fatto ([46]) ed all’aumento della frequenza e dell’intensità dei disturbi naturali che non sono oggetto di salvage logging o che comunque rilasciano una quota importante di residui legnosi. Accanto a queste situazioni, in cui l’aumento della necromassa avviene potremmo dire “per inerzia”, è di fondamentale importanza una “gestione attiva” di conservazione del legno morto da attuarsi nelle foreste coltivate che richiede il supporto della ricerca per la definizione di quantità e qualità dei rilasci. Di questa pratica si gioverà non solo la biodiversità ed il funzionamento di tutto l’ecosistema ([21]), ma anche la sostenibilità e l’accettazione sociale della gestione forestale ([41]). L’aumento della necromassa nelle foreste coltivate è però anche legata anche all’aumento delle superfici forestali dotate di Piani di Assestamento forestale o Piani Aziendali, in assenza dei quali non è possibile programmare la conservazione della necromassa sul lungo periodo e prevedere un’adeguata distribuzione della quantità e della qualità di questo elemento all’interno dei comprensori forestali. Una politica attiva di conservazione e valorizzazione della biomassa richiede un consapevole approccio culturale da parte dei tecnici forestali e di tutti i portatori di interesse. Quest’ultimo può essere favorito da opportune iniziative di formazione-informazione che trovano nei progetti LIFE un primo strumento efficace, ma che devono essere estese ad un pubblico più vasto di tecnici, operatori, amministratori, portatori di interesse e frequentatori a scopo turistico-ricreativo. Infine, l’aumento di necromassa, di alberi habitat e di altri elementi legati all’erogazione di biodiversità e di servizi ecosistemici di cui beneficia tutta la comunità, non può essere a carico, in termini di aumento di spese di gestione e di mancato reddito, dei soli proprietari forestali. È quindi auspicabile che le leggi nazionali e regionali che, anche nell’ambito di accordi internazionali, sono finalizzate ad aumentare la sostenibilità della gestione forestale e la valorizzazione dell’erogazione di servizi ecosistemici prevedano delle adeguate forme di indennizzo abbinate ad incentivi mirati a premiare le modalità di gestione “virtuosa” e le “buone pratiche” finalizzate ad aumentare la presenza di alberi habitat, di isole di invecchiamento e di necromassa rilasciata in foresta.
References
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar