Xylosandrus compactus, un nuovo parassita forestale invade l’Italia
Forest@ - Rivista di Selvicoltura ed Ecologia Forestale, Volume 18, Pagine 8-14 (2021)
doi: https://doi.org/10.3832/efor3711-018
Pubblicato: Gen 21, 2021 - Copyright © 2021 SISEF
Articoli Scientifici
Abstract
The black twig borer Xylosandrus compactus, an ambrosia beetle native to Asia, was recorded for the first time in Europe in 2011 in central Italy. This paper reports the progressive dispersal of this invasive species in many Italian regions (Campania 2011, Tuscany and Liguria 2012, Lombardy 2015, Lazio and Sicily 2016, Emilia Romagna 2018, Veneto 2019) and other European countries (France 2015, Spain and Greece 2019). The main features of the biology and ecology are reported, and the infestation symptoms and the produced damages are descripted, as well. An updated list of the potential host-plants is also provided. Finally, protocols for the pest control are suggested.
Keywords
Introduzione
Da alcuni anni un nuovo parassita di origine asiatica si sta velocemente diffondendo in molte regioni italiane causando localmente danni rilevanti a carico di varie specie arboree e arbustive utilizzate in contesti urbani come piante ornamentali, nel settore del vivaismo forestale, in piantagioni legnose da reddito e in formazioni forestali naturali. Si tratta dell’insetto lignicolo Xylosandrus compactus (Eichhoff), specie appartenente ai coleotteri scolitini, una piccola sottofamiglia rientrante nella famiglia dei Curculionidi (Coleoptera: Curculionidae, Scolytinae).
Xylosandrus compactus è un piccolo scolitide xilomicetofago con femmine di 1.6-1.8 mm, color nero scuro, lucido, alate (Fig. 1), e maschi più piccoli (0.9-1.3 mm) rossicci, rari, e privi di ali ([26]). Le larve hanno la caratteristica forma a “C” degli scolitidi, color bianco-crema, prive di zampe, glabre, con capo color marrone. La pupa, della stessa lunghezza dell’adulto, è color bianco-crema ([28]).
Fig. 1 - Femmina adulta di Xylosandrus compactus in visione laterale (in alto; foto: Louisiana State Arthropod Museum - ⇒ http://data.lsuinsects.org/) e dorsale (in basso; foto: N. Wright, Braman Termite & Pest Elimination, ⇒ https://www.bugwood.org/). La linea indica 1 mm.
Il presente contributo si propone di fornire un quadro aggiornato circa la distribuzione geografica, la bio-ecologia, gli alberi ospite e la dannosità di X. compactus, e suggerisce possibili strategie di lotta per contenere la sua diffusione.
Origine e distribuzione di Xylosandrus compactus
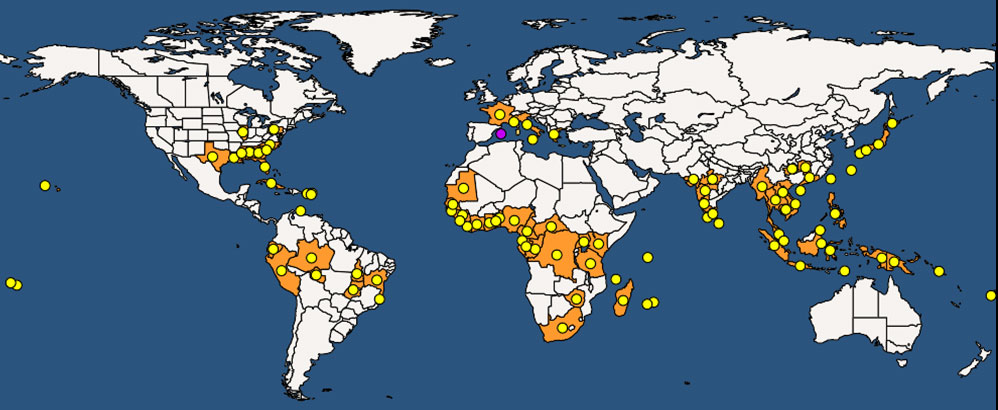
La specie è originaria dell’Asia tropicale orientale, ma ampiamente distribuita nelle regioni intertropicali di Africa, Asia e Sud America. Successivamente introdotta anche negli Stati Uniti meridionali, Nuova Zelanda, Hawaii e isole del Pacifico (Fig. 2) con il commercio internazionale e intercontinentale di piante e legname tropicale ([27]).
Fig. 2 - Distribuzione mondiale di Xylosandrus compactus aggiornata al 2020 (da: ⇒ https://gd.eppo.int/taxon/XYLSCO/distribution).
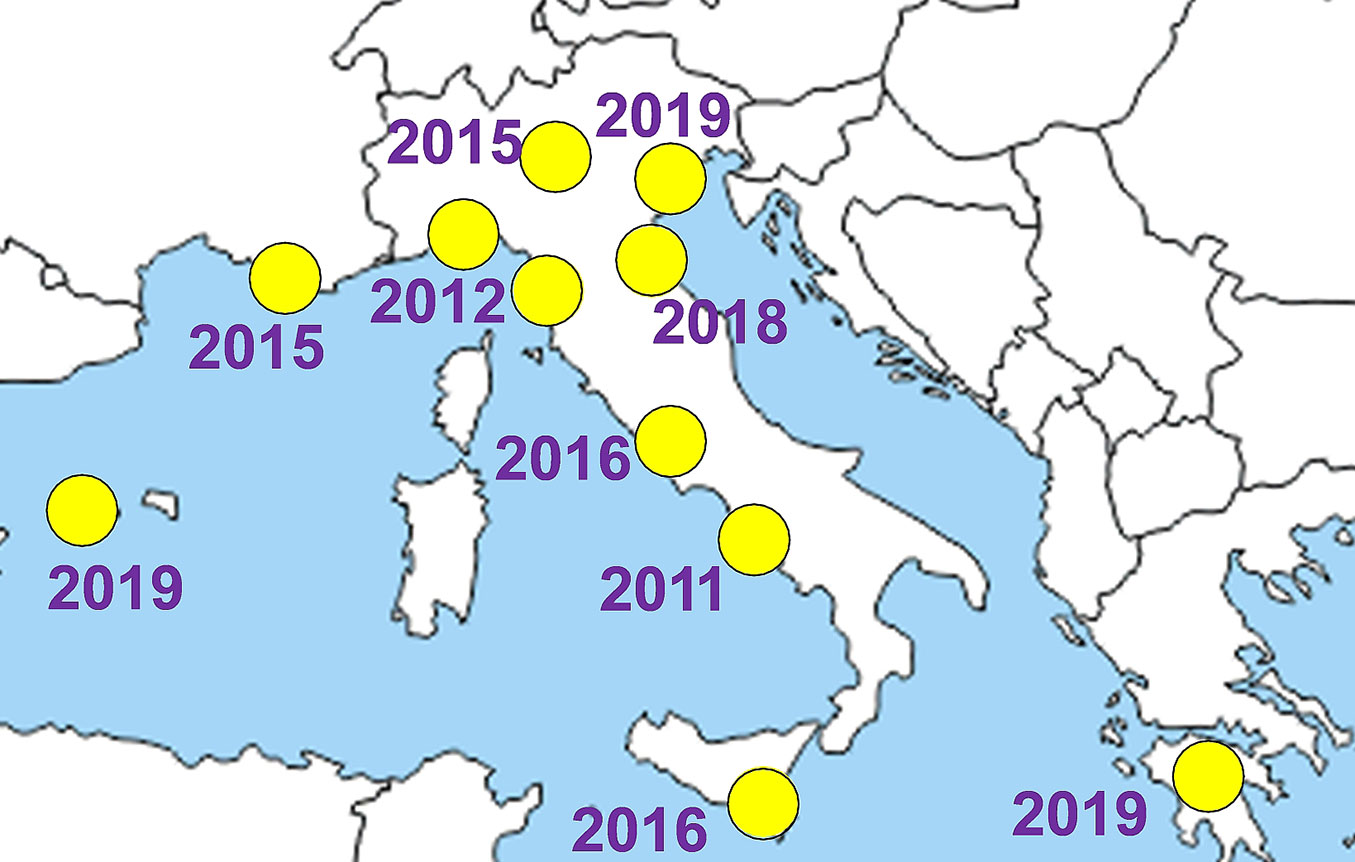
Nel 2011 X. compactus è stato trovato per la prima volta in Europa a Portici e Napoli ([15]), probabilmente arrivato tramite commercio internazionale di materiale vivaistico. Da allora in pochissimi anni si è diffuso lungo il litorale tirrenico (2012 in Toscana e Liguria, 2016 in Lazio e Sicilia), per poi raggiungere l’entroterra settentrionale (2015 in Lombardia), e infine il litorale adriatico (2018 in Emilia Romagna, 2019 in Veneto). Nel 2015 dalla Liguria ha raggiunto la Francia (Costa Azzurra - [6]) e nel 2019 è stato rinvenuto in Spagna (Maiorca, isole Baleari) su una pianta di carrubo prontamente trattata per tentare di eradicare lo scolitide ([23], [12]). Nel luglio dello stesso anno X. compactus è stato trovato anche nella Grecia meridionale a carico di carrubo, alloro, olivo, albero di giuda e arbusti appartenenti al genere Rhamnus ([29]), divenendo così un problema a livello europeo (Fig. 3). Al riguardo, dal 2018 è attivo un progetto europeo (LIFE17 NAT/IT/000609 SAMFIX) coordinato dal Parco Nazionale del Circeo, e che coinvolge anche Francia e Spagna, che ha come obiettivo lo sviluppo e la sperimentazione di protocolli di contrasto all’invasione di specie asiatiche di Xylosandrus (X. compactus, X. crassiusculus e X. germanus) negli habitat naturali che circondano il Mar Mediterraneo.
Fig. 3 - Distribuzione europea di X. compactus e date di ritrovamento per le varie regioni (aggiornato al 2020).
Biologia ed ecologia di Xylosandrus compactus
Xylosandrus compactus è un coleottero xilematico - ovvero che si sviluppa in profondità nel legno, a differenza della maggior parte degli scolitidi europei che sono corticicoli - con intime simbiosi obbligate con funghi associati che gli permettono di svilupparsi molto velocemente nei tessuti legnosi dell’ospite, notoriamente poveri di sostanze nutritive.
Il danno che deriva alla pianta è dovuto all’azione combinata di funghi patogeni, trasmessi dall’insetto, con le gallerie scavate dagli adulti al momento della colonizzazione dell’albero ospite. La maggior parte di questi insetti attacca piante in condizioni di stress - anche temporaneo - causate da siccità, forti potature, danni da trapianto, eventi climatici estremi come ondate di calore o gelate, attacchi di altri parassiti o patogeni, o qualsiasi altro fattore che può in qualche modo ridurre la vigoria della pianta ([2]).
Alle nostre latitudini gli adulti sono attivi fra metà marzo e fine settembre, sebbene con variazioni legate agli andamenti climatici locali e stagionali. Solo le femmine sono in grado di volare e attaccare nuove piante, che vengono scelte fra i potenziali ospiti in situazioni di sofferenza. Le femmine di solito penetrano in ramoscelli, rametti e piccoli rami con cortecce sottili, lisce e poco suberificate, di arbusti, giovani piante o nella porzione periferica della chioma di piante di grandi dimensioni. Quelli più frequentemente colpiti sono rametti di 1-3 anni di età fino a un diametro massimo di 4-6 cm. La specie può tentare di penetrare anche fusti di maggiori dimensioni ma in tali situazioni spesso il foro di colonizzazione abortisce. In Sicilia sono tuttavia riportati casi di infestazione anche su tronchi di carrubo di oltre 30 cm di diametro ([17]), benché estremamente insoliti.
La colonizzazione da parte della femmina avviene attraverso un piccolo foro circolare di ingresso del diametro di 0.7-0.8 mm, scavato solitamente sul lato inferiore del rametto (Fig. 4). Una volta entrata nell’ospite, la femmina procede con lo scavo fino a raggiungere il midollo centrale. A questo punto la galleria di ingresso si allarga a formare una caratteristica camera di allevamento che ha un diametro di pochi mm e si sviluppa longitudinalmente per alcuni centimetri. Il sistema riproduttivo di X. compactus è infatti di tipo “xilematico a camera” ([13]), con galleria materna regolare che penetra nella pianta in modo ortogonale alle fibre del legno per qualche millimetro per poi allargarsi a formare una piccola camera allungata (camera di allevamento), di solito sviluppata lungo il midollo del rametto colpito (Fig. 5). Nella camera di allevamento vengono deposte le uova: da quelle fecondate nasceranno femmine, da quelle non fecondate maschi ([11]); qui si sviluppano le larve e infine compaiono le pupe (Fig. 5). Come in tutte le specie lignicole (xilematiche) di scolitidi, le larve non scavano gallerie e non si cibano direttamente del legno ma sfruttano funghi simbionti che crescono sulle pareti interne della camera di allevamento ([2]). Tali funghi vengono introdotti nella pianta ospite dalla femmina durante la fase di colonizzazione dei rametti. Questo regime alimentare, rispetto agli insetti che si nutrono direttamente del tessuto xilematico, rende lo sviluppo delle larve molto più veloce e aumenta in modo impressionante il numero di potenziali piante suscettibili all’insetto, che ha solo bisogno di un ospite in cui possa coltivare i funghi simbionti. Al momento della colonizzazione dei rametti la femmina rilascia infatti nella camera di allevamento le spore dei funghi trasportati sul suo corpo in una struttura apposita detta micangio o micetangio. Nella camera scavata dalla femmina le spore del fungo - trovando ideali condizioni di umidità e temperatura - germineranno producendo il bianco micelio fungino che servirà da alimento per le larve e per la successiva maturazione sessuale degli adulti neo-formati. Xylosandrus compactus non si nutre quindi direttamente della pianta ma dei funghi che coltiva in essa ([2]).
Fig. 4 - Foro di ingresso (a sinistra; foto: Regione Emilia Romagna) e femmina in penetrazione (destra; foto: A. Vannini, Università della Tuscia, Viterbo).
Fig. 5 - Esempio di camera di allevamento di X. compactus (a sinistra; foto: Raffaele Giurato). Si noti lo sviluppo longitudinale della camera lungo il midollo del rametto (in centro; foto: Parco Nazionale del Circeo). A destra, pupe in fase di metamorfosi in nuovi adulti (foto: [16]).
Le larve si sviluppano in modo gregario nella camera nutrendosi dei funghi per circa 20-25 giorni. Raggiunta la maturità, esse affrontano la metamorfosi trasformandosi prima in pupe e poi in nuovi adulti. Gli adulti immaturi, teneri e chiari, hanno un comportamento gregario e rimangono qualche giorno entro la camera di allevamento continuando a nutrirsi di funghi all’interno dell’ospite al fine di raggiungere la maturità sessuale (Fig. 6). Dopo l’accoppiamento tra fratelli, i pochi e piccoli maschi presenti - di solito nell’ordine di uno ogni 9 femmine ([11]) - sono inetti al volo e muoiono nella galleria. Le femmine abbandonano invece la pianta attraverso il foro di ingresso inizialmente scavato dalla madre imbrattandosi nuovamente di spore del fungo simbionte, pronte a colonizzare un nuovo ospite ([2]).
Fig. 6 - Adulto neoformato (a sinistra; foto: [26]) e gruppo di adulti in fase di maturazione sessuale (a destra; foto: Agraria il Ponticello s.n.c. 2011).
Nei nostri ambienti l’intero ciclo di sviluppo da uovo ad adulto si completa in circa 4-6 settimane in relazione all’andamento climatico e alle diverse stagioni. Generalmente i primi attacchi si osservano a partire da aprile, col raggiungimento di temperature medie di circa 18-20 °C, e si protraggono fino a fine settembre ([18]). In condizioni climatiche favorevoli si hanno dunque numerose generazioni l’anno: in Italia settentrionale ve ne sono almeno tre (osservazione personale), sebbene nelle regioni centro-meridionali possano essercene quattro e in Sicilia ne siano state segnalate fino a cinque ([18], [20]). Lo svernamento è affidato agli adulti della generazione tardo-estiva e avviene all’interno della pianta ospite in cui gli insetti si sono sviluppati ([26], [18], [20]).
Piante ospiti
Xylosandrus compactus è una specie altamente polifaga su piante legnose, arboree e arbustive, principalmente latifoglie, sebbene con isolate segnalazioni anche su conifere come riportato in Lazio dove, nella città di Roma, l’insetto è stato rinvenuto su cipresso comune (Cupressus sempervirens - [28]). Nel mondo sono note almeno 220 specie ospiti appartenenti a 62 diverse famiglie. I principali ospiti di importanza economica sono coltivazioni della fascia intertropicale quali caffè (Coffea canephora), tè (Camelia sinensis), cacao (Theobroma cacao), alberi da frutto tropicali e subtropicali come macadamia (Macadamia ternifolia), lici (Litchi chinensis), mango (Mangifera indica) e avocado (Persea americana). Nei paesi in cui X. compactus è stato introdotto possono essere attaccate molte altre specie appartenenti ai generi Acacia, Acer, Azalea, Castanea, Celtis, Cornus, Eucalyptus, Ficus, Hibiscus, Khaya, Liquidambar, Magnolia, Malus, Ostrya, Platanus, Swietenia e Vitis.
In Italia X. compactus è stato segnalato su molte specie arboree e arbustive fra cui (in ordine alfabetico e non di preferenza): Acer spp., Alnus spp., Arbutus unedo, Azalea spp., Camelia spp., Castanea sativa, Celtis australis, Ceratonia siliqua, Cercis siliquastrum, Citrus aurantifolia, Citrus limonum, Cornus sanguinea, Corylus avellana, Evonymus spp., Fraxinus ornus, Gardenia spp., Laurus nobilis, Liquidambar styraciflua, Liriodendron tulipifera, Magnolia spp., Morus alba, Olea europea, Phillyrea spp., Pistacia lentiscus, Pittosporum spp., Platanus spp., Prunus laurocerasus, Punica granatum, Quercus ilex, Quercus robur, Rhododendron spp., Ruscus aculeatus, Tilia spp., Ulmus spp., Viburnum tinus ([15], [28], [30]).
Dannosità e sintomatologia
Poiché, come ricordato, la colonizzazione e riproduzione di X. compactus interessa principalmente piante deperienti o in gravi difficoltà vegetative, questa specie viene definita - come molti altri suoi confamiliari - un “parassita di debolezza” in quanto generalmente non in grado di colonizzare piante sane e vigorose se non in condizioni di elevata densità di popolazione.
Gli attacchi di X. compactus provocano diversi tipi di danno che vanno dalla riduzione della crescita delle piante causato dalla distruzione di rametti e germogli sulle chiome, alla morte di arbusti e siepi pesantemente e reiteratamente infestati. Nel caso di infestazioni in vivai, in ambiente urbano o in aree ad alta frequentazione turistica, non ultimi sono i danni di natura estetica rappresentati dal disseccamento delle chiome o loro porzioni con i conseguenti incrementi di costo relativi alla gestione del verde.
Xylosandrus compactus può causare gravi infestazioni nelle aree litoranee a seguito di freddi invernali molto intensi, soprattutto se accompagnati da forti venti. Anche siccità prolungate e ondate di calore possono essere all’origine delle pullulazioni dello scolitide. Gravi danni si registrano con crescente frequenza in Italia centro-meridionale, dove boschi di macchia mediterranea, vivai di piante forestali e ornamentali e verde urbano presente in parchi, giardini e viali vengono attaccati e devastati in poche settimane ([30], [19], [7]). Danni economici importanti sono stati recentemente registrati anche in località turistiche della Lombardia (lago di Garda) e del Veneto (litorale veneziano) dove X. compactus ha colpito siepi e alberature.
L’insetto tende a innescare focolai di infestazione a danno di gruppi di piante indebolite; si tratta in molti casi di episodi parassitari di modesta rilevanza, che si estinguono spontaneamente. Se però le condizioni di indebolimento dei soprassuoli circostanti persistono a lungo si può assistere a un’esplosione demografica di questi insetti con infestazioni particolarmente intense. Un segnale dell’aumento delle popolazioni è costituito dall’osservazione di un gran numero di germogli arrossati e disseccati sulle chiome di siepi e arbusti, e in misura minore di piante arboree.
La sintomatologia degli attacchi è piuttosto caratteristica e presenta un modello costante. La maggior parte delle piante colpite presenta evidenti fenomeni di disseccamento di germogli, rametti e piccole branche o loro porzioni, con successivo arrossamento periferico della chioma. Sui germogli neo-lignificati vi è inoltre la presenza di piccoli fori circolari di colonizzazione, di solito collocati sulla porzione infera del rametto.
Nel caso di attacchi diffusi su gran parte della chioma il disseccamento dei giovani rametti presenta ripercussioni sullo stato di salute generale dell’intera pianta, causando importanti danni estetici su piante ornamentali ed economici nel settore vivaistico. Il disseccamento dei rametti colpiti compare in media dopo 7-10 giorni dal momento della colonizzazione, con un iniziale imbrunimento dei tessuti corticali adiacenti al foro d’ingresso della femmina. Nel giro di pochi giorni tale imbrunimento si estende verso l’alto interessando l’intera porzione superiore del ramoscello con contemporanea comparsa di necrosi corticale e un progressivo avvizzimento delle foglie che però non si distaccheranno dai rametti. I rametti colpiti disseccano e spesso vengono rotti dal vento cadendo a terra. È comune osservare un’alterazione cromatica del legno con imbrunimenti o azzurramenti dovuti ai funghi simbionti che si sviluppano partendo dalle camere di allevamento dell’insetto (Fig. 7). Il tutto risulta in un declino rapido e generico degli alberi, con chiome arrossate e successivo disseccamento periferico. Piante fortemente infestate deperiscono progressivamente e velocemente, divenendo suscettibili ad attacchi di altri parassiti e patogeni.
Fig. 7 - Caratteristici imbrunimenti del legno causati dai funghi simbionti (Foto: A. Vannini, DIBAF, Università della Tuscia, Viterbo).
Il danno è causato dall’azione meccanica di scavo delle gallerie all’interno dei rametti a cui si aggiungerebbe anche l’azione patogena di alcuni funghi associati all’insetto ([30]). Oltre ai funghi simbionti di X. compactus, quali Ambrosiella xylebori e Ambrosiella macrospora fondamentali per l’alimentazione larvale ma non patogeni per la pianta ([14]), l’insetto è vettore anche di funghi fitopatogeni, come Fusarium solani, Geosmithia pallida, Epicoccum nigrum ([24], [21], [8], [3], [10], [30]). Infine, altri parassiti fungini patogeni e batteri possono penetrare nei tessuti legnosi in modo autonomo attraverso i fori d’ingresso dell’insetto ([4]), comportando stress fisiologici con conseguente declino vegetativo che nei casi più gravi può divenire irreversibile portando a morte la pianta.
Indicazioni gestionali
L’aggressività e polifagia di X. compactus lo hanno reso specie esotica da quarantena in alcuni paesi quali il Marocco (dal 2018) e Israele (dal 2009). Dal 2017 l’agenzia europea per la protezione delle piante (EPPO) lo ha inserito nella Alert List per i paesi della comunità europea, al fine di attirare l’attenzione dei paesi membri su un parassita che potrebbe rappresentare un rischio economico o ecologico per i loro territori. La Francia, ad esempio, ha eseguito una specifica valutazione del rischio fitosanitario associato alla potenziale introduzione di X. compactus nei suoi confini ([2]). Al riguardo, la gestione delle popolazioni di X. compactus si basa sulla realizzazione contemporanea e integrata di varie azioni, come di seguito illustrato.
La manutenzione del verde e la prevenzione delle infestazioni
La difesa dalle infestazioni di X. compactus deve essere in primo luogo di tipo preventivo ([22]), cercando di mantenere le piante nelle migliori condizioni vegetative possibili, evitando ad esempio traumi o danni eccessivi a chioma e radici, garantendo il necessario apporto idrico durante le stagioni più asciutte e calde, e fornendo un’adeguata concimazione di supporto ([9], [3]). È inoltre necessaria un’attenta sorveglianza delle condizioni generali di salute degli alberi e delle siepi provvedendo, ove possibile, al loro miglioramento tramite irrigazioni di soccorso, concimazioni mirate e aerazione del suolo.
Nel caso si optasse per una sostituzione totale o parziale di siepi o verde urbano la cui funzione estetica venga compromessa da gravi attacchi di X. compactus, si consiglia l’utilizzo di specie vegetali non annoverate nella lista dei potenziali ospiti del parassita. L’utilizzo di più specie diverse permetterebbe inoltre una maggiore distribuzione del rischio di possibili futuri attacchi da parte di altri parassiti che andrebbero a interessare solo una parte delle nuove piante messe a dimora.
Il monitoraggio delle popolazioni
Al fine di avere un preciso quadro della situazione epidemiologica é necessario compiere un monitoraggio continuo delle popolazioni di X. compactus ([5]). Questo può essere eseguito utilizzando vari modelli di trappole di colore nero; di solito a imbuti sovrapposti (multifunnel) o a pannelli incrociati. A parità di efficacia le trappole multifunnel sono più discrete, più maneggevoli, più resistenti al vento e occupano meno spazio per il deposito invernale. In questi contesti le trappole sono molto utili non solo per una rapida valutazione della diffusione dell’insetto in nuove aree, ma anche per quantificare la densità delle sue popolazioni e le relative variazioni fra stagioni e anni, e infine per identificare con precisione i periodi di volo delle femmine e quindi pianificare in modo mirato luoghi e tempistica degli interventi necessari per contenere il parassita ([1], [25]). Le trappole dovranno essere esposte a inizio primavera (fine marzo) agganciandole a un paio di metri da terra su tutori, pali o recinzioni, ma mai direttamente sulla vegetazione, e dovranno essere collocate ad almeno una decina di metri dalle piante più vicine. Dovranno essere fissate anche nella parte inferiore per evitare danni da vento e l’effetto “bandiera”. Saranno poi attivate con appositi erogatori che liberano etanolo nell’aria, sostanza che si è dimostrata attrattiva per X. compactus ([5]). L’erogatore sarà fissato esternamente alla trappola a circa metà della sua altezza. Il monitoraggio dovrà continuare fino a fine settembre e le trappole dovranno essere controllate e svuotate settimanalmente, contando gli insetti catturati e conservando l’informazione in modo da poter riscostruire le curve di volo a fine monitoraggio.
Gli erogatori di etanolo dovranno essere sostituiti periodicamente, di solito una volta al mese (ma dipende dalla marca). Non è necessario allestire un grande numero di trappole in quanto la loro funzione è principalmente di monitoraggio e non di lotta. Le trappole e le sostanze attrattive consigliate non sono pericolose per l’uomo e gli animali domestici.
La bonifica fitosanitaria
In caso di infestazioni in corso sarà necessario intervenire il prima possibile sul materiale colonizzato procedendo alla sua distruzione al fine di eliminare le covate dell’insetto in fase di sviluppo nel legno. Questo tipo di interventi è di importanza prioritaria e ottiene ottimi risultati in caso di infestazioni non troppo estese e intense, quando la potatura dei rametti interessa una parte contenuta della chioma ed è manualmente praticabile in tempi brevi ([16]). In condizioni di gravi e pesanti infestazioni che coinvolgono oltre il 50% della chioma di piante, siepi o cespugli, le potature di bonifica divengono invece particolarmente costose, di difficile realizzazione pratica e dai risultati incerti in quanto si arreca alla pianta un danno (fisiologico ed estetico) a volte peggiore di quello arrecato dall’insetto. Le potature devono inoltre essere condotte nei tempi compatibili con lo sviluppo dell’insetto, in quanto asportare ramoscelli già abbandonati dal parassita è inutile dal punto di vista fitosanitario, e in caso di grandi infestazioni che si sviluppano su ampie superfici ciò non è sempre possibile. Si ricorda, al riguardo, che i sintomi di colonizzazione di rametti e fusticini (che nel frattempo rimangono asintomatici) compaiono solo dopo circa un paio di settimane dalla penetrazione della femmina, ovvero solo poche settimane prima dallo sfarfallamento dei nuovi adulti, per cui il tempo a disposizione per individuare i ramoscelli colpiti e procedere con potature efficaci si riduce notevolmente. In tale contesto risulta invece particolarmente utile - soprattutto su piante sempreverdi - la bonifica fitosanitaria condotta in inverno sulla generazione che sverna all’interno dei rametti colonizzati a fine estate. Questa azione consente di disporre del tempo necessario per intervenire, presenta ridotti danni fisiologici alle piante che sono in diapausa invernale, se svolta correttamente incide notevolmente sulla densità della popolazione dell’insetto, e permette di “ripulire” la vegetazione facilitando quindi il monitoraggio di nuovi attacchi che eventualmente si dovessero ripresentare nella primavera successiva.
Tutto il materiale di risulta prodotto dagli interventi di bonifica fitosanitaria dovrà essere prontamente distrutto per abbruciamento.
La protezione chimica
Specifici interventi di protezione chimica possono essere realizzati al fine del contenimento delle infestazioni. Si fa presente tuttavia che contro questo gruppo di parassiti non esistono interventi chimici di tipo curativo delle piante colpite, nemmeno con trattamenti insetticidi di tipo sistemico ([26]). Prove sperimentali di lotta condotte in Spagna mediante trattamenti endoterapici realizzati tramite iniezioni al fusto di prodotti a base di abamectine non hanno fornito risultati soddisfacenti in quanto due mesi dopo il trattamento erano ancora presenti larve in attività nel legno ([23]). La colonizzazione degli insetti, alterando i normali flussi linfatici, impedisce infatti alle linfe di circolare normalmente nei tessuti legnosi e di trasportare i principi attivi dei prodotti insetticidi utilizzati. Si tratta inoltre di “parassiti di profondità”, ovvero di insetti che vivono e si sviluppano in profondità nel legno nutrendosi di funghi, e quindi difficilmente raggiungibili con normali trattamenti insetticidi. Si può tuttavia cercare di colpire gli adulti durante lo sfarfallamento dai ramoscelli infestati o durante la fase di prima colonizzazione dei nuovi ospiti ([31], [3]), al fine di abbattere la popolazione del parassita e proteggere piante e loro porzioni ancora sane. Gli interventi di protezione chimica possono essere eseguiti solo in ambienti confinati e facilmente accessibili (vivai, siepi, giardini privati) nell’ambito di un programma di trattamenti adulticidi che preveda aspersioni con atomizzatori realizzate irrorando il sottochioma di piccole piante, arbusti e siepi, ed eventualmente condotti in modo combinato contro altri parassiti ([16]). Al riguardo è opportuno optare per prodotti insetticidi distribuiti in soluzione acquosa che agiscano per contatto o ingestione, e che presentino una buona capacità abbattente nei confronti degli adulti ma una bassa persistenza nell’ambiente. Le epoche di intervento verranno calibrate sulla base dei dati ottenuti mediante il monitoraggio condotto con le trappole.
Il contenimento delle infestazioni può essere dunque realizzato tramite una serie di azioni dirette e indirette finalizzate al miglioramento delle condizioni vegetative delle potenziali piante ospite e al contenimento del parassita mediante interventi di lotta meccanica (bonifica) e chimica (trattamenti insetticidi). Un’attenta sorveglianza visiva delle condizioni generali di salute delle piante e un monitoraggio continuo delle popolazioni mediante trappole attrattive si rendono necessari al fine di valutare la densità di popolazione del parassita e il successo degli eventuali interventi di controllo posti in essere.
Bibliografia Citata
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar