Are the conditions of the Italian forests worsening due to extreme climatic events? Evidence from the national monitoring networks ICP Forests - CON. ECO.FOR.
Forest@ - Journal of Silviculture and Forest Ecology, Volume 19, Pages 74-81 (2022)
doi: https://doi.org/10.3832/efor4134-019
Published: Jul 12, 2022 - Copyright © 2022 SISEF
Research Articles
Abstract
Tree defoliation and mortality are triggered in Europe by extreme climatic events that are recurring since the beginning of XXI century. Data from the ICP Forests monitoring networks reveal a general worsening of tree conditions in the last ten years, as consequence of the drought and heat waves that affected the Southern (2017) and Central Europe (2018-2019). In Italy a significant increase of defoliation and tree mortality, assessed on the extensive (Level I) monitoring network, was observed after the 2017 dry summer, which impacted mainly the broadleaved forests (beech and oak forests) in the peninsular regions. Coniferous forests of the alpine belt were severely impacted in 2021, probably because of the co-occurrence of multiple causes, involving windstorm and bark beetle attacks. Chestnut forests suffer from pest (insect and pathogen) attacks. The intensive (Level II) monitoring network provides cases of study and allows to carry out specific cause-effect studies concerning the physiological effects on the environmental impacts, as well to observe the ecological processes following the disturbing events. Defoliation caused by drought or pest attacks induces the loss of physiological defenses (namely non-structural carbohydrates), that need several years to be restored. Then, the occurrence of more frequent and repeated heat and drought waves can produce irreversible effects. In this view, the long-term forest health monitoring is key to detect the extent and direction of changes in forest structure and composition, and represents an important tool for forest conservation and management.
Keywords
Defoliation, Drought, Forest Health Monitoring, Heat Waves, ICP Forests, Tree Mortality
Introduzione
Dall’inizio degli anni 2000 gli eventi di estrema aridità e calore estivo sono sempre più frequenti in Italia ed in Europa. Magno et al. ([36]) evidenziano che nel primo ventennio di questo secolo tali ondate si ripetono in Italia ogni 4-5 anni ed è previsto un aumento della loro frequenza ed intensità nel futuro ([51], [29], [39], [32]). L’attenzione verso gli impatti di eventi climatici estremi sugli ecosistemi forestali entra in maniera consistente nella letteratura scientifica dopo l’ondata di caldo estivo del 2003 che interessò gran parte d’Europa ([7], [44]), e ancor di più a seguito delle forti siccità del 2017 in Italia ([46], [6]) e degli anni 2018-2019 nell’Europa centrale ([8], [48]). Estesi casi di mortalità degli alberi in Europa sono riportati da Caudullo & Barredo ([15]).
In Italia gli eventi di declino e mortalità delle foreste dovuti all’aridità e ad altri estremi climatici, nonché alle loro interazioni con agenti parassitari, sono ricorrenti dagli anni 2000. I casi più noti in letteratura riguardano il declino delle querce caducifoglie nell’Italia settentrionale, ed in particolare sono documentati i casi di moria di Quercus petraea (Matt.) Liebl. nei boschi di Carrega a Parma ([4]) e Quercus robur L. nel Parco del Ticino ([47]); il declino di Pinus sylvestris L. nelle Prealpi centro-occidentali ([38], [53]); l’impatto della siccità del 2017 su Quercus ilex e sulla vegetazione mediterranea nella Toscana meridionale ([42]) e la diffusa mortalità di specie quercine nell’Italia meridionale ([16]). A questi sono da aggiungere gli impatti di ricorrenti gelate tardive sulle faggete dell’Appennino centro-meridionale ([28], [17]) e i danni da vento nei boschi di conifere, con particolare riferimento a quelli provocati dalla tempesta Vaia nell’autunno 2018 nelle Alpi centro-orientali ([18]). La Fig. 1 riporta alcuni esempi di defogliazione e discolorazione (cioè cambiamento di colore, da verde a giallo o rosso o bruno) delle foglie osservati nel 2021 su latifoglie decidue.
Fig. 1 - Esempi di defogliazione e discolorazione (ingiallimenti) delle foglie in Fagus sylvatica (A-B) e Quercus pubescens (C-D). Le foto sono state scattate in Toscana nell’Agosto 2021.
L’estensione e l’intensità dei danni alle foreste provocati dagli impatti climatici e altri fattori biotici e abiotici (per es., inquinamento e deposizioni atmosferiche) è rilevata in maniera sistematica dalle reti di monitoraggio nell’ambito del programma pan-Europeo ICP Forests ([31], [37]), e in Italia dal programma CON. ECO.FOR. (CONtrollo ECOsistemi FORestali).
In questo articolo si riportano i risultati di 24 anni di monitoraggio delle condizioni delle foreste italiane, evidenziando in particolare l’impatto degli eventi climatici estremi (ondate di calore e siccità, tempeste di vento), che sono stati frequenti soprattutto negli ultimi anni. Vengono infine discussi alcuni limiti dell’attuale sistema di osservazione di lungo periodo e le possibili azioni realizzabili per renderlo più efficace anche ai fini della conservazione e gestione delle foreste.
Metodi
Lo studio condotto prende in esame i risultati delle reti italiane di monitoraggio dello stato di salute delle foreste. La rete CON.ECO.FOR. è attiva nella presente conformazione dal 1996 nell’ambito del programma pan-Europeo ICP Forests, ed è stata creata con l’obiettivo di studiare le interazioni ecologiche tra le componenti strutturali e funzionali degli ecosistemi forestali e i fattori ambientali di stress. Il sistema di monitoraggio è organizzato su due livelli: la rete estensiva (Livello I - i dati sono disponibili per il periodo 1998-2021), e la rete intensiva (Livello II - dati disponibili per il periodo 1996-2020). Le due reti sono state gestite inizialmente dal Corpo Forestale dello Stato e, attualmente, dalla struttura Carabinieri Forestale. Il principale parametro rilevato come indicatore dello stato di salute degli alberi in bosco è la defogliazione, che rappresenta la percentuale di foglie perse o non emesse rispetto ad un albero di riferimento considerato sano, cioè non defogliato ([19]). Per gli standard di defogliazione sulle specie principali si fa riferimento alle fotoguide di Müller & Stierlin ([40]) per le specie montane e Ferretti ([22]) per le specie mediterranee. La metodologia è definita da manuali comuni europei ([20] e precedenti versioni). La defogliazione è stimata visivamente utilizzando una scala proporzionale, con classi di entità del 5% (da 0% = pianta completamente sana, fino a 100% = pianta morta; alle piante completamente defogliate ma non morte viene attribuito il valore convenzionale 99%). Oltre alla defogliazione, sono rilevati anche i danni su foglie, rami e fusto. Si tratta di danni causati da agenti biotici, come insetti e funghi, e abiotici tra cui la grandine, il gelo, i fulmini, il fuoco. I criteri per la valutazione dei danni provocati da fattori biotici ed abiotici sui vari organi sono stati definiti, nell’attuale formalizzazione, dalla revisione del manuale comune a livello europeo del 2006, e sono entrati definitivamente a regime in Italia a partire dal 2010. I sintomi sono identificati e classificati per manifestazione visibile e agente di danno e vengono quantificati per mezzo di una scala semi proporzionale (0 = 0%, assenza di sintomi; 1 = 1-10%; 2 = 11-20%; 3 = 21-40%; 4 = 41-60%; 5 = 61-80%; 6 = 81-99%; 7 = 100%). I rilievi sono svolti annualmente nei mesi estivi (luglio e agosto), dal personale dei carabinieri forestali. Il programma di monitoraggio dello stato di salute delle foreste include azioni di QA (Quality Assurance), tra cui l’utilizzo di metodologie comuni per le due reti riguardo l’archiviazione, trasmissione ed elaborazione dei dati; la produzione di una manualistica nazionale ([27], [9]); lo svolgimento di corsi di intercalibrazione per il personale addetto ai rilievi in bosco e controlli in campo della loro capacità di valutazione delle chiome ([23]).
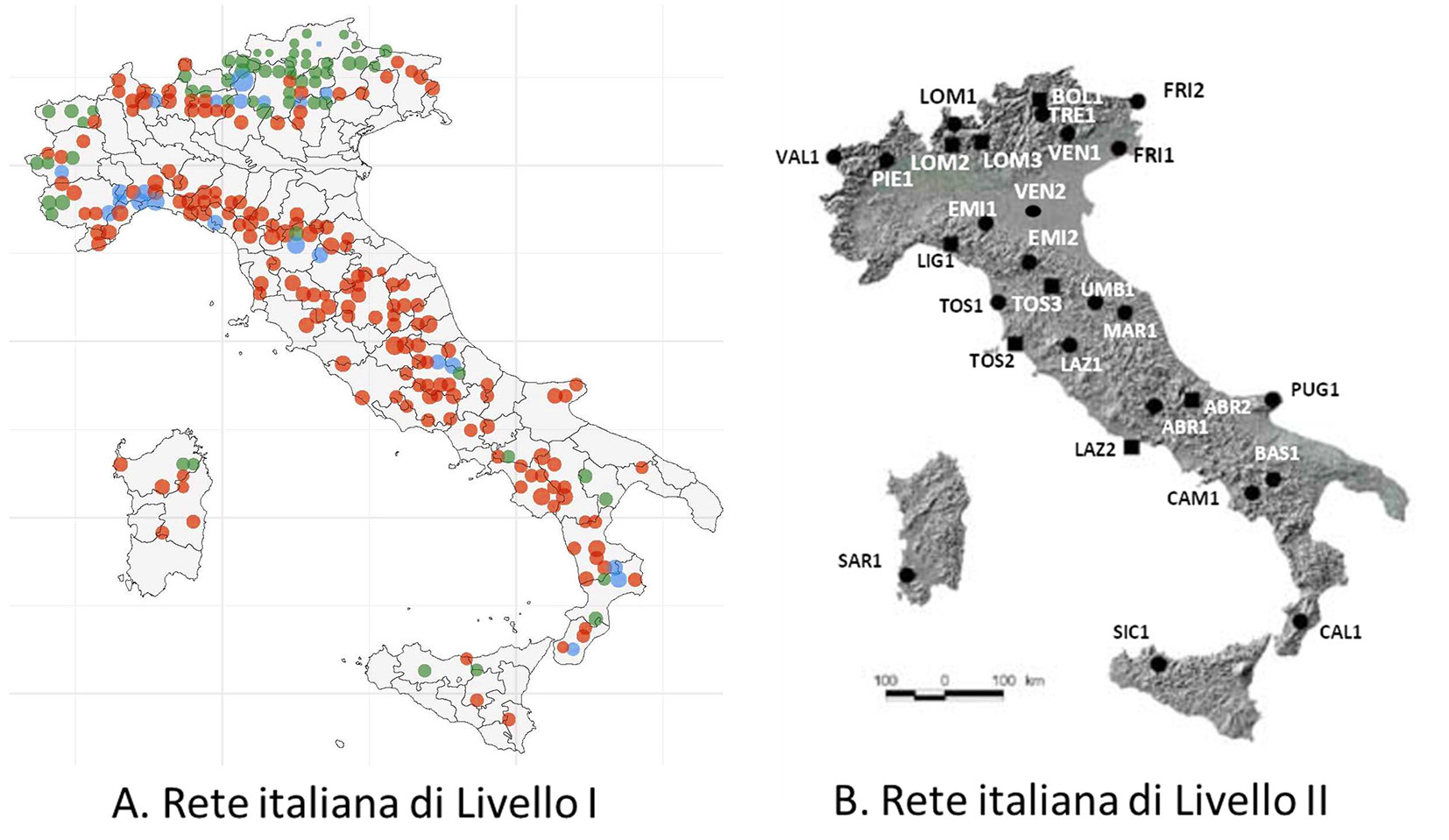
La rete di Livello I prevede la valutazione annuale della condizione delle chiome degli alberi. Questa rete include circa 260 aree circolari di 18 m di raggio (la metodologia è mutuata dall’inventario forestale nazionale - [27]) distribuite sull’intero territorio italiano secondo una rete 10 × 18 km, sulle quali sono radicati circa 5000 alberi con diametro minimo di 10 cm (Fig. 2A).
Fig. 2 - Distribuzione delle aree permanenti di monitoraggio nella rete di Livello I (A) e di Livello II (B). (A): i punti rossi rappresentano boschi di latifoglie, quelli verdi boschi di conifere e quelli celesti boschi misti; (B): le aree contrassegnate con un cerchio sono state attivate nel 2006, quelle con un quadrato sono state attivate successivamente (da: [41], modificata).
I dati qui presentati sono stati elaborati considerando la defogliazione media per area di saggio per il periodo 1998-2021. Questo periodo è stato suddiviso in due sottoperiodi di uguale durata (1998-2009 e 2010-2021) allo scopo di poter valutare le eventuali differenze negli andamenti nel medio e nel breve periodo. I risultati sono riportati per l’insieme di tutta la popolazione esaminata (defogliazione media per plot) e per le principali formazioni forestali: conifere montane (50 aree soprattutto a Picea abies (L.) Karts., ma includono anche Larix decidua L., Pinus cembra L. e Pinus sylvestris L.); faggete (38 aree a Fagus sylvatica L., per lo più monospecifiche); querceti decidui (54 aree a prevalenza di Quercus cerris L. e Quercus pubescens Willd., ma includono anche Quercus petraea (Matt.) Liebl., Quercus robur L. e specie accompagnatrici, come Ostrya carpinifolia Scop.); querceti sempreverdi (11 aree a Quercus ilex L. e Quercus suber L.); castagneti (18 aree a Castanea sativa Mill., per lo più monospecifiche).
La rete di Livello II comprende 32 aree distribuite in tutte le regioni italiane (Fig. 2B) e rappresentano le principali comunità forestali: peccete (Picea abies) e conifere montane (Larix decidua), faggete (Fagus sylvatica), querceti decidui (Quercus cerris), querceti sempreverdi (Quercus ilex), foreste planiziarie (Quercus robur e Carpinus betulus L.). Queste aree sono state attivate progressivamente a partire dal 1996 e sono state selezionate sulla base della proprietà (è stata privilegiata la proprietà pubblica), l’accessibilità e l’idoneità a poter consentire lo svolgimento delle varie attività di monitoraggio previste dal programma (raccolta e analisi delle deposizioni atmosferiche e della soluzione circolante dei suoli, rilevamento di parametri meteo-climatici, campionamento per l’analisi della chimica fogliare, misura degli accrescimenti).
Risultati
Risultati della rete di Livello I
Andamenti della defogliazione
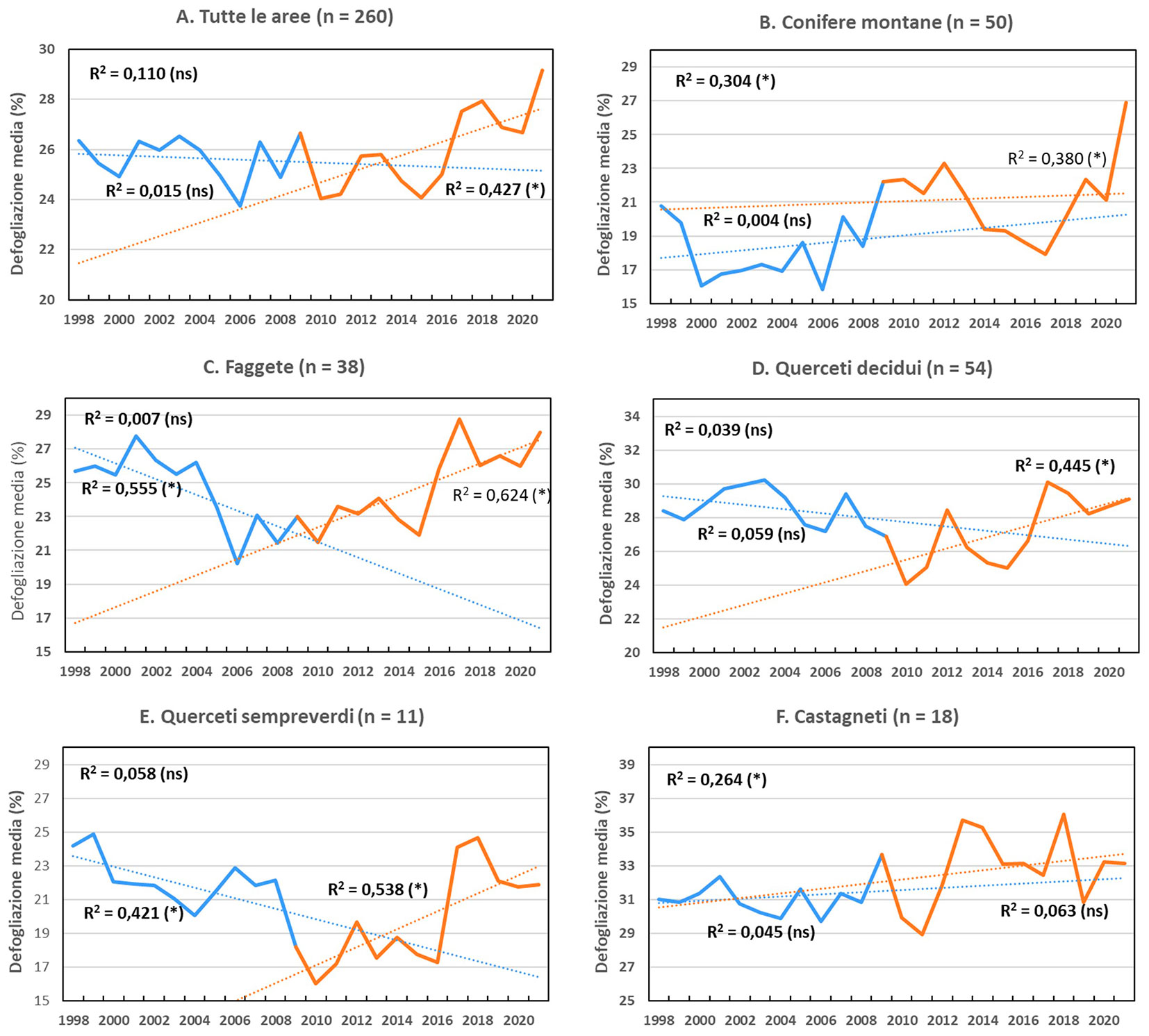
Nell’insieme di tutte le aree di saggio, per l’intero periodo considerato (1998-2021) la defogliazione non mostra un andamento significativo. Un significativo incremento di defogliazione, tuttavia, è stato osservato nel secondo sottoperiodo (2010-2021 - Fig. 3A).
Fig. 3 - Andamento della defogliazione media per area di osservazione, per tutte le aree complessivamente, e per tipo di bosco, suddiviso nei due sottoperiodi di osservazione (1998-2009 in blu; 2010-2021 in arancio). È riportato il coefficiente di regressione (R2) dell’intera sequenza (in alto a sinistra, nel riquadro) e dei due sottoperiodi. (ns): andamento non significativo; (*): andamento significativo (p < 0.05).
Nelle Fig. 3B-E sono mostrati gli andamenti della defogliazione nel corso del tempo per le varie tipologie forestali. Le faggete (Fig. 3C), i querceti decidui (Fig. 3D) ed i querceti sempreverdi (Fig. 3E) hanno un andamento simile fra loro: tutti e tre i gruppi presentano nel periodo 1998-2009 una riduzione della defogliazione (non significativa nei querceti decidui, ma significativa nelle faggete e nei querceti sempreverdi), ed un successivo significativo incremento nel periodo 2010-2021. Considerando il secondo sottoperiodo di osservazione, sempre negli stessi gruppi, i livelli di defogliazione maggiori sono stati osservati nel 2017. Nel 2012 è stato osservato un picco di defogliazione nel gruppo dei querceti decidui e, in misura minore, nei querceti sempreverdi. Specie coesistenti possono avere sensibilità differente, per esempio Quercus cerris ha mostrato una minore suscettibilità alla defogliazione rispetto a Quercus pubescens e Ostrya carpinifolia.
Le conifere montane (Fig. 3B) e i castagneti (Fig. 3F) hanno mostrato una tendenza significativa all’incremento di defogliazione nel corso dell’intero periodo 1998-2021, ma non nei due sottoperiodi. Tuttavia, in entrambi i casi, la defogliazione media del periodo 1998-2009 è significativamente inferiore (p<0.05) rispetto al periodo 2010-2021 (18.31% vs. 21.28% nelle conifere montane; 31.14% vs. 32.87% nei castagneti). Nell’ultimo anno di monitoraggio (2021) la defogliazione ha avuto un forte incremento nelle conifere montane, soprattutto a carico di Picea abies e Pinus sylvestris. I castagneti, d’altro canto, presentano i maggiori livelli di defogliazione rispetto a tutti gli altri tipi di bosco monitorati.
Sintomi di danno
La diffusione media per area dei sintomi fogliari è del 12.8%, quella dei sintomi sui rametti è 6.9%, senza andamenti significativi nel tempo (2010-2021). La diffusione dei danni sulle foglie, considerando tutte le aree ed anni di osservazione insieme, è correlata positivamente con la defogliazione (R2 = 0.294, p<0.05).
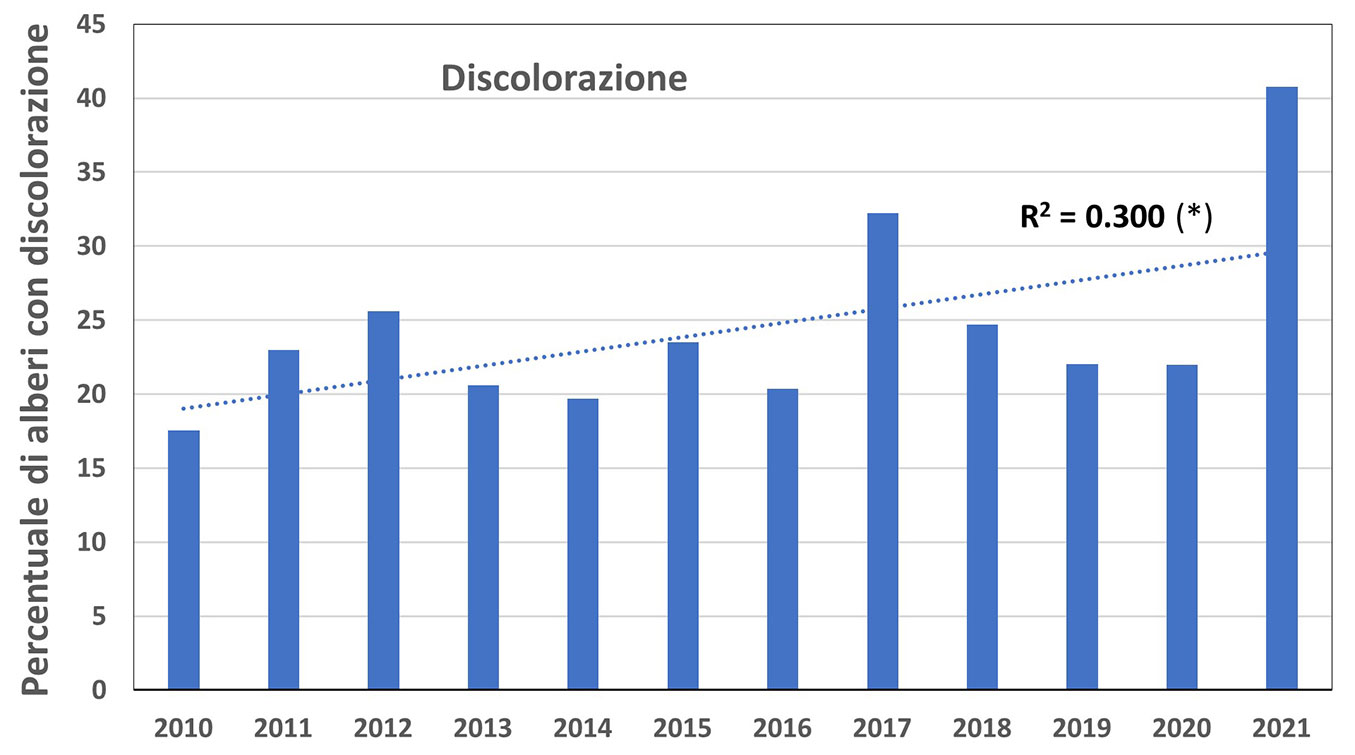
Analizzando la diffusione dei sintomi di danno fogliari e sui rametti, il contributo di ciascun tipo di sintomo (p.es., erosione o perdita dell’organo, alterazioni cromatiche) è stato quantificato come frequenza in percentuale di alberi che presentano quel dato sintomo. Da questa analisi emerge una chiara e significativa tendenza all’aumento del numero di alberi con alterazioni cromatiche (discolorazione) nelle foglie (Fig. 4). L’incidenza della discolorazione (ingiallimenti, arrossamenti, bronzature) nell’intero periodo di osservazione mostra dei picchi nel 2012 e nel 2017 e rimane su livelli alti anche negli anni successivi. Il livello massimo è raggiunto nel 2021, determinato soprattutto dall’incidenza dei danni osservata nei boschi di querce decidue e sempreverdi.
Fig. 4 - Percentuale di alberi interessati a discolorazione delle foglie (ingiallimenti, arrossamenti, imbrunimenti, necrosi) osservati nelle aree della rete di livello I per gli anni dal 2010 al 2021. È riportato il coefficiente di regressione (R2) dell’intera sequenza (andamento significativo - p < 0.05).
Mortalità
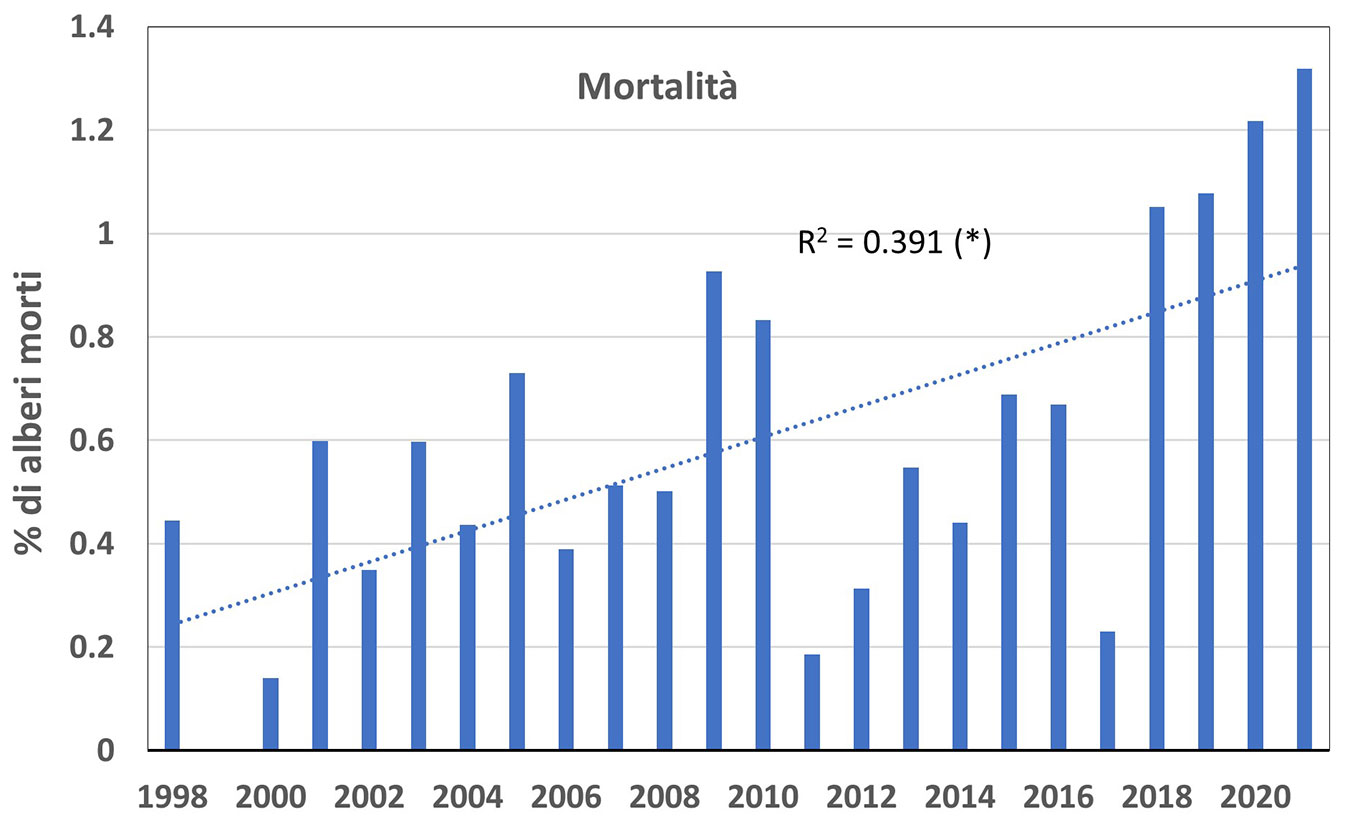
Un’ultima analisi è stata effettuata sulla mortalità forestale, intesa come la percentuale di alberi morti (cioè con defogliazione pari a 100%) fra due successive indagini annuali (gli alberi valutati nel corso di una campagna non vengono poi considerati l’anno successivo ed escono dal campione). Complessivamente, analizzando tutte le aree assieme, la mortalità degli alberi ha mostrato un andamento crescente statisticamente significativo (Fig. 5).
Fig. 5 - Percentuale di mortalità (alberi morti, ovvero con defogliazione = 100%) rilevati per ogni anno di monitoraggio nel periodo 1998-2021. Tutte le aree e le specie della rete di Livello I sono qui considerate insieme. È riportato il coefficiente di regressione (R2) dell’intera sequenza (andamento significativo, p < 0.05).
Risultati della rete di Livello II
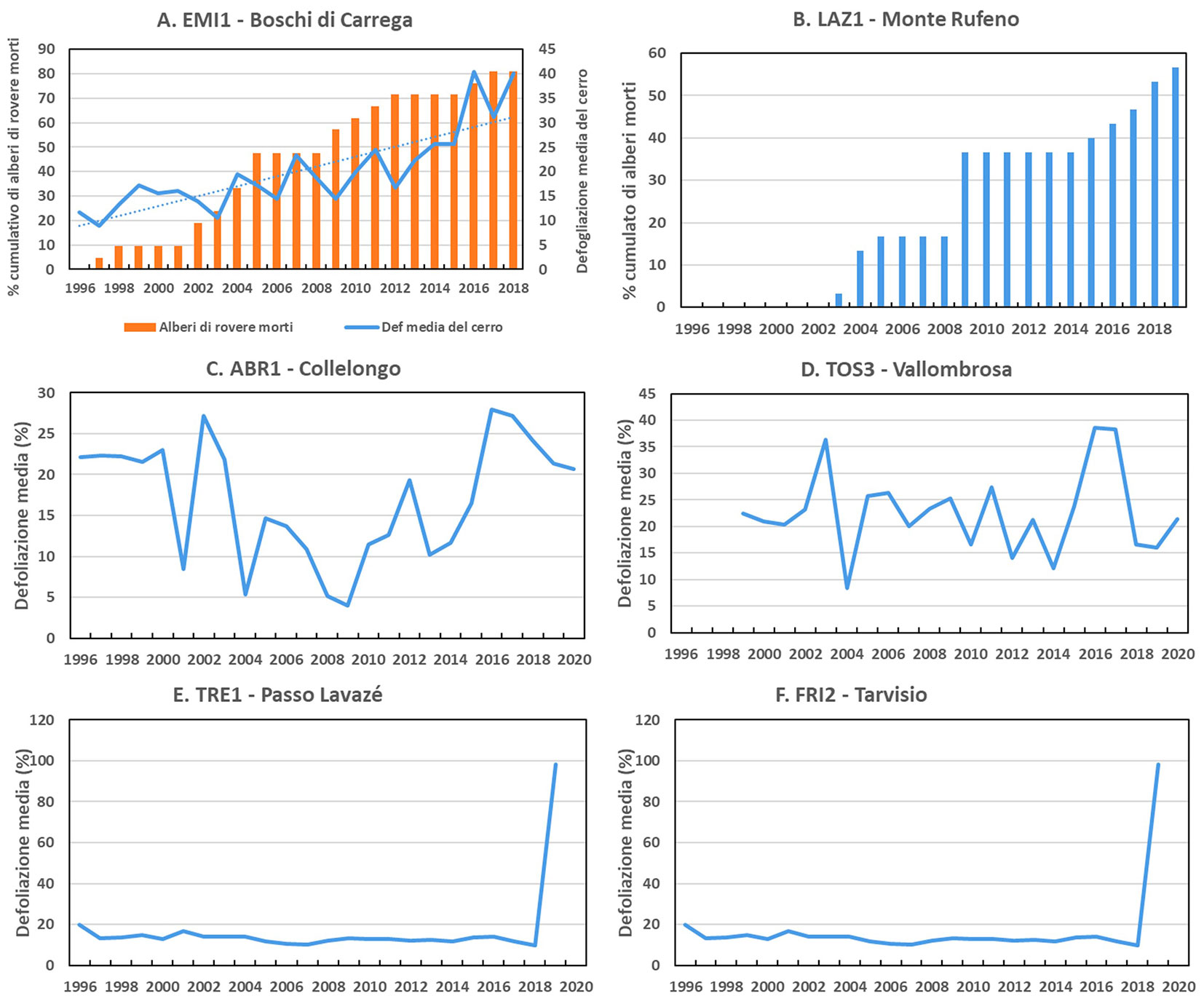
Essendo la rete di Livello II una serie di casi di studio per l’approfondimento dei processi e delle cause, l’analisi degli andamenti della defogliazione è stata effettuata su singole aree. Nella Fig. 6 sono riportati alcuni degli episodi di defogliazione e di mortalità degli alberi registrati sulla rete di Livello II nel periodo considerato. Sono state selezionate alcune aree sulle quali sono stati rilevati gli eventi di maggior rilievo. Nelle aree EMI1 (Fig. 6A - Boschi di Carrega, a Q. cerris e Q. petraea) e LAZ1 (Fig. 6B - Riserva di Monte Rufeno, a Q. cerris) si sono osservati alti livelli di mortalità degli alberi. Nel caso di EMI1 si tratta di una mortalità selettiva di Q. petraea rispetto a Q. cerris a seguito dell’ondata di calore del 2003, mentre nel caso di LAZ1 tale mortalità è probabilmente collegata ad attacchi di Lymanthria dispar L. che ha colpito il cerro, unitamente a condizioni di siccità. Anche in questo caso la mortalità ha avuto inizio nel 2003 ed è aumentata con attacchi successivi di insetti defogliatori fra il 2009 e il 2011. Consistenti attacchi di insetti defogliatori sono stati osservati anche in SIC1 (Ficuzza, Sicilia, a Q. cerris) con andamento crescente a partire dal 2014 e in LAZ2 (Circeo, Latina, a Q. ilex) fra il 2010 e il 2013. Per quanto riguarda le aree a faggio, si riportano i casi di ABR1 (Collelongo, L’Aquila) e TOS3 (Vallombrosa, Firenze). In entrambi i casi sono stati registrati alti livelli di defogliazione fra il 2016 e il 2017, legati agli effetti di una gelata tardiva, avvenuta nel 2016, seguita nel 2017 da una forte siccità estiva. Incrementi di defogliazione sulle aree a F. sylvatica sono stati osservati in maniera casuale e per lo più dovuti ad attacchi di defogliatori o avversità climatiche, anche in CAL1 (Piano Limina, Reggio Calabria) e LOM3 (Moggio, Lecco). Le conifere montane, soprattutto P. abies, hanno mostrato una sostanziale stabilità nei valori di defogliazione per la maggior parte del periodo di osservazione. Nel 2019 le aree del Trentino (Passo Lavazè, Trento) e del Friuli (Tarvisio, Udine) sono state colpite da gravi eventi catastrofici, che ne hanno distrutto il soprassuolo: la tempesta Vaia a Passo Lavazè e un violento attacco di bostrico (Ips typographus L.) a Tarvisio.
Fig. 6 - Andamento della defogliazione e mortalità degli alberi in alcune aree selezionate della rete di Livello II. (A) EMI1: Boschi di Carrega, Parma, Quercus cerris e Quercus petraea; (B) LAZ1: Monte Rufeno, Viterbo, Quercus cerris; (C) ABR1: Collelongo, L’Aquila, Fagus sylvatica; (D) TOS3: Vallombrosa, Firenze, Fagus sylvatica; (E) TRE1: Passo Lavazé, Trento, Picea abies; (F) FRI2: Tarvisio, Udine, Picea abies.
Discussione
Rete di Livello I
Nell’insieme del campione, il dato più rilevante è il significativo incremento della defogliazione nel sottoperiodo 2010-2021, che conferma quanto evidenziato da Potočić et al. ([43]) a livello europeo. L’andamento delle condizioni delle chiome dei boschi italiani monitorati in questi anni è guidato dagli incrementi di defogliazione media avvenuti in coincidenza o a seguito delle ondate di calore e aridità estiva del 2012 e del 2017 ([35], [46]) e, probabilmente, da effetti ritardati della tempesta di vento Vaia per quanto riguarda le conifere nell’arco alpino centro-orientale ([18]). È da osservare che la defogliazione rimane alta negli anni successivi agli eventi di disturbo confermando pertanto l’esistenza di un effetto ritardato (legacy effect - [50]). Il ripetersi di eventi estremi a distanza di tempo ravvicinata può impedire il pieno recupero fisiologico degli alberi danneggiati; infatti, la defogliazione indotta da eventi estremi di siccità, gelate tardive o attacchi di insetti determina la riduzione delle riserve di carboidrati non strutturali (NSC -[34], [17], [21]), che sono essenziali per regolare i processi di crescita e di difesa nelle specie legnose ([30]). Il ripristino di queste riserve ai livelli pre-impatto impiega vari anni, a seconda della specie, durante i quali gli alberi sono maggiormente vulnerabili nei confronti di ulteriori eventi di stress ([26]).
Le variazioni nella condizione delle chiome, e più in generale nello stato di salute degli alberi, nel corso del tempo sono il risultato della risposta di distinte popolazioni, che reagiscono in maniera indipendente e diversa tra loro ai differenti fattori ambientali e biotici. Le conifere, principalmente presenti nella regione alpina, sono soggette a condizioni climatiche ed ecologiche differenti rispetto alle latifoglie diffuse nell’Appennino e nella regione mediterranea. Fra le latifoglie, alcune specie sono maggiormente esposte all’azione di agenti biotici, come il castagno, che è soggetto principalmente all’attacco di insetti e funghi patogeni.
Le aree di monitoraggio a prevalenza di latifoglie, ad eccezione dei castagneti, mostrano andamenti di defogliazione simili fra loro. Gli alti valori di defogliazione registrati tra il 1998 e il 2000 sono probabilmente legati ad una serie di estati siccitose verificatesi negli anni ’90 del secolo scorso, mentre i più recenti picchi di defogliazione del 2012 e 2017 sono attribuibili ad eventi climatici estremi di quegli anni ([13]). L’incremento di defogliazione del 2016 nelle faggete è dovuto alla gelata tardiva avvenuta in Aprile 2016, come descritto da Greco et al. ([28]) e D’Andrea et al. ([17]). Le variazioni dei livelli di defogliazione, nelle varie specie e tipologie di bosco analizzate nel presente studio, sono accompagnate da corrispondenti variazioni dei sintomi fogliari di danno, con particolare riferimento alle discolorazioni.
Le conifere montane e i castagneti mostrano andamenti di defogliazione ben distinti da quelli delle altre specie. L’aumento della defogliazione nel 2021 nelle conifere montane è un fenomeno complesso, connesso probabilmente ad un effetto ritardato della tempesta Vaia (Ottobre 2018), che ha compromesso la stabilità degli alberi, con problemi a livello radicale, ed ha aumentato la probabilità di attacco di I. typographus a causa dell’accumulo di grandi quantità di legno morto in bosco. La combinazione di stress climatici e l’azione di insetti corticali è un rischio diffuso nelle foreste europee ([33]). Analizzando lo stato delle chiome delle conifere montane, un contributo importante alla defogliazione è dato da P. sylvestris il cui declino, a partire dalla siccità del 2003, è documentato per vaste aree del versante meridionale delle Alpi ([38], [53], [45]) ed è associato all’azione di insetti corticali ([54]). Castanea sativa è stato colpito per molti anni da attacchi parassitari da Cryphonectria parasitica (Murr.) Barr. e Phytophthora cambivora (Petri) Buisman, patogeni che producono tumori e lesioni corticali. Recentemente il castagno ha subito anche un attacco da parte della vespa asiatica Dryocosmus kuriphilus Yasumatsu ([3]), con produzione di galle nelle gemme, che hanno causato alterazioni dello sviluppo dei rametti, e conseguente perdita della chioma e della produzione di frutti ([3]).
L’aumento del tasso annuo di mortalità è un importante indicatore della salute delle foreste soggette al cambiamento climatico ([2]). Negli anni 1998-2009 la mortalità degli alberi in bosco non ha avuto particolari variazioni rispetto ai valori considerati di fondo, come definito da Bertini et al. ([5]) per i boschi italiani, pari a 0.5% anno. Il tasso di mortalità è cresciuto a livelli superiori all’1% negli anni successivi al 2017, confermando una tendenza all’aumento della mortalità a livello europeo ([49]).
Rete di Livello II
Le aree della rete di Livello II sono costituite perlopiù da boschi maturi di alto fusto, che crescono in ambienti favorevoli per giacitura, esposizione e fertilità. Nelle singole aree l’entità e gli andamenti della defogliazione, nel corso degli anni, sono stati influenzati da eventi specifici, quali attacchi parassitari, avversità climatiche, che hanno causato forti variazioni anno per anno; per cui tali andamenti non sono comparabili tra loro.
La rete di Livello II si è rivelata un efficace strumento per lo studio dei rapporti causa-effetto e delle dinamiche e conseguenze ecologiche di singoli eventi di disturbo. Si riportano per esempio i casi riguardanti le aree a Picea abies del Trentino e del Friuli che nel 2019 sono state soggette a eventi catastrofici dovuti rispettivamente alla tempesta Vaia e ad attacchi di bostrico. Questi episodi confermano la presenza di problemi specifici sui boschi alpini di conifere ([33]), già evidenziata dai risultati della rete di Livello I. Il monitoraggio di lungo periodo consente di osservare i processi di recupero ed evoluzione naturale di questi soprassuoli. Altrettanto importanti sono i cambiamenti vegetazionali e strutturali a seguito del declino di singole specie (Boschi di Carrega, Emilia-Romagna - [4]); la mortalità indotta dall’interazione fra aridità, insetti defogliatori e parassiti di debolezza (Monte Rufeno, Lazio); i processi di recupero fisiologico delle faggete soggette a gelate tardive e siccità estiva (Collelongo, Abruzzo - [17]).
La raccolta costante di dati di alta qualità rappresenta nel lungo periodo un’eccellente piattaforma per ospitare e sviluppare ricerche specifiche, utili anche per l’interpretazione in chiave ecologica e fisiologica dei risultati della rete estensiva di monitoraggio dello stato di salute delle foreste italiane. In quest’ottica rivestono molta importanza le iniziative volte a fornire una elaborazione dei dati che integri le diverse variabili investigate ([1], [24], [25], [41]) in un quadro coerente dal punto di vista ecologico. Infine, la rete di Livello II è integrata nella piattaforma per l’implementazione della Direttiva (UE) 2016/2284 (rete NEC - National Emission Ceilings), per il controllo degli effetti dell’inquinamento atmosferico sugli ecosistemi forestali e di acque dolci.
Conclusioni
Mentre nel periodo di monitoraggio 1998-2021 (24 anni) non sono state osservate tendenze significative nell’intero campione esaminato, un significativo incremento della defogliazione è stato registrato nel secondo sottoperiodo (2010-2021). Inoltre, in alcune tipologie forestali (faggete e querceti sempreverdi), una significativa riduzione della defogliazione nel sottoperiodo 1998-2009 è stata seguita da un altrettanto significativo aumento nel sottoperiodo 2010-2021. Ciò può far ipotizzare che in un più lungo periodo si possano susseguire fasi di impatto (aumento della defogliazione) e fasi di recupero (riduzione della defogliazione).
Tuttavia, in condizioni di rapidi cambiamenti climatici, in previsione di eventi estremi con frequenza sempre più ravvicinata e con tempi sempre più brevi per il recupero fisiologico degli alberi, possiamo prevedere che possa avvenire un’irreversibile tendenza all’aumento della defogliazione, con conseguenti interazioni con parassiti di debolezza e, alla fine, un aumento della mortalità degli alberi, con innesco di importanti cambiamenti nella composizione e struttura delle foreste.
In quest’ottica il monitoraggio della salute delle foreste rappresenta uno strumento fondamentale per poter conoscere l’entità e la direzione dei cambiamenti, nonché per valutarne le cause scatenanti e i fattori contribuenti. Il monitoraggio, tuttavia, può acquistare maggiore efficacia lavorando in due direzioni: (i) aumentare la capacità di intercettazione dei disturbi forestali e la loro distribuzione nello spazio e nel tempo, incrementando le osservazioni a terra su reti locali di monitoraggio, grazie anche alla collaborazione con cittadini ([14]) e la loro restituzione per mezzo di remote sensing ([52]); (ii) migliorare la qualità dell’informazione con l’introduzione di specifici indicatori di tipo fisiologico per misurare la vitalità e la resilienza degli alberi ([10], [11], [12]).
Ringraziamenti
La ricerca è stata svolta nell’ambito del progetto “LIFE MODERn(NEC) - new MOnitoring system to Detect the Effects of Reduced pollutants emissions resulting from NEC Directive adoption” - LIFE20 GIE/IT/000091.
Siamo grati al personale Carabinieri Forestale per la raccolta dei dati in campo per tutto il periodo dello studio.
References
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar