Microbial indicators as innovative methods to assess the performance of woody crops in soil organic carbon sequestration and natural resource valorisation
Forest@ - Journal of Silviculture and Forest Ecology, Volume 21, Pages 48-54 (2024)
doi: https://doi.org/10.3832/efor4610-021
Published: Jun 23, 2024 - Copyright © 2024 SISEF
Research Articles
Abstract
Molecular techniques for studying soil microorganisms allow to quantify the presence of specific functional groups from the total soil DNA and thus to assess their dynamic in response to the land use. Using this approach, a study was carried out to assess the increase the soil organic carbon (C) of arable land in the central Po Valley with three woody species (white willow, black locust, hybrid poplar) in short rotation forestry. Being fungi the most involved microorganisms in the C-cycle and representing the larger part of microbial biomass in volume, total fungi e the two most widespread main fungal degraders in the upper soil layer (Ascomycetes and Basidiomycetes) were used as indicators of the effectiveness of land use in increasing soil organic C. An innovative molecular technique (SYBR® Green I dye on the QuantStudio™ 3D digital PCR system) which allows to overcome the critical issues associated with the relatively low concentration of fungal DNA compared to that of bacteria was used. Compared to the ploughed soil, total organic carbon (TOC), microbial biomass and enzyme activities increased significantly in the woody plantations. However, TOC increased to different degrees among the woody species. White willow and black locust showed a greater increase in soil TOC than arable (+30 and 20% respectively), followed by hybrid poplar with a smaller increase of +12%. The increases in soil TOC in the three plantations were not correlated with the total woody mass, assessed 15 years after abandonment. Total fungi and Ascomycetes were highly correlated with microbial biomass and TOC, while Basidiomycetes were not. Ascomycetes, which commonly prevail in agricultural soils, were still the most abundant even after a short rotation forest cycle of 15 years and can be taken as good indicator of C sequestration activities into the soil. Soil tillage strongly reduced the content of Basidiomycetes and short rotation forestry managed to increase it at least 4-5 times over a 15-year cycle of short rotation forestry, suggesting that it can act as a qualitative indicator of C sequestration. Since Basidiomycetes have different biological and morphological characteristics than Ascomycetes, combining them (i.e., as Ascomicetes:Basidiomycetes ratio) seems to be a good option for choosing the most suitable woody species for carbon accumulation in agricultural soils.
Keywords
Soil Fungi, Ascomycetes, Basidiomycetes, Short Rotation Forestry, Hybrid Populus (Populus × canadensis), White Willow (Salix alba L.), Black locust (Robinia pseudoacacia L.)
Introduzione
Le strategie finalizzate alla riduzione delle emissioni di gas serra nei suoli agricoli sono essenzialmente mirate a: (i) arricchire il suolo di carbonio (C) organico incorporando residui colturali o biomasse derivati da rifiuti valorizzati come compost, biochar e biodigestati ([3], [25]); (ii) contrastare la perdita di C attraverso il no-tillage, la lavorazione ridotta o minima, la pacciamatura e altre pratiche di conservazione e ripristino ([12], [7], [35]); (iii) realizzare sistemi agroforestali in grado di combinare diversi usi del suolo puntando sulle biomasse legnose epigee ed ipogee come principali pool di C ([1], [19]). In questo contesto, la Short Rotation Forestry (SRF), ossia la coltivazione di alberi a crescita rapida che raggiungono le dimensioni economicamente ottimali in un periodo variabile da 8 a 20 anni a seconda della specie vegetale, è uno degli usi del suolo ritenuto più idoneo per aumentare il sequestro di carbonio nei terreni agricoli ([16], [18]). Tuttavia, molto ancora va studiato sulla capacità effettiva delle diverse specie legnose di incrementare il contenuto di sostanza organica dei suoli. In tal senso, non è mai stata svolta una indagine organica in diversi ambienti, ma è stata invece valutata questa capacità con una serie di casi studio condotti in ecosistemi diversi. Alcuni di questi studi hanno dimostrato che la capacità di accumulo di C nel suolo è più elevata in boschi di conifere rispetto a quelli di latifoglie ([15]), altri non hanno rilevato differenze tra boschi di conifere e di latifoglie ([13]), altri ancora hanno evidenziato una maggiore capacità di accumulo di carbonio nelle latifoglie ([14]). Questi risultati contrastanti indicano che l’interazione specie legnose-ambiente, in particolare il tipo di suolo, l’uso del suolo e il clima, influiscono profondamente sui processi biologici del ciclo del C ([15], [20]). Poiché molti sono gli studi che supportano un ruolo dominante dei funghi sui batteri nel ciclo del C ([2], [32]) e la loro concentrazione nel suolo è fortemente influenzata dalla lavorazione del terreno ([33], [9]), sono stati ampiamente riportati come indicatori per le strategie volte ad aumentare il sequestro di C ([24]). Il gruppo funzionale più numeroso di funghi del suolo è quello dei funghi saprotrofi, responsabili della degradazione della sostanza organica grazie alla loro ampia gamma di processi metabolici e biotrasformazioni ([34]). Fra questi, i due gruppi più rappresentati nello strato superficiale in cui si massimizzano i processi biologici sono gli Ascomiceti ed i Basidiomiceti. I primi sono rappresentati soprattutto dai microfunghi che si diffondono nel suolo come spore attraverso la soluzione circolante e per questo prevalgono nei suoli coltivati. Questo gruppo è particolarmente attivo nella degradazione dei residui erbacei ed ha una grande adattabilità ai diversi ambienti. I Basidiomiceti invece colonizzano il suolo con ife e strutture miceliali molto più spesse (rizomorfe) e per questo sono molto più sensibili alle lavorazioni degli Ascomiceti. Inoltre, hanno la capacità peculiare di poter degradare completamente la lignina, e per questo sono tipici dei suoli forestali ([21]).
A partire dalle suddette considerazioni, prendendo come riferimento un areale intensamente coltivato affetto da declino della sostanza organica quale la pianura Padana centrale e orientale, classificate a rischio desertificazione già dagli inizi degli anni 2000 ([37]), è stato svolto uno studio sulla possibilità di incrementare la sostanza organica dei suoli con la SRF, utilizzando i funghi del suolo come indicatori quantitativi e qualitativi dei processi relativi al ciclo del carbonio.
Materiali e metodi
Area studio e campionamento del suolo
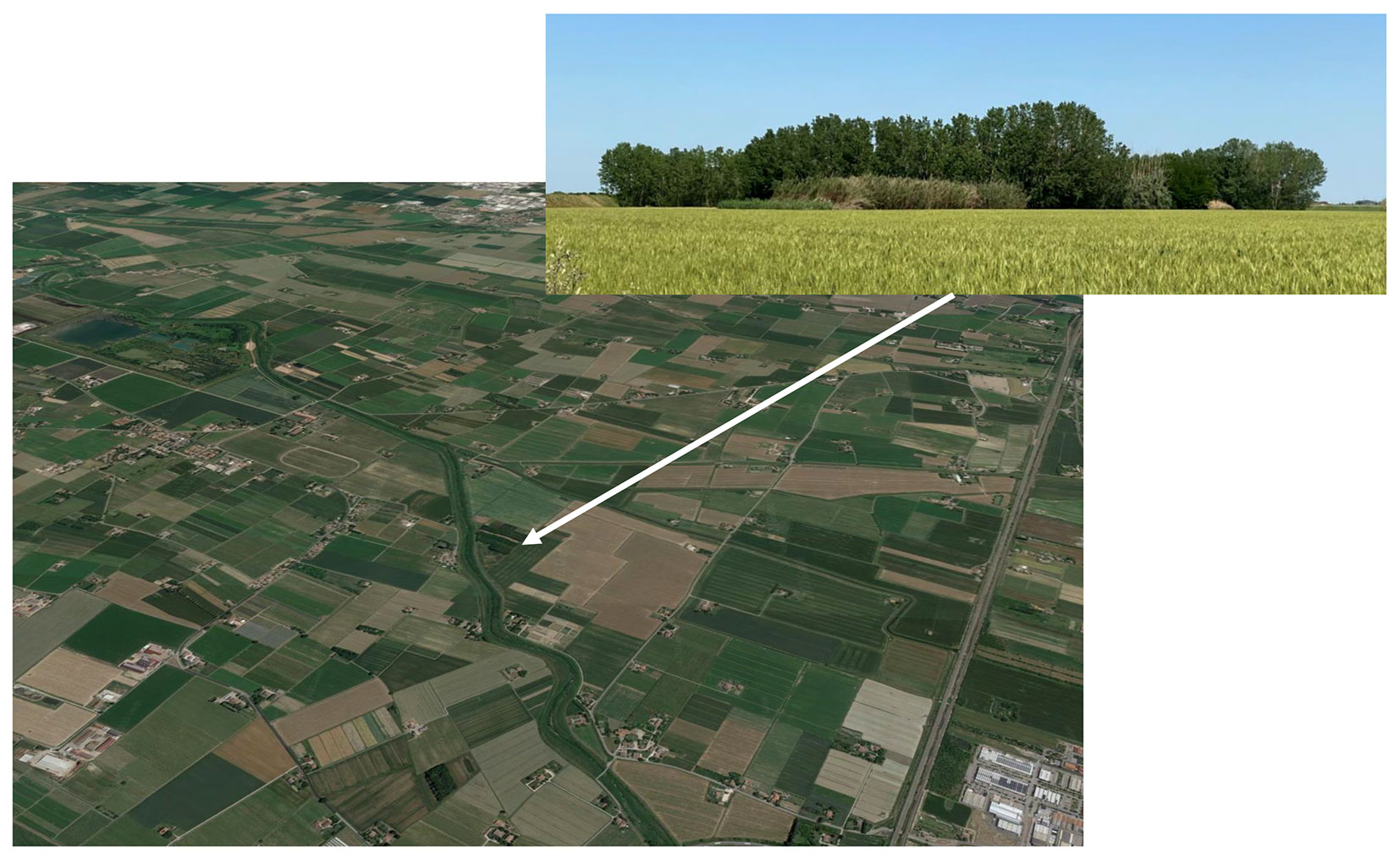
Lo studio è stato svolto nel 2022 in un’area sperimentale allestita all’inizio degli anni 2000 in un’area coltivata della Pianura Padana nel comune di Anzola dell’Emilia, in provincia di Bologna (Fig. 1). L’obiettivo originale dell’impianto riguardava il cambiamento di destinazione d’uso del suolo da seminativo a SFR per la produzione di biomassa ad uso energetico. Le specie arboree confrontate erano: (i) pioppo ibrido (Populus × canadensis); (ii) salice bianco (Salix alba L.) e (ii) robinia (Robinia pseudoacacia L.).
Fig. 1 - Vista aerea dell’area in intensamente coltivata in provincia di Bologna in cui è localizzata la prova a lungo termine di piantagioni con 3 essenze legnose.
L’impianto di SRF consisteva in tre piantagioni adiacenti della superficie di circa 3500 m2 , ciascuna allestita con disposizione su 12 file di 164 m di lunghezza nel 2002 in un’area precedentemente coltivata a seminativo, con un contenuto medio di sostanza organica pari a 1.1%. Interventi colturali quali concimazione con azoto e fosforo, irrigazione di soccorso e controllo delle malerbe, erano stati applicati solo nella prima stagione di crescita per garantire la sopravvivenza delle giovani piante ([28]). A seguito di tre tagli a cadenza biennale con rimozione di tutta la biomassa epigea ad un’altezza di 0.1 m, le piantagioni erano state abbandonate nel 2007, diventando un SRF ad evoluzione naturale. Al momento del campionamento, nel maggio 2022, è stato assunto come appezzamento controllo un arativo adiacente alle piantagioni, che verrà di seguito indicato come “seminativo”. In questo appezzamento, la gestione convenzionale applicata in zona ai sistemi erbacei era stata mantenuta inalterata dal 2002. L’incremento del contenuto in TOC e di tutti i parametri chimici e biochimici nelle piantagioni legnose di questo studio è stato valutato assumendo come riferimento i valori dell’appezzamento a seminativo al 2022.
Stima della biomassa legnosa
Il volume della componente viva e morta è stato stimato sull’8.0% dell’area totale di ciascuna piantagione utilizzando aree di saggio circolari di 9 m di raggio. Per tutti gli alberi vivi presenti all’interno delle aree di saggio sono state raccolte le seguenti informazioni: (i) la specie, (ii) il diametro ad altezza d’uomo per tutti gli alberi con diametro superiore a 2.5 cm; (iii) l’altezza dei venti alberi più vicini al centro dell’area di campionamento; (iv) il grado di copertura ([27]). Inoltre, all’interno delle aree di saggio sono stati raccolti i dati sulle tre componenti del legno morto (alberi morti in piedi, legno morto a terra, ceppaie) registrando per ciascuna i parametri volumetrici, la specie e la classe di decadimento ([6], [28]). La valutazione della classe di decadimento è stata fatta visualmente impiegando il sistema a tre classi perché considerato più idoneo alla casistica delle SFR ([17], [36]).
Analisi chimiche e biochimiche
Il carbonio organico totale del suolo (TOC), il carbonio totale estraibile (TEC), l’azoto totale, gli acidi umici e fulvici sono stati determinati secondo i metodi di analisi del suolo della Soil Science Society of America ([31])
Le attività enzimatiche relative al ciclo del C (α-glucosidasi, α-galactosidasi, β-galactosidasi, β-glucuronidasi, ossidasi and perossidasi), quelle dell’azoto (leucina aminopeptidasi, arginina-aminopeptidasi, serina-proteasi) e l’idrolisi della fluoresceina diacetato, come indicatrice dell’attività metabolica complessiva, sono state quantificate in estratti di suolo come descritto in Cardelli et al. ([5]). L’estrazione degli enzimi è stata effettuata mediante scambio etero molecolare utilizzando una soluzione di lisozima al 3%; successivamente le attività sono state quantificate in micropiastre utilizzando substrati fluorogenici. Infine, la biomassa microbica del suolo è stata valutata in termini di dsDNA come descritto in Fornasier et al. ([8]).
Quantificazione delle popolazioni fungine
Il DNA genomico totale è stato estratto da 0.25 g di campioni di suolo (peso secco) usando il PowerSoil™ DNA Isolation kit (MoBio Laboratories, Carlsbad, CA, USA) seguendo le istruzioni del produttore. La quantificazione dei funghi totali e delle popolazioni degli Ascomiceti e Basidiomiceti è stata eseguita utilizzando il sistema QuantStudio™ 3D Digital PCR (Applied Biosystems, CA, USA) e il colorante SYBR™M Green I per gel di acidi nucleici concentrato 10.000× in DMSO. Questo sistema fornisce una quantificazione assoluta di una sequenza nucleotidica grazie all’esclusiva tecnologia Microfluidic Array Plate™ (MAP) che consente la compartimentazione automatizzata di una singola reazione PCR/campione in 20.000 pozzetti di reazione per chip. I primers utilizzati per la quantificazione sono stati mirati a porzioni della regione 18S del DNA ribosomiale, specifiche per i funghi totali, gli Ascomiceti e i Basidiomiceti. Le condizioni della PCR e le fasi successive dell’analisi sono riportate in Manici et al. ([23]). I risultati sono stati espressi come numero di copie di DNA per μL di DNA del suolo.
Risultati
La biomassa legnosa
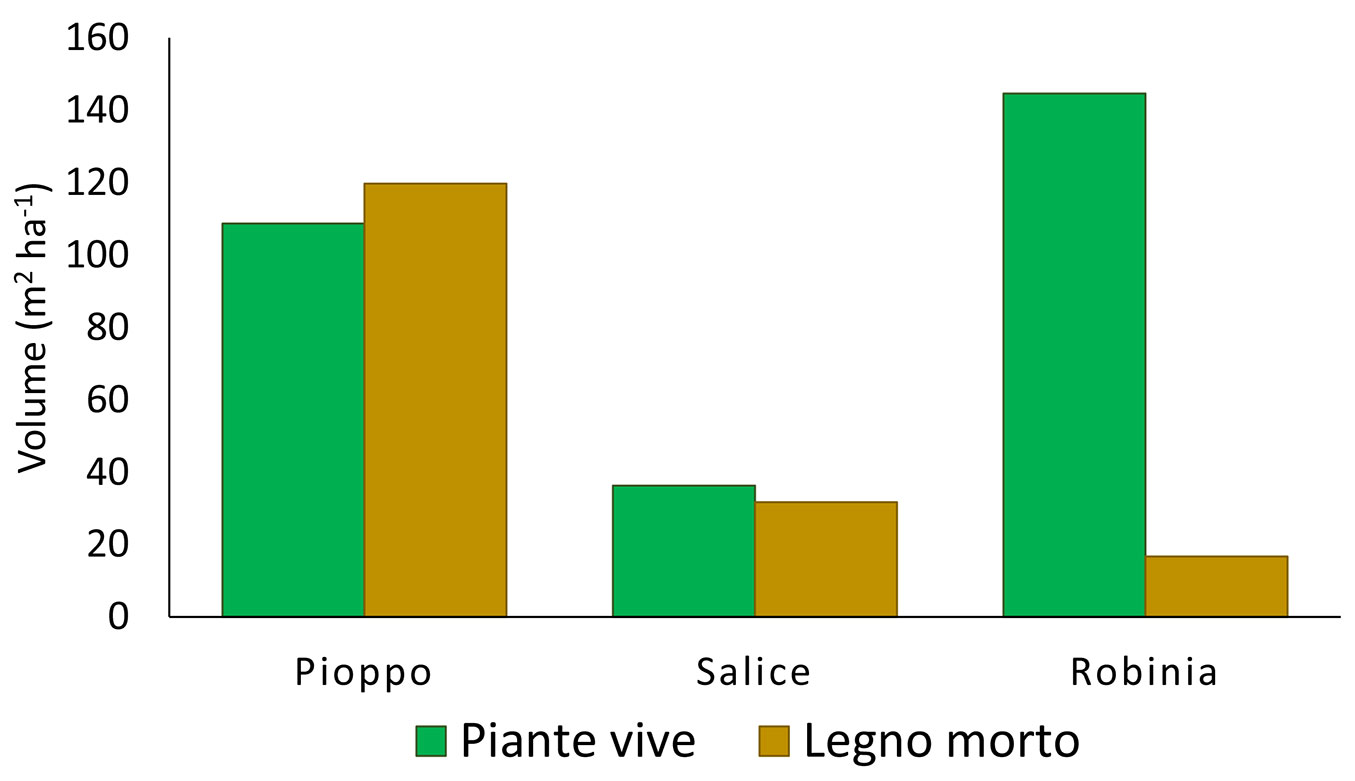
La SRF a robinia pseudoacacia è risultata la piantagione con il più alto volume (144.6 m3 ha-1), seguita dal Pioppo ibrido con quasi il 50% di piante vive, mentre il salice bianco ha evidenziato il più basso volume legnoso complessivo, sia in termini di piante vive che morte (36.3 m3 ha-1 - Fig. 2). Salice bianco e pioppo ibrido hanno prodotto il maggiore volume di legno morto fra le tre specie valutate (rispettivamente 31.7 e 119.7 m3 ha-1): ciò suggerisce che entrambe queste specie erano in una fase di declino del ciclo vegetativo; mentre, in base alla frazione ampiamente predominante di legno vivo rispetto a quella dilegno morto, solo robinia pseudoacacia è stata considerata essere ancora nella fase attiva del ciclo di crescita (Fig. 2).
Fig. 2 - Volume del legno vivo e del legno morto prodotto dalle tre specie di latifoglie dell’impianto iniziale lasciate evolvere allo stato naturale per 15 anni.
Incremento dei parametri chimici e biochimici
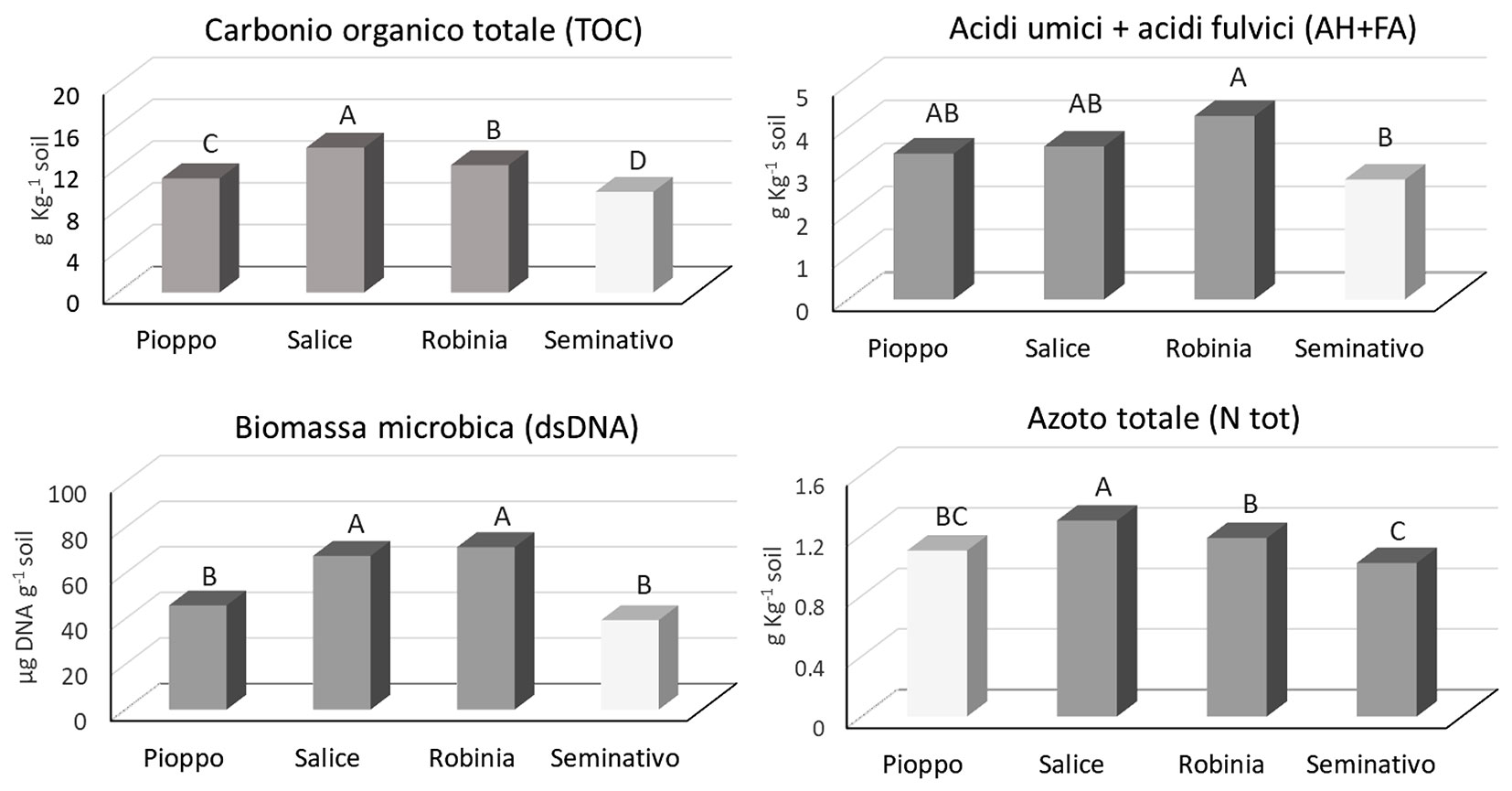
Come atteso, il C organico totale del suolo (TOC) è aumentato significativamente nelle piantagioni rispetto al seminativo (Fig. 3); il C organico estraibile (TEC) e l’azoto totale hanno mostrato lo stesso trend, evidenziando tuttavia che il pioppo non era riuscito a indurne un incremento significativo rispetto al seminativo (Fig. 3). Lo stesso incremento relativo del TOC ha differito in modo significativo fra le specie legnose con il maggiore aumento rispetto al seminativo nella SRF a salice bianco (+30%), seguito da quella a robinia pseudoacacia (+20%), mentre, sulla base della predominante porzione di legno vivo, solo robinia pseudoacacia è stata considerata essere ancora in una fase attiva del ciclo di crescita. Il pioppo ibrido ha avuto un incremento in TOC pari solo al 12%. In sintesi, in quindici anni, nei suoli delle SRF il C organico è aumentato dal 12% al 30% rispetto al seminativo (Fig. 3). La biomassa microbica, aumentata in misura significativa solo nei suoli a robinia e salice bianco, è risultata correlata positivamente con il TOC (coefficiente di correlazione r= 0.88).
Fig. 3 - Contenuto di carbonio organico totale del suolo, azoto totale, acidi umici e fulvici e biomassa microbica valutata come DNA totale del suolo nei quattro trattamenti. Le medie seguite da una lettera diversa differiscono significativamente secondo la procedura LSD di Fisher, a un livello di confidenza del 95%.
Gli acidi umici e fulvici (HA+FA) sono aumentati significativamente rispetto al seminativo solo nella SFR a robinia pseudoacacia (Fig. 3). Questo risultato è probabilmente legato ad una più lunga e intensa attività vegetativa di robinia rispetto a salice e pioppo deducibile da una predominante porzione di biomassa legnosa viva rispetto a quella di legno morto (Fig. 2). Questo ha fornito nel tempo un substrato più ricco in cellulosa, olocellulose e pectine supportando una maggiore attività metabolica a carico del ciclo del carbonio, come suggerito anche dal più alto livello di fungi totali e di Ascomiceti di seguito riportato.
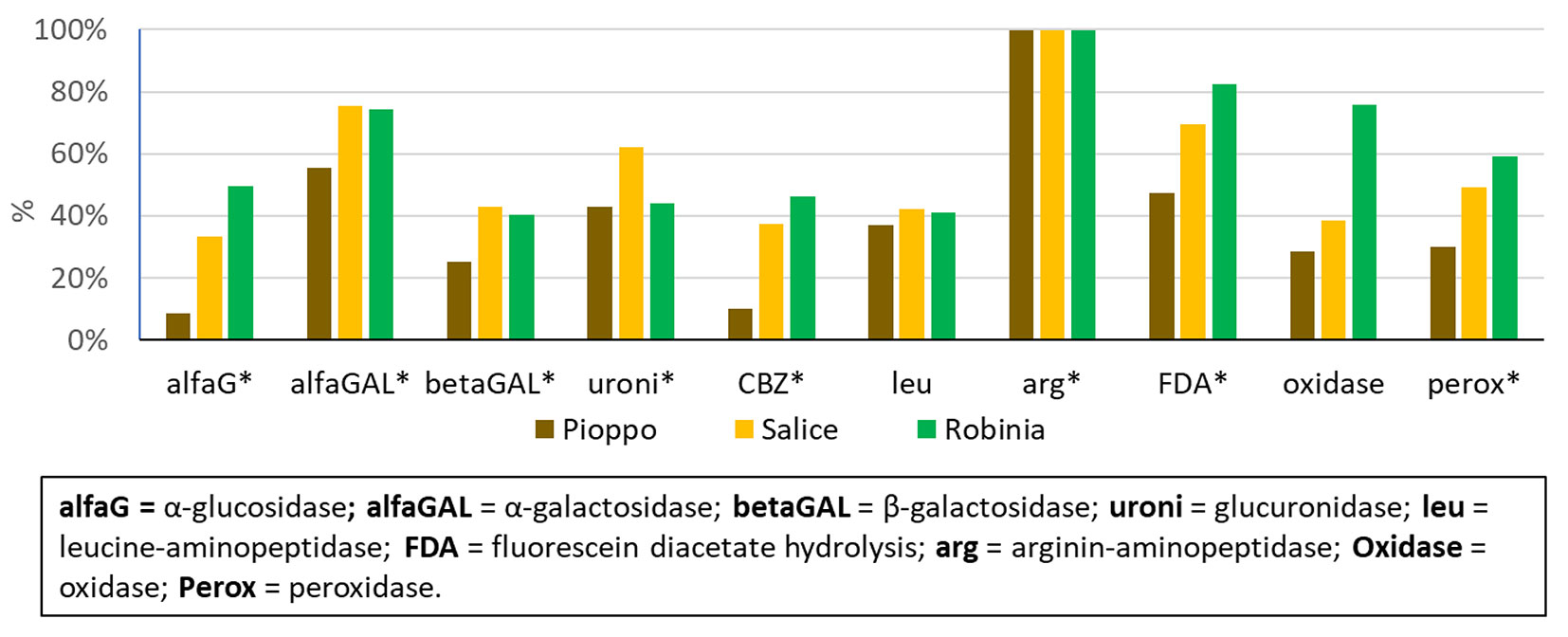
Tutte le attività enzimatiche come pure la biomassa microbica sono aumentate rispetto al seminativo in modo significativo nei suoli di robinia pseudoacacia e salice bianco (Fig. 3, Fig. 4). Mentre il pioppo ibrido non ha incrementato in modo significativo la massa microbica (Fig. 3), e ha inciso meno delle altre specie sull’incremento dell’attività enzimatica (Fig. 4).
Fig. 4 - Incremento relativo delle attività enzimatiche nei suoli afforestati rispetto al seminativo in seguito e 15 anni di piantagioni legnose a ciclo breve. Gli asterischi (*) indicano che i quattro trattamenti (3 piantagioni legnose e seminativo) erano significativamente diversi (p ≤ 0.05) per l’attività enzimatica secondo il test di Kruskal-Wallis.
La risposta delle popolazioni fungine
La SRF ha determinato un incremento altamente significativo (p<0.01) di tutte le popolazioni fungine analizzate rispetto al seminativo. I funghi totali e degli Ascomiceti sono aumentati da una a quattro volte mostrando un andamento simile nelle tre piantagioni legnose (Fig. 5) ed entrambi sono risultati correlati positivamente con la biomassa microbica ed il TOC (r: 0.93). I Basidiomiceti, presenti solo in tracce nel seminativo, pur essendo aumentati in modo significativo nelle parcelle a SRF rispetto al seminativo, non sono risultati correlati né con la massa microbica né con il TOC come invece osservato per gli Ascomiceti ed i funghi totali. Questo gruppo fungino, infatti, è risultato significativamente più alto nel pioppo ibrido rispetto a robinia pseudoacacia e salice bianco.
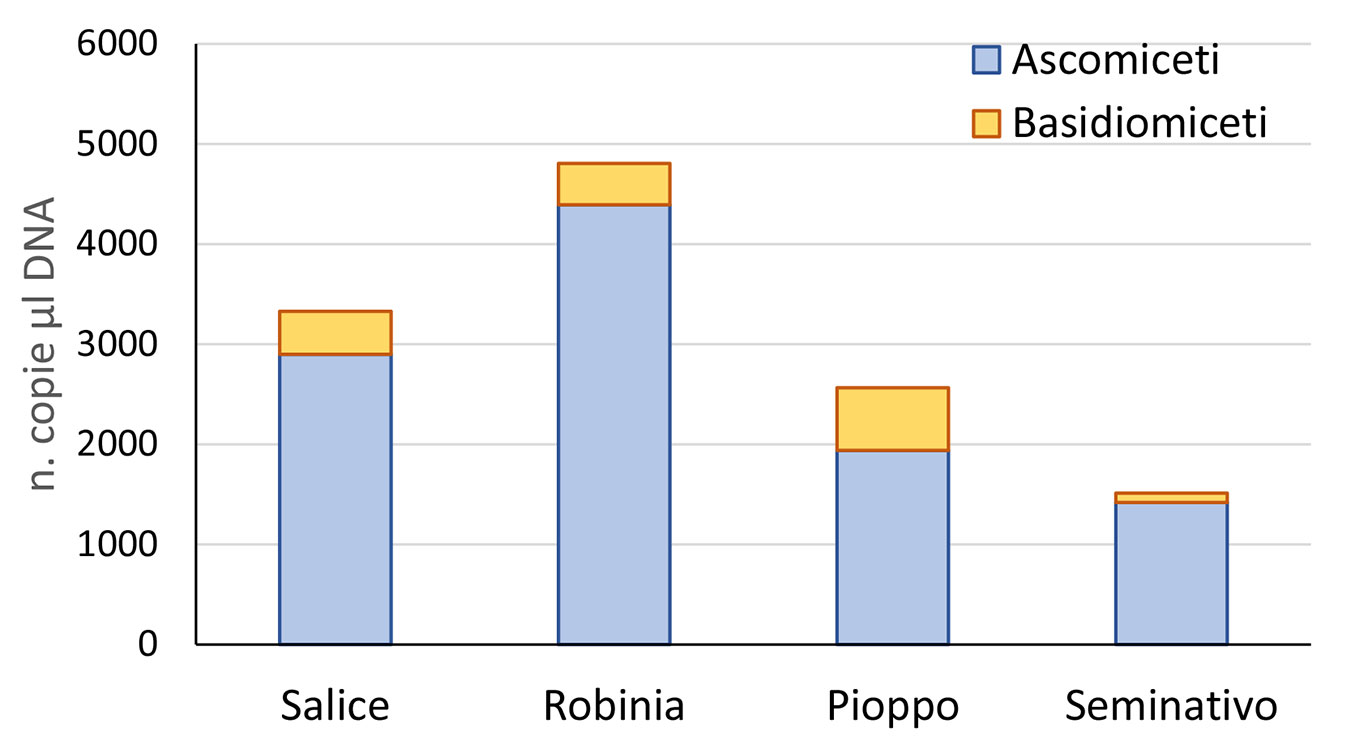
Fig. 5 - Quantità cumulata di ascomiceti e dei basidiomiceti valutata in temini di numero di copie di nucleotidi per µl di DNA di nucleotidi nelle 3 piantagioni legnose (pioppo, robinia e salice) e nell’adiacente seminativo.
Dalla Fig. 5 risulta evidente che gli Ascomiceti erano predominanti, almeno in termini di concentrazione di DNA. Questo risultato è coerente con l’altissima correlazione positiva fra Ascomiceti e funghi totali, valutati sempre con la dPCR (r=0.96), mentre la correlazione fra i Basidiomiceti e fungi totali è risultata molto inferiore (r=0.54). Il rapporto Ascomiceti:Basidiomiceti è risultato differire in modo significativo (p<0.05) fra i trattamenti secondo il test non parametrico di Kruskal-Wallis. Questo rapporto era più alto nel seminativo e nella SRF a robinia (Tab. 1), suggerendo che gli ascomiceti sono buoni indicatori quantitativi della attività di degradazione a carico dei residui organici, e quindi, del metabolismo complessivo del carbonio.
Tab. 1 - Il rapporto fra Ascomiceti e Basidiomiceti, quantificati con dPCR. In base alla pairwise comparison (Bonferroni) solo pioppo vs. seminativo differivano significativamente (p=0.05)
| Tipologia | Ascomiceti:Basidiomiceti |
|---|---|
| Pioppo | 3.16 |
| Salice | 6.76 |
| Robinia | 11.11 |
| Seminativo | 15.25 |
Discussione
Il periodo di quindici anni di abbandono gestionale delle tre aree SRF a salice bianco, robinia pseudoacacia e pioppo ibrido ha generato un aumento del carbonio organico del suolo, della biomassa microbica e dell’azoto ed ha indotto importanti variazioni delle caratteristiche biologiche del suolo rispetto al seminativo adiacente. Gli incrementi in C hanno differito fra le tre specie, ma non sono risultati correlati con il volume della biomassa complessiva prodotta dalle tre specie. Il salice bianco e la robinia pseudoacacia sono risultate le specie più performanti in termini di capacità di accumulare C organico nel suolo, di biomassa microbica ed attività enzimatica, ovvero l’attività metabolica complessiva. Tuttavia, la robinia pseudoacacia, l’unica specie ancora in piena fase vegetativa dopo 15 anni di abbandono gestionale, è stata l’unica ad aver incrementato in modo significativo gli acidi umici e fulvici. La miglior performance di quest’ultima è coerente con la maggiore attività ossidasica e perossidasica, due enzimi associati alla degradazione della lignina, all’umificazione e alla mineralizzazione del C ([29]). Nel complesso, questi risultati suggeriscono che molti fattori, oltre alla produzione di biomassa influenzano l’accumulo di carbonio nel suolo nei rimboschimenti con queste tre specie di latifoglie. Ciò è anche coerente con diversi altri studi che hanno riscontrato che la quantità di carbonio del suolo varia tra le specie di latifoglie, suggerendo che, oltre ai fattori ambientali come temperatura e umidità, i processi di accumulo del C sono fortemente influenzati dalla qualità e alla quantità di materiale vegetale che a loro volta influenzano il tasso di decomposizione ([13], [15]).
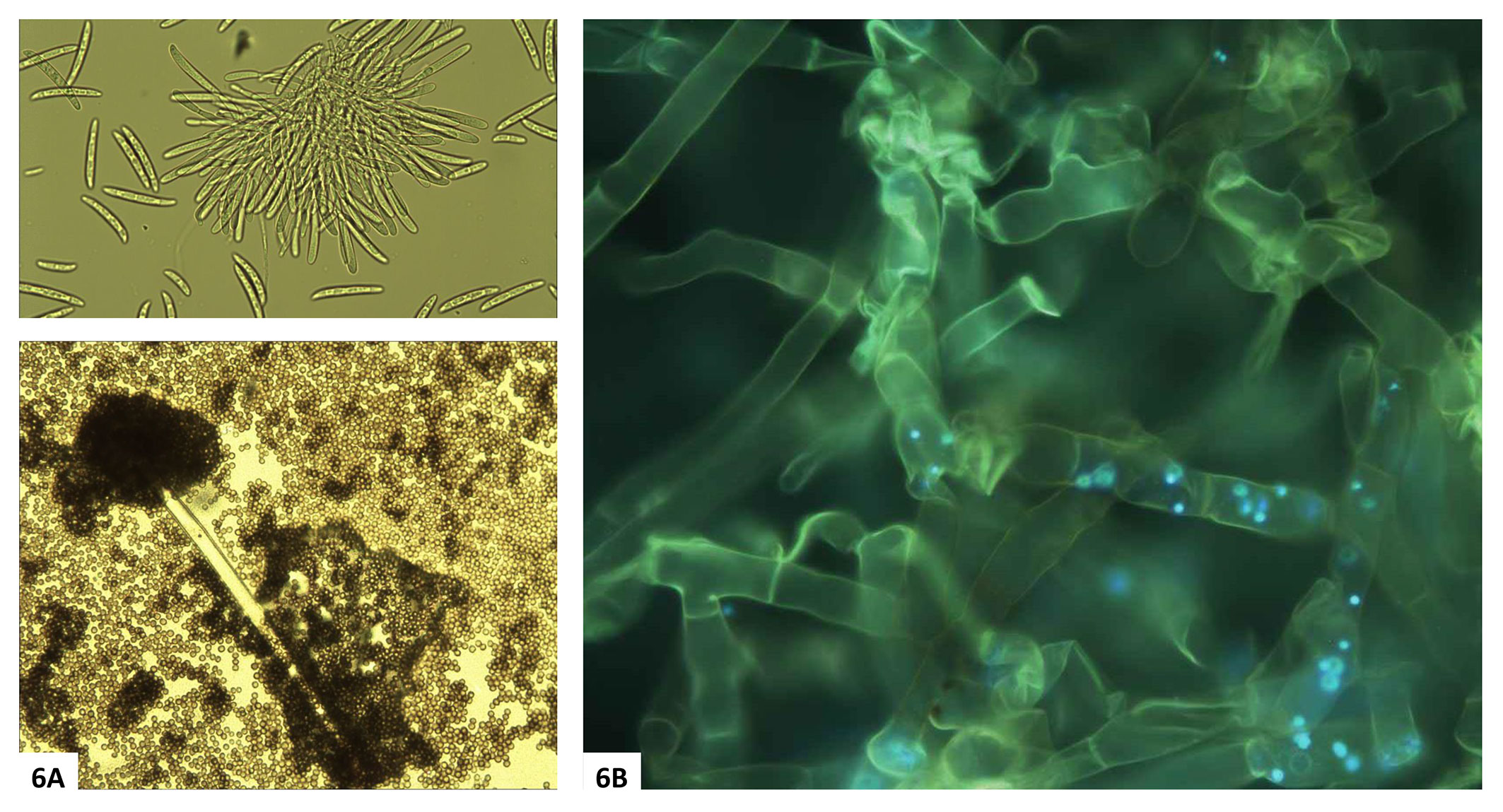
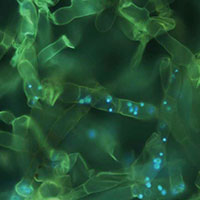
La quantificazione diretta dei gruppi fungini ha messo in evidenza quanto l’uso del suolo influisca sul contenuto in Basidiomiceti. Questo gruppo è risultato drasticamente ridotto nel seminativo rispetto agli Ascomiceti, i quali sono comunque risultati predominanti in tutti i trattamenti (Fig. 5). Questo sbilanciamento delle popolazioni fungine verso gli Ascomiceti, particolarmente forte nei suoli coltivati, è in parte dovuto a una preferenza dei Basidiomiceti per i residui vegetali più ricchi di lignina, rispetto agli Ascomiceti, i quali invece possiedono un pool enzimatico più adatto a decomporre la cellulosa e l’olocellulosa piuttosto che la lignina ([26], [11]), ed una spiccata capacità di adattamento a nuovi ambienti e nuove fonti nutritive grazie alla capacità di adattare in breve tempo il loro metabolismo ([22]). Inoltre, i Basidiomiceti, che colonizzano progressivamente il suolo con spesse formazioni ifali, sono molto più sensibili alla lavorazione del terreno rispetto agli Ascomiceti (funghi mitosporici o microfunghi), i quali sono in grado di diffondersi rapidamente con le spore attraverso la soluzione circolante del suolo ([4] - Fig. 6A). D’altra parte, il notevole incremento relativo dei Basidiomiceti osservato in questo studio nelle piantagioni legnose rispetto al seminativo è sicuramente un aspetto importante nella rigenerazione dei suoli. I Basidiomiceti, infatti, hanno una grande capacità di migliorare l’aggregazione del suolo e favorire la stabilità degli aggregati grazie all’estesa rete miceliale ramificata (Fig. 6B) e alle proprietà leganti delle mucillagini che producono ([4]). Inoltre, i Basidiomiceti, grazie alle loro spesse ife in grado di accumulare C ed elementi nutritivi e alla rete miceliare che riescono a costruire nei suoli indisturbati (Fig. 6B), svolgono un ruolo importante nella regolazione e nel rilascio di nutrienti nel suolo ([30]).
Fig. 6 - (A) Dispersione in acqua di spore di microfunghi (Ascomiceti, Fusarium solani e Penicillium niger) da colonie pure. Foto al microscopio ottico (ingrandimenti 10× e 20× rispettivamente). (B) Particolare delle ife di un Basidiomicete (Ceratobasidium sp.) da colonia pura, colorata con un prodotto specifico (DAPI) per microscopio a fluorescenza (ingrandimento 40×). I puntini evidenziati con fluorescenza azzurra entro le ife, sono i nuclei delle cellule.
Il più alto livello del pool dei demolitori microbici del suolo (funghi totali e Ascomiceti) come pure del rapporto Ascomiceti;Basidiomiceti nella SRF a robinia pseudoacacia rispetto a pioppo ibrido e salice bianco, supporta l’evidenza di una più lunga ed attiva attività vegetativa di questa piantagione, come si è potuto dedurre dalla quantità relativa di legno vivo molto maggiore in robinia rispetto a salice bianco e pioppo ibrido. Come già accennato nei risultati, questo ha probabilmente permesso di sostenere un’attività metabolica complessiva del suolo tale da permettere una maggiore produzione di sostanze umiche e fulviche nella piantagione a robinia rispetto alla SRF con salice bianco che, pur avendo indotto il miglior incremento di TOC nel suolo, non è stata in grado sostenere un incremento significativo degli acidi umici e fulvici alle stesse condizioni.
Nel complesso, i risultati di questo studio dimostrano che i funghi totali del suolo, gli Ascomiceti quantificati direttamente con tecniche molecolari ed il rapporto Ascomiceti e Basidiomiceti rappresentano efficaci indicatori dell’arricchimento in C dei suoli. L’aumento complessivo dei funghi del suolo e la coesistenza di Ascomiceti e Basidiomiceti nelle piantagioni legnose conferma che i meccanismi di degradazione e umificazione sono il risultato di una serie di processi che coinvolgono entrambi questi gruppi di funghi, la cui co-esistenza nei suoli forestali favorisce l’accumulo di C organico ([10]).
Sulla base delle risposte quantitative da parte delle popolazioni fungine all’uso dei suoli qui valutato, è possibile concludere che l’aumento del C organico e della funzionalità del suolo con diverse specie a rapido accrescimento, sono nel complesso legate ad una serie di processi biologici del suolo. Quest’ultimi a loro volta, sono correlati alle proprietà delle specie legnose e alle loro interazioni con le variabili ambientali.
I risultati di questo studio suggeriscono che, quando si punta a massimizzare l’efficienza d’accumulo di C nei suoli agricoli con specie legnose a rapido accrescimento, l’uso degli Ascomiceti e dei funghi totali, come indicatori quantitativi del metabolismo del carbonio, combinato con il rapporto Ascomiceti/Basidiomiceti, quale indicatore qualitativo dello stesso processo, permettono di identificare la durata ottimale dei cicli di SRF in quanto indicatori dell’interazione fra la specie legnosa e l’ambiente a livello dello strato coltivato dei suoli.
Questo studio non intende proporre alternative ad indicatori di scontata valenza tecnica per come l’incremento del contenuto di sostanza organica dei suoli, ma piuttosto identificare degli indicatori microbici dei diversi processi coinvolti nel ciclo del carbonio al fine di fornire elementi di supporto ad un’analisi critica nella scelta delle essenze legnose quando si mira, con nuove opzioni di forestazione, ad incrementare la sostanza organica del suolo sia dal punto di vista quantitativo che qualitativo.
Ringraziamenti
Questa ricerca è stata sviluppata nell’ambito del Programma Congiunto Europeo SOIL “Towards climate-smart sustainable management of agricultural soils” (EJP SOIL), progetto AGROECOseqC (⇒ https://ejpsoil.eu/soil-research/agroecoseqc) finanziato dal programma di ricerca e innovazione dell’Unione Europea Horizon 2020 (grant agreement no. 862695).
Si ringrazia Anna Orsi per la sua attività di laboratorio di analisi chimiche del suolo presso il Centro di ricerca CREA Zootecnia e Acquacoltura di San Cesario sul Panaro (MO).
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar