Artificially increasing atmospheric nitrogen deposition does not stimulate growth of Picea mariana (Mill.) BSP in the Canadian boreal forest
Forest@ - Journal of Silviculture and Forest Ecology, Volume 22, Pages 18-26 (2025)
doi: https://doi.org/10.3832/efor4675-022
Published: Apr 04, 2025 - Copyright © 2025 SISEF
Research Articles
Abstract
Forests provide essential ecosystem services we rely on, including climate regulation and mitigation, biodiversity conservation, clean water and air supply, food and energy production, and improvement of human health and well-being. However, their functioning is significantly altered by different global change drivers related to human activities, such as increasing atmospheric CO2 and pollution, with particular reference to the increase in reactive nitrogen (N) in the atmosphere and their deposition back to the biosphere as N deposition. Global change drivers may particularly affect boreal forests, given that low temperatures, shorter growing seasons, and nutrient (particularly N) limitations strongly limit tree growth in this biome. This study tested the hypothesis that tree growth in boreal forests would increase with the simulated increase in N deposition. To this aim, a dendrochronological study was carried out in a novel manipulation experiment, where an increase in N deposition was simulated for five years (2008-2013) through above-canopy rather than soil fertilization (as in all previous manipulation experiments in this biome). The experiment was carried out in two Picea mariana (Mill.) BSP forests (BER, tree age 130 and SIM, tree age 90), both including treatment plots with aerial N misting (n=3) and control (receiving only water, n=3). From each plot, four wood cores were sampled from the single tree subjected to the N additions for a total of n=3 trees per treatment. We did not observe any significant effect of the added N on tree growth. This result could be related to the short duration of the experiment and the low doses applied (twice as much as the ambient deposition), which did not significantly contribute to altering the growth of a slow-growing tree species like Picea mariana. Moreover, during the last year of the treatment, both stands were interested by the Choristoneura fumiferana attack that likely caused canopy defoliation, thus limiting the potential foliar N uptake, but also photosynthesis and growth. It is likely that the added N reached the soil directly (during the spraying) or indirectly (through litterfall), with a positive effect on the rhizosphere. Conducting long-term manipulation experiments in forest ecosystems is undoubtedly complex, but it is crucial to enhance our understanding of tree growth dynamics and forest carbon sequestration, as well as how they are affected by global change divers and biotic stress.
Keywords
Boreal Forest, Nitrogen Atmospheric Deposition, Dendrochronology, Nitrogen Fertilizations, Climate Change
Introduzione
L’ecosistema boreale rappresenta un terzo delle foreste esistenti sulla Terra e contiene il più importante stock di carbonio (C) a livello globale, pari a 264.9 ± 10.5 Pg per il 2020 ([37]). Queste foreste hanno grande importanza per le loro svariate funzioni ecosistemiche. Sono l’habitat di molte specie, e garantiscono il mantenimento di un’elevata biodiversità ([34]). Seconda importante funzione delle foreste boreali è quella di mitigazione dei cambiamenti climatici. Le piante utilizzano la CO2 atmosferica, uno dei gas a effetto serra maggiormente responsabili del riscaldamento globale. Il C in ambiente boreale, freddo e dominato da conifere associate a funghi micorrizici, è mineralizzato molto lentamente, portando ad un accumulo di materia organica superficiale indecomposta (e quindi ad uno stoccaggio di C nel suolo) o di humus molto acido e profondo ([4]). Una così lenta trasformazione, che permette l’immagazzinamento del C, consente però anche di reagire con elementi alcalini presenti nel suolo, formando sali che vengono facilmente lisciviati e allontanati, impoverendolo ([24]).
La disponibilità di azoto (N) è uno dei principale fattori limitanti l’accrescimento degli alberi nelle foreste boreali ([26]). Un apporto di N mediante deposizione atmosferica può in parte sopperire alla ridotta disponibilità di questo elemento nel suolo. La deposizione atmosferica di N si aggira su 4-9 kg N ha-1 anno-1 nelle regioni boreali ([28]), un valore limitato a causa della scarsa esposizione a fonti inquinanti. L’aumento delle emissioni di composti attivi di N dal 1850 a oggi in Canada non è paragonabile a quello di altri paesi industrializzati quali Stati Uniti e nord Europa, dove i valori hanno raggiunto picchi di 20-25 milioni di tonnellate (NOx). Tuttavia, le emissioni di composti reattivi di N in Canada sono triplicate negli ultimi decenni ([7]). Uno sbilanciamento dei nutrienti nell’ecosistema, già fortemente limitato dalla disponibilità di N ([30]), porta ad una maggior vulnerabilità degli alberi a fattori abiotici e biotici, aumentandone la mortalità ([6]).
Una maggiore disponibilità di N mediato dalla deposizione atmosferica favorisce un aumento della capacità fotosintetica delle piante ([48]), grazie ad un effetto positivo sia sull’attività enzimatica della Rubisco coinvolta nel processo di fotosintesi sia sull’area fogliare, incrementando la superficie intercettante la radiazione solare ([47]). Questo non solo permette una maggior efficienza nella fissazione del C, ma anche un suo utilizzo nell’accrescimento secondario o un suo stoccaggio nelle radici ([17]). Molti studi, infatti, hanno osservato come un aumento della CO2 in atmosfera e della deposizione atmosferica di composti reattivi dell’N da attività antropiche, dovute al cambio di uso del suolo, all’utilizzo di combustibili fossili e agricoltura ed allevamenti intensivi, abbiano portato ad un incremento di crescita nelle foreste ([14], [12]).
Per studiare come questi ecosistemi rispondano al variare del clima e della concentrazione di elementi nel suolo e in atmosfera si è iniziato ad effettuare esperimenti di fertilizzazione, mimando possibili condizioni future, in un’ottica di continuo aumento della pressione antropica. La maggior parte degli esperimenti di manipolazione di N condotti in foresta hanno considerato fertilizzazioni al suolo. I risultati sono stati variabili soprattutto in base al sito di studio, alle condizioni climatiche, alla specie e alla tipologia di suolo. Un significativo aumento dell’accrescimento degli alberi di abete rosso è stato osservato con dosi di fertilizzazione elevate (70 kg di N ha-1 anno-1 - [36], [25]) in siti in Norvegia e Svezia con suoli particolarmente acidi e temperature rigide, dove la disponibilità di N era molto bassa ([27]). Fertilizzazioni con dosi maggiori in due siti finlandesi con variazioni marginali di latitudine (5°) hanno mostrato come piccole variazioni nelle condizioni stazionarie possano portare a una mancata risposta da parte degli alberi; solo il sito più a nord ha risposto al trattamento con maggiori accrescimenti (150 kg ha-1 - [28]). Altre prove di lungo termine (18 anni) effettuate su suoli piuttosto fertili in Svezia con aggiunta di 20 kg ha-1 anno-1 sono state ininfluenti a livello di accrescimento in popolamenti di abete rosso, eccetto per un aumento di biomassa fogliare ([38]). Infatti, sopra una certa soglia, un aumento dell’input di N mediante deposizione atmosferica può non alterare ([43]) o addirittura rallentare l’accrescimento ([33], [14]). Studiare gli effetti di un aumento delle deposizioni sull’accrescimento degli alberi attraverso fertilizzazioni al suolo risulta però fuorviante. Un aspetto importante che è stato di gran lunga trascurato nelle fertilizzazioni al suolo è che la deposizione atmosferica di N interagisce dapprima con le chiome degli alberi, che possono ritenere, assorbire o addirittura trasformare parte di questo N, prima che arrivi al suolo mediante throughfall ([44], [16], [21], [22]). Inoltre, la pioggia non sarà solo ricca di N ma anche altri elementi che, con le fertilizzazioni a terra, non sono considerati ([38]). Una fertilizzazione sopra chioma risulta quindi più verosimile di quella al suolo: deposizioni continue a livello fogliare, a composizione chimica controllata e variabile. In alcuni studi l’aumento della deposizione azotata atmosferica è stato ottenuto attraverso fertirrigazione da elicottero, rimanendo però inconcludente sull’accrescimento degli alberi ([18], [11]). Dei 20 kg ha-1 anno-1 distribuiti, infatti, solo 15% non veniva intercettato dalle chiome e, pertanto, arrivava direttamente al suolo, mentre l’80% veniva trattenuto dalle chiome ([18]). Utilizzando l’N tracciato isotopicamente, si è visto però che in realtà la ritenzione non avveniva ad opera delle foglie ma della corteccia ([11]).
Come evidenziato da Bebber ([1]), la maggior parte degli studi disponibili in letteratura ha sovrastimato la risposta dei popolamenti forestali all’aumento della deposizione atmosferica di N, sia per l’approccio utilizzato (fertilizzazioni al suolo - [49]) che per eccessive quantità apportate. Si rende sempre più necessario effettuare esperimenti di manipolazione che simulino in maniera più realistica un aumento della deposizione atmosferica di N per una più accurata stima del suo effetto sugli ecosistemi forestali.
Il presente lavoro si propone di: (i) investigare la relazione di lungo periodo tra l’accrescimento degli alberi ed i fattori abiotici (aumento delle temperature e concentrazione di CO2 in atmosfera); e (ii) valutare la risposta degli alberi ad un aumento di deposizione azotata, simulato mediante fertirrigazione sopra-chioma. In particolare, il trattamento ha simulato un aumento di tre volte il valore attuale di deposizione azotata, applicando dosi realistiche rispetto agli scenari futuri ([19]). Considerando la ridotta disponibilità di N nell’ecosistema, si è ipotizzata una risposta immediata e positiva da parte degli alberi: un maggior input di N atmosferico insieme ad un allungamento della stagione vegetativa avrebbero permesso una maggior attività fotosintetica e quindi una maggiore quantità di C rimosso dall’atmosfera e stoccato nelle piante sotto forma di biomassa legnosa.
Materiali e metodi
Siti sperimentali e campionamento
Lo studio è stato condotto in due popolamenti di Picea mariana (Mill.) BSP in Québec, Canada. Questa specie è rappresentativa della foresta boreale del nord America. Ricopre il 28% delle foreste del Québec, formando una banda di 300 km tra il 49° e il 52° parallelo, e raggiungendo il limite settentrionale della vegetazione arborea. La sua diffusione è legata principalmente all’elevata resilienza a temperature rigide e l’adattamento a varie tipologie di suoli ([8]). Entrambi i siti studiati si sono originati in seguito ad incendio, cha ha dato origine ad una coorte di alberi di età uniforme. Il più vecchio popolamento analizzato, originatosi nel 1884, si trova vicino al lago Bernatchez nei Monti Valin (48° 51′ N, 70° 20′ W, 611 m s.l.m. - da qui in poi indicato come BER.) La falda si trova a 10-30 cm di profondità nelle zone più pianeggianti, ed è poco profonda soprattutto dopo lo scioglimento della neve in primavera e dopo le abbondanti piogge in autunno. Il secondo sito, originatosi intorno al 1930, è ad un’altitudine minore, nella Riserva Naturale dei Laurentides, all’interno della stazione di ricerca Simoncouche (48° 13′ N, 71° 15′ W, 350 m s.l.m. - di seguito indicato come SIM). I siti sono entrambi su pendii lievemente inclinati (8-17%). SIM ha un suolo più drenante di BER; inoltre, SIM ha temperature maggiori di 2 °C ed ha una stagione vegetativa più lunga di due mesi rispetto a BER, permettendo un maggiore accrescimento degli alberi (BER maggio-settembre; SIM aprile-ottobre - [32]).
All’interno dei due popolamenti, è stata individuata un’area di 60 × 60 m, suddivisa a sua volta in dodici plot di 12 × 12 m distribuiti in maniera randomizzata tra diversi trattamenti (n = 3 repliche per trattamento): H con aumento di temperatura al suolo, N con fertilizzazione azotata sopra chioma, NH con interazione dei precedenti trattamenti, e C come controllo ([32]). Nel presente studio è stato considerato solo il trattamento N con fertilizzazione azotata sopra chioma. La fertirrigazione è stata attuata su 1 albero co-dominante per plot (per un totale di n=3 alberi per trattamento), scelti in base al loro stato di salute. Accanto all’albero scelto per il trattamento è stato identificato un altro albero sul quale sono stati installati degli irrigatori per effettuare la fertirrigazione ([32]). Gli alberi del controllo erano irrigati con acqua avente la stessa composizione di quella piovana, mentre gli alberi del trattamento con N hanno ricevuto con una soluzione contenente tre volte il nitrato di ammonio (NH4NO3) normalmente ricevuto con le piogge, pari a 44.78 equiv. L-1 , simulando un aumento realistico della deposizione di N umida. L’irrigazione applicata su un raggio di 3 m ha fornito un apporto equivalente di 2 mm di pioggia a settimana tra giugno e settembre, per evitare i periodi di neve e gelate ([32]). Per accertarsi della corretta irrigazione si è evitato di effettuare fertilizzazioni in giorni con vento forte ed è stata verificata la traiettoria dei getti tramite secchi di raccolta alla base delle chiome. L’esperimento di fertilizzazione è stato condotto dal 2008 al 2013, con trattamenti effettuati con una frequenza settimanale da giugno a settembre.
Nel novembre del 2020, sono state prelevate con la trivella di Pressler da due a quattro carote da ogni albero, per un totale di tre repliche per trattamento e sei campioni per sito (per un totale di 12 repliche).
Analisi dendrocronologiche
Una volta essiccate su supporto rigido per evitare distorsioni del legno, le carote sono state levigate utilizzando una levigatrice circolare utilizzando della carta abrasiva con grana da 60 e poi da 400 per mettere in evidenza gli anelli di accrescimento. Successivamente, le carote sono state scansionate utilizzando uno scanner (Epson perfection v550), considerando una risoluzione dell’immagine pari a 4800 DPI. Ogni file dell’immagine scannerizzata è stato nominato con il numero identificativo dell’albero di riferimento e salvato in una cartella corrispondente al suo plot (controllo o trattamento) di appartenenza. Su ogni immagine scansionata, si è proceduto con l’individuazione e la datazione di ciascun anello di accrescimento, procedendo dalla corteccia fino al midollo, considerando nella marcatura il passaggio dal legno primaverile di un anno a quello tardivo dell’anno precedente. La misura delle ampiezze anulari è stata effettuata mediante l’uso del software CooRecorder (Cybis Elektronik & Data AB - ⇒ http://www.cybis.se/forfun/dendro/), che consente di misurare sia l’ampiezza di ciascun anello in mm che di costruire la curva delle ampiezze anulari per una data carota di legno.
Il software CDendro (Cybis Elektronik & Data AB) è stato utilizzato per la cross-datazione delle curve ottenute, per creare le curve di riferimento di ogni sito dalla media di tutte le curve considerate. Per ciascun albero, a partire dai dati delle ampiezze anulari è stato calcolato l’incremento di area basimetrica (basal area increment, BAI), utilizzando la seguente formula (eqn. 1):
in cui ra ed ra-1 rappresentano il raggio di un dato anno e quello dell’anno precedente rispettivamente. Si è scelto di usare il BAI piuttosto che i dati di ampiezze anulari per rimuove l’effetto biologico dell’età sull’accrescimento ([29]).
Le misure così effettuate sono state confrontate con le curve di riferimento relative ad altri popolamenti nelle vicinanze dei siti di BER e SIM, e disponibili del dataset globale del NOAA International Tree Ring Data Base. In particolare, si sono considerati popolamenti di P. mariana sul Lago Onatchiway (Krause- Lac Onatchiway 5 and 7- PCMA-ITRB CANA143) e di Thuja occidentalis L. a Bienville (Dagneau- Quebec City Region Archeological-THOC-ITRBD CANA 269), ottendendo rispettivamente coefficienti di correlazione medi di 0.54 ± 0.27 (media ± deviazione standard) e 0.49 ± 0.21. Per valutare ulteriormente la qualità della cronologia, i valori di ampiezza anulare sono stati detrendizzati utilizzando una funzione “Spline” (funzione detrend, pacchetto “dplR” ([9]). Per valutare la robustezza della cronologia media ottenuta è stato calcolato l’Expression Population Signal (EPS), che quantifica la variabilità comune in tutte le serie anulari di un particolare sito, ad indicare che tutti gli alberi sono influenzati da simili variabili climatiche e pertanto, che possono considerarsi appartenenti alla stessa popolazione ([5]). Valori di superiore a 0.85 indicano che la cronologia delle ampiezze anulari può essere considerata affidabile. La formula per il calcolo dell’EPS è la seguente (eqn. 2):
dove t è il numero delle serie temporali (considerando 1 carota per albero), rbt è la media della correlazione tra le diverse serie.
Il valore di EPS delle serie di ampiezze anulari, standardizzate utilizzando una spline cubica (con soglia del 50% e lunghezza d’onda di 0.67 volte la lunghezza in anni di ciascuna serie), è risultato pari a 0.861, indicando che le cronologie ottenute possono essere ritenute rappresentative dei due siti.
Analisi statistiche
Per l’analisi di lungo periodo, le informazioni sul clima sono state ricavate dalla Climatic Research Unit TS 4.06 dataset High Resolution (50 × 50 km). I dati climatici derivano da modellazioni di misure effettuate in centraline meteo georeferenziate. I fattori considerati sono stati le precipitazioni, le temperature medie e il range di temperatura (differenza tra temperature massime e minime). Come verifica dell’accuratezza dei dati modellizzati si è effettuato un confronto con i dati osservati presso l’aeroporto di Bagotville per il periodo 1942-2017 (distanza Bagotville-Simoncouche circa 22 km).
I dati climatici di breve periodo sono stati invece ottenuti dalle stazioni metereologiche presenti nei singoli siti di studio (per gli anni 2001- 2020). I parametri considerati sono stati: temperature massime, minime e medie, precipitazioni acquose, altezza del manto nevoso, umidità relativa e contenuto idrico del suolo.
Nelle analisi di lungo periodo (1901-2020), sono state effettuate delle correlazioni di Pearson tra BAI e dati climatici a scala mensile e stagionale, in particolare inizio e fine stagione vegetativa: primavera (MarchAprilMay, MAM) e autunno (SeptemberOctoberNovember, SON). Inoltre, per studiare i siti singolarmente sono state usate correlazioni di Pearson tra le serie di BAI e quelle di temperatura e precipitazione mensili su una finestra mobile di 1, 3 e 6 mesi. Le regressioni lineari multiple sono state considerate per verificare la relazione tra accrescimento e fattori climatici (temperature medie e precipitazioni annuali) e la concentrazione della CO2 in atmosfera considerando i siti come unica popolazione. I dati di lungo periodo relativi alle concentrazioni di CO2 atmosferica sono stati ottenuti da Belmecheri & Lavergne ([3]).
Nelle analisi di breve periodo (2000-2020), si sono valutate le correlazioni lineari tra BAI e i fattori climatici (temperature medie massime e minime, altezza della neve, umidità relativa del suolo, precipitazioni). Per verificare l’effetto del trattamento di fertilizzazione sull’accrescimento, è stata effettuata un’analisi della varianza (ANOVA). Tutte le analisi ed elaborazioni grafiche sono state condotte utilizzando Rstudio ([40]) e pacchetti specifici per le analisi statistiche condotte (“Rmisc”, “car”, “tidyverse”, “rstatix”, “ggpubr”, “dplR”, “seas”, “zoo”, “ppcor”, “lubridate”, “ggplot2”).
Risultati
Risposta dell’accrescimento alle variabili climatiche
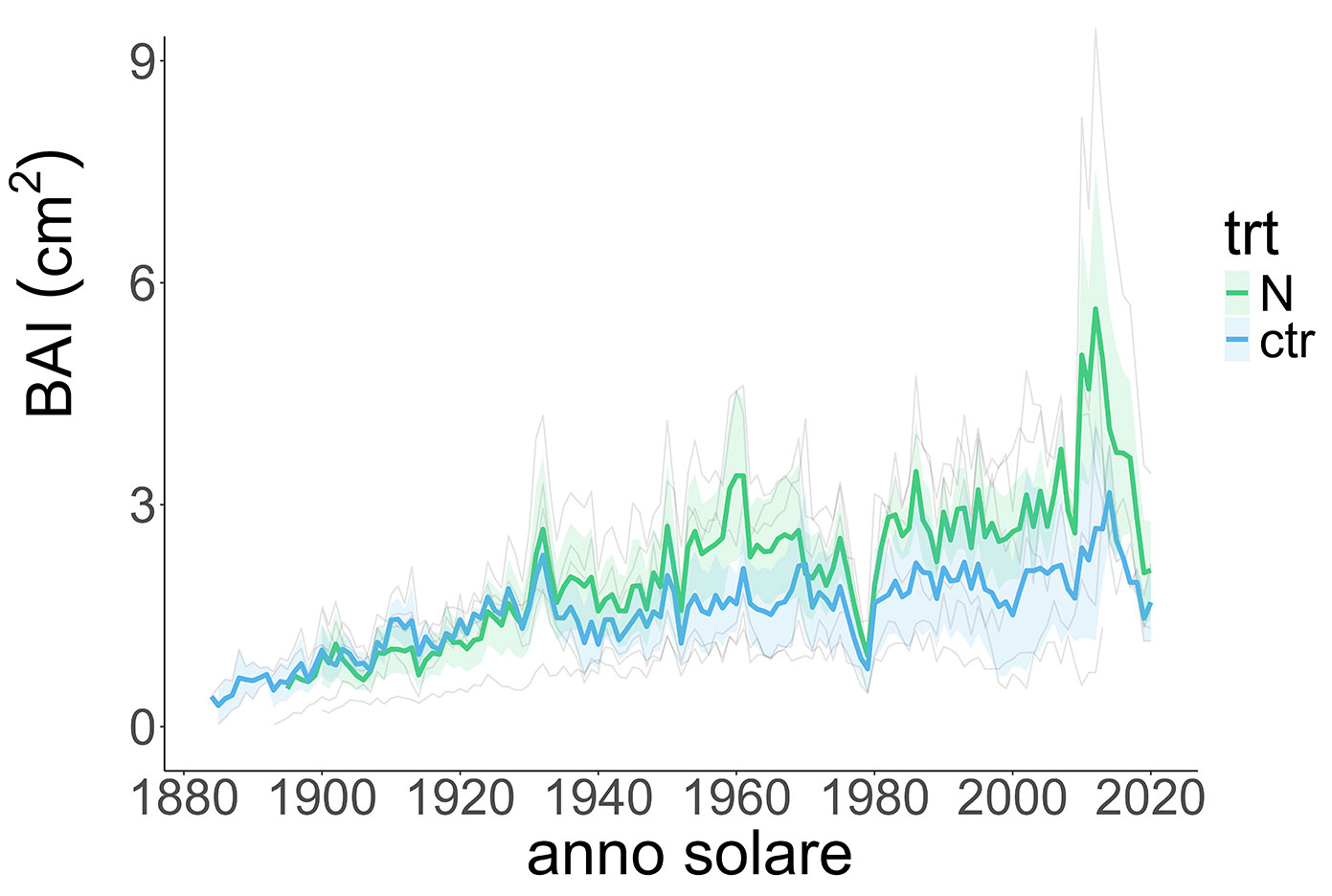
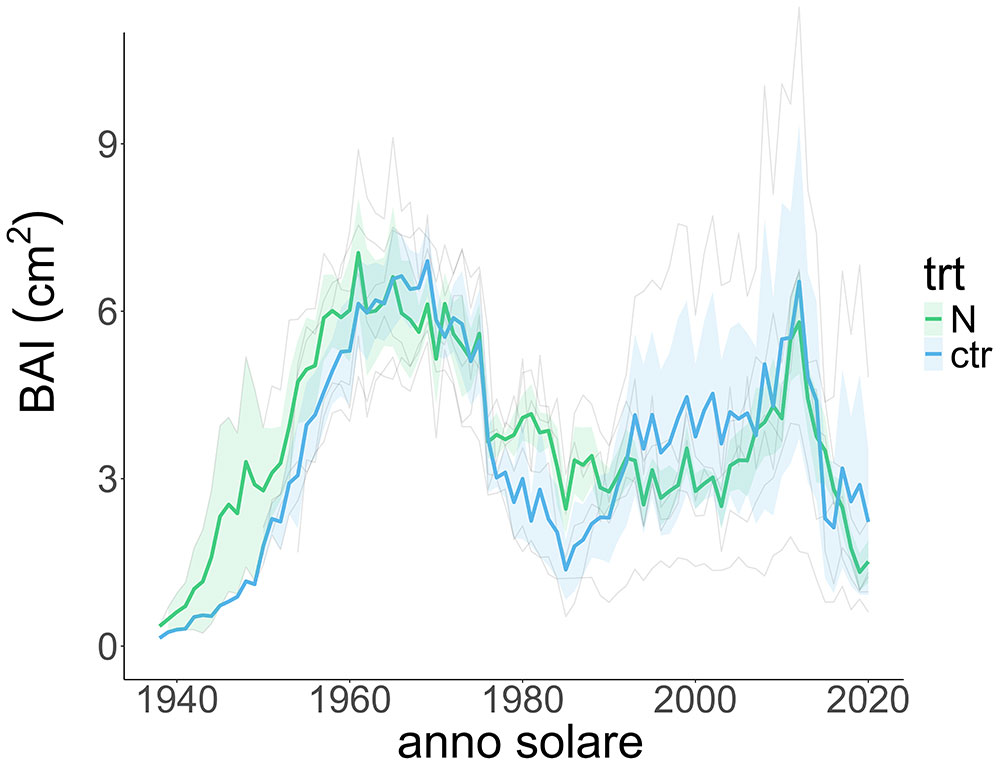
In questo studio, è stato possibile osservare l’andamento dell’accrescimento complessivo dei due siti (in termini di BAI) nel lungo periodo (1884-2020). L’accrescimento degli alberi in BER, sito più a nord, ha un andamento molto lento dovuto alle condizioni rigide del sito (rispettivamente temperature medie autunno inverno e primavera: 3 °C, -14.5 °C, -0.5 °C) con picchi attorno al 2010. Gli alberi in SIM invece hanno mostrato un andamento dell’accrescimento più eterogeneo, con valori complessivamente più alti di BER, con picchi durante gli anni âÂÂ60 e nel primo decennio del 2000 (Fig. 1, Fig. 2).
Fig. 1 - Media degli incrementi di area basimetrica nel trattamento e nel controllo per il sito BER. In verde sono indicate le curve di BAI relative agli alberi interessati dal trattamento di fertilizzazione con N, mentre in blu gli alberi del controllo; le linee più spesse rappresentano le medie delle repliche per ogni gruppo. L’area ombreggiata per ciascuna curva media rappresenta la deviazione standard. La sigla “trt” indica il trattamento.
Fig. 2 - Media degli incrementi di area basimetrica nel trattamento e nel controllo per il sito SIM. In verde vengono indicate le curve di BAI relative agli alberi interessati dal trattamento di fertilizzazione con N, mentre in blu quelle degli alberi nel controllo; le linee più spesse rappresentano la media delle repliche per ogni gruppo. L’area ombreggiata per ciascuna curva media rappresenta la deviazione standard. La sigla “trt” indica il trattamento.
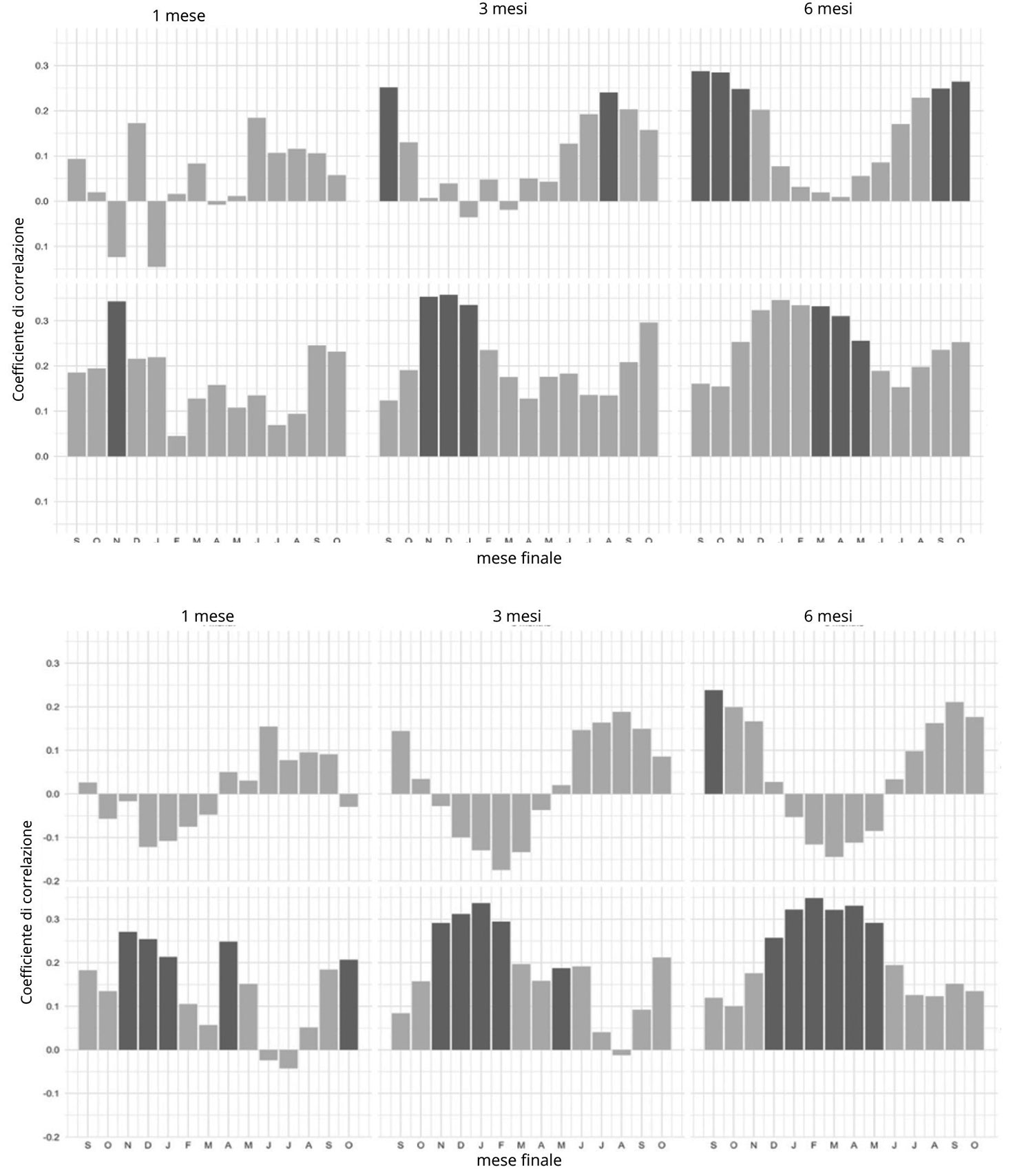
Evidente è la differenza delle condizioni stazionali dei due siti e la loro influenza sull’accrescimento degli alberi: il sito più a nord, BER, ha una stagione vegetativa più corta di due mesi rispetto al sito più a sud, SIM, considerando che la ripresa dell’attività fenologica del cambio avviene generalmente quando le temperature superano 0 °C ([45]). Dall’analisi di correlazione di Pearson, gli alberi nel sito di BER mostrano una risposta maggiore dell’accrescimento alle temperature, che non superano normalmente 0 °C prima del mese di aprile. L’accrescimento in SIM risponde maggiormente alle precipitazioni (Fig. 3).
Fig. 3 - Correlazioni di Pearson tra accrescimento, temperatura e precipitazioni. Il grafico a barre mostra i coefficienti di correlazione di Pearson tra le serie di BAI e le precipitazioni medie mensili (i primi tre diagrammi in alto di entrambi i pannelli) e temperature medie mensili (i 3 diagrammi in basso di entrambi i pannelli) su una finestra temporale di 1, 3 e 6 mesi per il sito di SIM (pannello superiore) e BER (pannello inferiore). Le colonne in grigio scuro indicano le correlazioni significative.
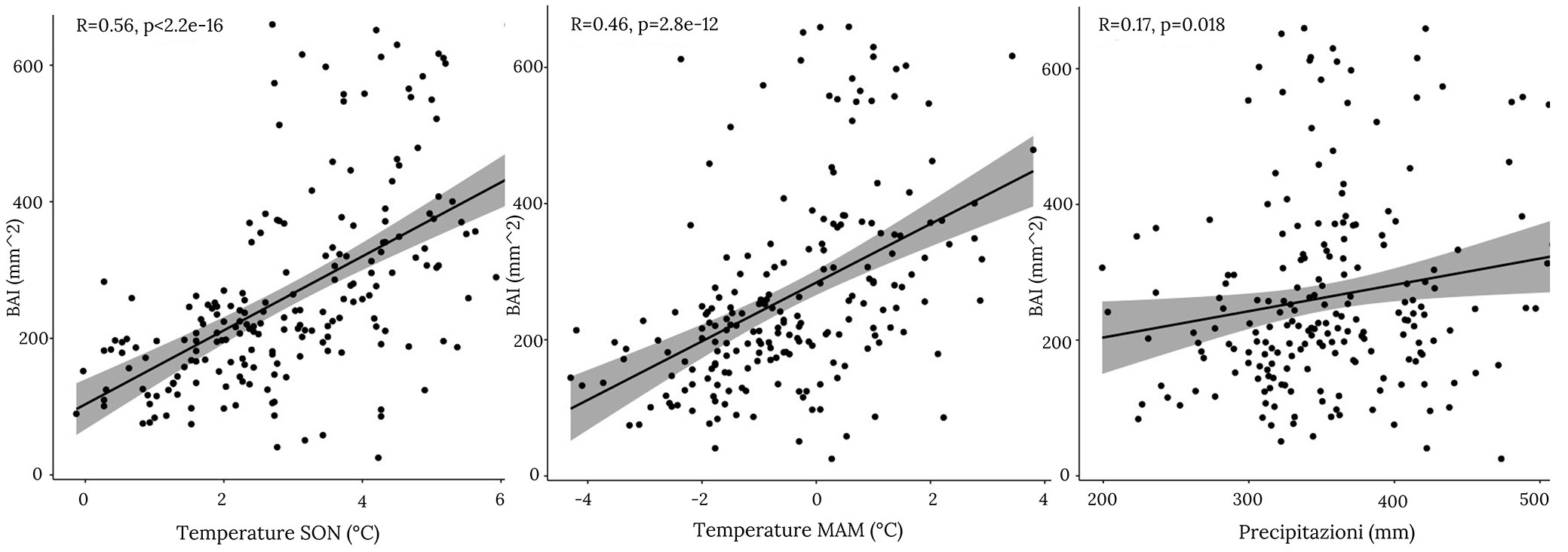
Nel lungo periodo, i due siti studiati come un’unica popolazione hanno dato risposte positive verso le condizioni che assicuravano un possibile allungamento della stagione vegetativa, come le temperature medie primaverili (MAM) e le temperature medie autunnali (SON - Fig. 4). Anche le precipitazioni durante la stagione estiva (JuneJulyAugust, JJA) sono risultate favorevoli per l’accrescimento degli alberi (Fig. 4).
Fig. 4 - Correlazione tra accrescimento e fattori climatici. Vengono mostrate le correlazioni tra accrescimento e temperature medie autunnali per i mesi settembre, ottobre e novembre (SON - grafico a sinistra), temperature medie primaverili dei mesi di marzo, aprile e maggio (MAM - al centro), e, infine le precipitazioni estive per i mesi di giugno, luglio e agosto (JJA - a destra).
La regressione lineare ha evidenziato una relazione positiva (p<0.001) tra accrescimento e temperature medie, sottolineando la sua influenza su ripresa e durata della stagione vegetativa degli alberi (Tab. 1).
Tab. 1 - Analisi di regressione lineare multipla per valutare la relazione tra accrescimento e fattori ambientali. Il “Parametro statistico” è il coefficiente angolare, il “Valore di t” è il valore ottenuto con il test di student, Pr(>|t|) rappresenta il valore di p (livello di significatività). Le variabili indipendenti considerate sono state: concentrazioni di CO2 in atmosfera (ppm), temperatura media annuale (°C) e precipitazioni annuali (mm).
| Coefficiente regressione lineare |
Parametro statistico |
Errore standard |
Valore di t | Pr (>|t|) |
|---|---|---|---|---|
| (Intercetta) | 148.437 | 109.631 | 1.354 | 0.177 |
| CO2 atmosferica | 0.199 | 0.312 | 0.64 | 0.523 |
| Temperatura | 64.804 | 7.492 | 8.649 | 1.81E-15 |
| Precipitazione | 0.017 | 0.075 | 8.649 | 8.22E-01 |
Nelle analisi di breve periodo (2000-2020) non sono state osservate correlazioni significative tra l’accrescimento e umidità, precipitazioni e contenuto idrico del suolo. La pioggia non risulta un fattore limitante per i siti in primavera, dal momento che l’approvvigionamento abbondante di acqua nel suolo è garantito dallo scioglimento dello spesso manto di neve accumulatosi durante l’inverno (il manto nevoso può superare il metro e mezzo di altezza). Si evidenzia invece una relazione negativa tra l’accrescimento e l’altezza del manto nevoso (R = -0.4, p < 0.001).
Effetto del trattamento su accrescimento e relazioni tra accrescimento e clima
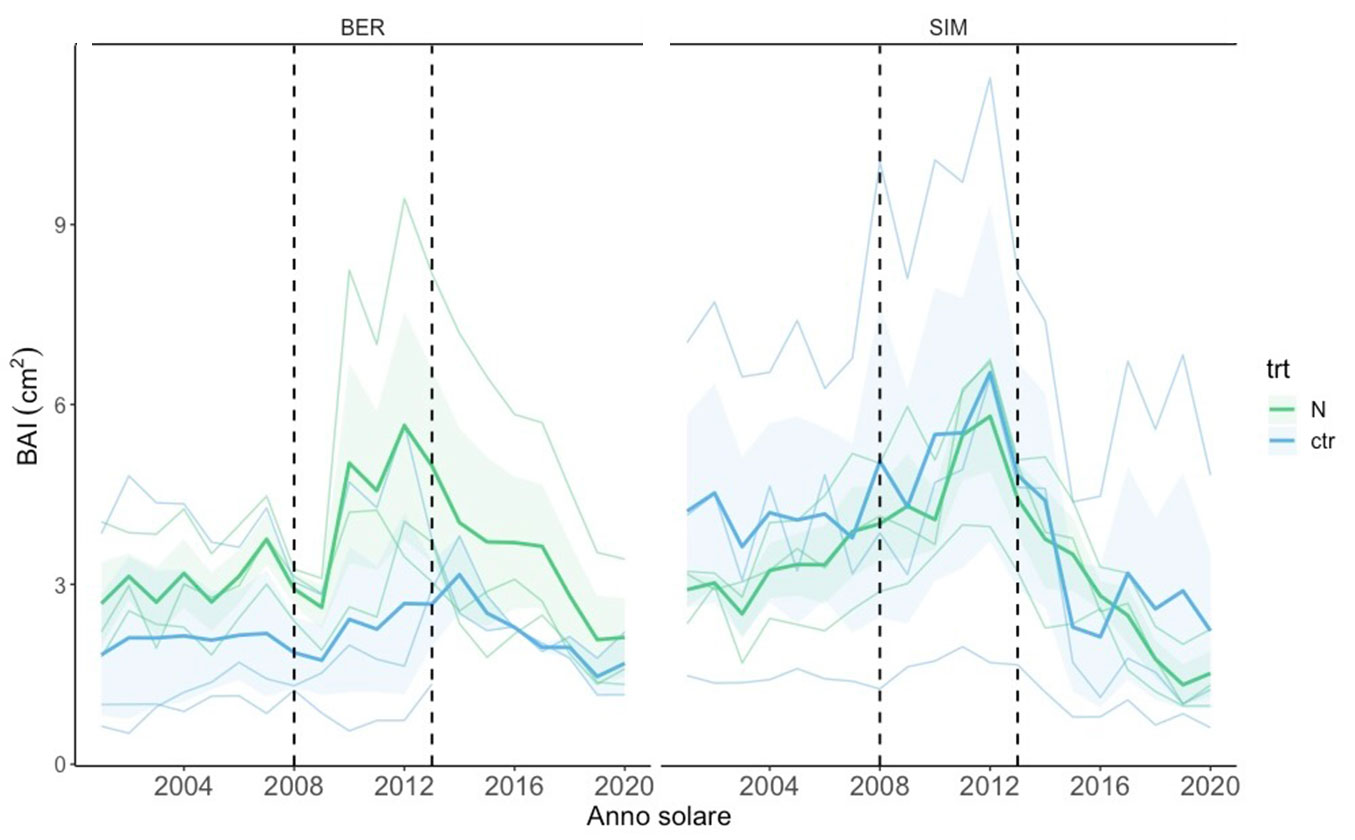
Negli anni del trattamento, tra il 2008 e il 2013, si osserva come sia il controllo che il trattato abbiano un picco di crescita degli alberi in entrambi i siti (Fig. 5). La risposta positiva nell’accrescimento durante gli anni del trattamento osservata soprattutto nel caso di BER non è però risultata significativa (Tab. 2). Dall’analisi della varianza emerge che non c’è una differenza significativa tra l’accrescimento degli alberi sottoposti all’aumento di N mediante fertilizzazioni e gli alberi del controllo. Pertanto, in nessuno dei popolamenti studiati possiamo attribuire alla fertilizzazione azotata l’incremento di accrescimento osservato a partire dal 2010. In particolare, durante gli anni del trattamento, le temperature sono risultate maggiori in BER e le precipitazioni in SIM, rispettivamente sopra lo zero le temperature sia massime che minime (0-6 °C), mentre le precipitazioni medie sono state di 1100-1600 mm; fattori che rispettivamente determinano un aumento di accrescimento nei due siti (Fig. 5).
Fig. 5 - Media degli incrementi di area basimetrica del trattamento e del controllo nel breve periodo (2000-2020). Curve di accrescimento per il periodo interessato dal trattamento di fertilizzazione azotata (2008-2013) indicato con linee tratteggiate e gli 8 anni antecedenti. Le linee di maggior spessore rappresentano la media delle repliche per sito, quelle sottili i dati per i singoli individui. L’area ombreggiata per ciascuna curva media rappresenta la deviazione standard. La sigla “trt” indica il trattamento.
Tab. 2 - Analisi della varianza per valutare l’effetto di diversi fattori (trattamento, periodo, sito e loro interazione) sull’accrescimento degli alberi. “numDF” e “denDF” indicano i gradi di libertaÌÂ al numeratore e al denominatore, rispettivamente, il “Valore di F” è la media quadratica del fattore divisa per la media quadratica dell’errore, e Pr(>|F|) è il valore p del test F. “Periodo” si riferisce all’intervallo di tempo analizzato (2008-2013 durante trattamento), “Trattamento” è il fattore che indica la fertilizzazione azotata, mentre “Sito” si riferisce agli alberi studiati.
| Fattori | numDf | denDF | Valore di F | Pr (> F) |
|---|---|---|---|---|
| Trattamento | 1 | 8 | 0.16667 | 0.6938 |
| Periodo | 2 | 15 | 13.54404 | 0.0004 |
| Sito | 1 | 8 | 0.85533 | 0.3821 |
| Trattamento:periodo | 2 | 15 | 0.89720 | 0.4285 |
| Trattamento:sito | 1 | 8 | 1.00264 | 0.3460 |
| Periodo:sito | 2 | 15 | 2.69107 | 0.1003 |
| Trattamento:periodo:sito | 2 | 15 | 0.25560 | 0.7778 |
Discussione
La rigidità dell’ambiente boreale è testimoniata dagli andamenti degli accrescimenti degli alberi nel lungo periodo. Gli alberi studiati sono infatti risultati fortemente influenzati dalle temperature e dall’altezza della neve che, in particolare nel periodo primaverile e autunnale, determina un ritardo o un anticipo della stagione vegetativa. Le cronologie estese a più di 120 anni ci permettono di verificare anche la risposta a componenti del cambiamento globale che hanno subito variazioni nel corso dei decenni. Uno di questi è la variazione di concentrazione di CO2 atmosferica, fattore determinante del cambiamento climatico, che tuttavia non è risultato essere un fattore significativo nello spiegare le variazioni di accrescimento nei siti considerati. Simili risultati sono già stati riportati in altri studi, soprattutto in ecosistemi boreali ([20], [10], [23]). Di fatto, non si tiene spesso conto della necessità da parte degli alberi di un aumento in parallelo di nutrienti come fosforo, potassio ma soprattutto N, che possano supportare l’effetto fertilizzante della CO2 in atmosfera sull’accrescimento e sulla produttività degli ecosistemi forestali ([30]).
Si ipotizzava che una maggiore quantità di N per una specie a lento accrescimento come la P. mariana, che vegeta su suoli poveri di elementi disponibili e coperti da neve per gran parte dell’anno, avrebbe favorito un aumento della fotosintesi, e di conseguenza dell’accrescimento degli alberi ([15]). In realtà, nessuno dei due popolamenti studiati ha mostrato una risposta significativa al trattamento di fertilizzazione azotata.
Il suolo particolarmente umido e periodicamente sottoposto ad un innalzamento della falda, in una stazione con basse temperature che impediscono la mineralizzazione dell’N da parte dei microrganismi, avrebbe potuto beneficiare della fertilizzazione azotata e favorito l’accrescimento degli alberi in BER. Tuttavia, questa ipotesi è stata confutata dalle evidenze dello studio, dal momento che, pur osservando una tendenza ad un maggiore accrescimento per alberi interessati dalla fertilizzazione, la differenza tra controllo e trattamento non è risultata significativa.
Durante il trattamento, l’aumento generale di accrescimento in SIM può essere legato ad un aumento di temperature e precipitazioni (10% e 40%), in particolare tra il 2011 e il 2013, che può averne stimolato la ripresa vegetativa in primavera (Fig. 5). Questo però vale anche per gli alberi del controllo, che sono comunque stati trattati solo con acqua, considerando un apporto (in mm) pari a quello utilizzato nel caso della fertirrigazione con N.
Il trattamento non ha interferito con le interazioni accrescimento-clima. In vari studi e ricerche effettuate nel passato, si è visto come l’aumento di apporto di nutrienti al suolo renda i soprassuoli più suscettibili alle variazioni climatiche, cosa che nei nostri siti non è stato osservato ([6], [35]). Nemmeno i risultati delle analisi di xilogenesi condotte nei due siti hanno mostrato un effetto dei due trattamenti (fertilizzazione e riscaldamento del suolo) sull’attività cambiale e sulla fenologia dell’accrescimento secondario ([13], [32]).
L’assenza di una risposta al trattamento potrebbe essere legata a diversi aspetti sia relativi alla durata e al disegno sperimentale che a possibili altri processi che possono essere stati influenzati dal trattamento. L’esperimento in bosco è stato svolto per cinque anni, un tempo relativamente lungo per potersi aspettare delle risposte da parte degli alberi, ma forse troppo breve per una specie a così lento accrescimento, molto conservativa, che vive in un ambiente dove la stagione vegetativa è limitata (soprattutto nel popolamento più a nord e a maggior altitudine). Inoltre, un’altra spiegazione può essere legata al ridotto numero di repliche predisposte in partenza nel disegno sperimentale, giustificato dalla difficoltà oggettiva di effettuare il trattamento sopra chioma in bosco. Pur mostrando andamenti interessanti negli anni del trattamento (si veda ad esempio il caso di BER), considerare 3 alberi potrebbe non essere sufficiente per rilevare un effetto del trattamento su una specie a così lento accrescimento.
Il maggiore input di N ricevuto potrebbe essere stato assorbito (sia direttamente dalle chiome o dalle radici), aumentando l’attività fotosintetica della pianta, ma il carbonio potrebbe non essere stato utilizzato nell’accrescimento secondario, ma piuttosto allocato in altri comparti, come ad esempio le radici o la biomassa fogliare ([39]). Infine, non è da escludere che l’N fornito attraverso il trattamento possa essere stato utilizzato direttamente dai microrganismi sia nella fillosfera ([21], 2024) che nella rizosfera (in seguito al dilavamento di quanto accumulato sulle chiome durante un evento di precipitazione), prima ancora che esso potesse essere direttamente disponibile per le piante.
Studi su piantine di P. mariana allevate in serra hanno messo in evidenza una scarsa capacità di assorbimento fogliare di N ([2]). Questo risultato andrebbe confermato anche su piante adulte, effettuando misure nei diversi comparti (incluso la rizosfera) per poter catturare eventuali differenze nell’allocazione del carbonio e tracciare il destino dell’N apportato alle piante. Un’analisi a scala ecosistemica avrebbe consentito di verificare eventuali variazioni dello stato nutritivo della pianta in relazione al trattamento e delle diverse strategie di stoccaggio del C.
In entrambi i siti, durante gli anni della fertilizzazione, ci sono state temperature più alte e piogge più consistenti che hanno favorito un maggiore accrescimento, a prescindere dal trattamento (Fig. 5). Durante gli ultimi anni dell’esperimento (2012-2020), si è osservata una rapida diminuzione di accrescimento in entrambi i popolamenti. Questa riduzione di crescita è stata ricondotta alla riduzione della biomassa fogliare (con effetti negativi sulla fotosintesi) causata dall’epidemia di un insetto defogliatore (Choristoneura fumiferana C.). Il possibile maggiore attacco di Choristoneura fumiferana nel trattato può essere legato a possibili effetti (feed-back) inattesi. Tale insetto, infatti, nutrendosi degli aghi resi più appetibili dall’arricchimento di N, potrebbe essere stato maggiormente favorito dal trattamento di fertilizzazione. L’attacco negli anni 2000 da parte dell’insetto risulta infatti di maggior intensità rispetto a quello degli anni âÂÂ70, riconducibile anche all’aumento delle temperature dovuto al cambiamento climatico ([41] - Fig. 1, Fig. 2). D’altro canto, il disturbo biotico legato all’attacco dell’insetto defogliatore potrebbe aver diluito l’effetto del trattamento. L’assenza di dati relativi ad altre componenti della pianta e del suolo e la breve cronologia di accrescimento durante il trattamento non permette di verificare l’ipotesi di un iniziale stoccaggio da parte degli alberi alle radici e di un eventuale utilizzo successivo in situazioni di stress generato dal disturbo biotico.
Conclusioni
L’ecosistema forestale dominato da Picea mariana in questo studio ha dimostrato ancora una volta il suo alto grado di omeostasi, non solo verso le temperature rigide e la neve durante la stagione vegetativa, ma anche rispetto ad un simulato aumento dell’input di N sotto forma di deposizione umida che ad attacchi da insetti. La crescita lenta di questa specie garantisce una minor sensibilità verso i fattori abiotici e, quindi, una maggiore resistenza e resilienza, permettendole di mantenere il ruolo dominante nella foresta boreale nordamericana. Tuttavia, le foreste boreali sono condizionate dal cambiamento climatico, e in particolare dall’aumento di temperature che, se da un lato favorisce un allungamento della stagione vegetativa, dall’altro rende i popolamenti forestali più meridionali maggiormente vulnerabili ad epidemie di insetti e ad incendi, convertendoli da sink a source di carbonio ([46], [31]).
L’assenza di risultati significativi dell’esperimento non fornisce indicazioni circa un potenziale effetto positivo dell’aumento della deposizione atmosferica di N sull’accrescimento e il sequestro di C in ecosistemi boreali, almeno non per i due siti considerati. Ulteriori studi sono tuttavia necessari, su altre specie e soprattutto su una scala temporale più ampia, per indagare se altri elementi, come l’N fornito dalle fertilizzazioni e lo zolfo delle deposizioni atmosferiche, possano influire sull’accrescimento e sulla capacità di sequestro di carbonio da parte degli alberi. L’interazione pianta-deposizioni potrebbe essere positiva, aumentando la concentrazione di nutrienti si osserverà un maggior accrescimento e assorbimento; o negativa, rendendo più sensibili le piante si vedrà a un aumento della loro mortalità che le convertirebbe in C source ([42]). Studi su P. mariana in vivaio hanno evidenziato che la sua capacità di assorbimento fogliare è piuttosto bassa ([2]), ma gli alberi adulti in bosco potrebbero mostrare una diversa attitudine, che potrebbe portarli ad essere considerati purificatori di queste sostanze inquinanti.
Esperimenti di manipolazione in foresta sono complessi nella realizzazione e nell’interpretazione dei risultati. Un tempo di analisi più lungo, unito a misure su altre componenti, sono necessari per una maggiore comprensione sull’influenza dei fattori del cambiamento globale su questi ecosistemi, non solo in termini di dinamiche di accrescimento ma anche di dinamiche dell’N a scala ecosistemica.
Ringraziamenti
Il presente lavoro è stato possibile grazie alla preziosa collaborazione di H. Morin, M.-J. Tremblay, R. Silvestro, F. Gionest, D. Laprise, C. Lupi e A. Turcotte.
References
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar