Forests in the future - No forest, no future
Forest@ - Journal of Silviculture and Forest Ecology, Volume 21, Pages 82-92 (2024)
doi: https://doi.org/10.3832/efor4729-021
Published: Dec 20, 2024 - Copyright © 2024 SISEF
Commentaries & Perspectives
Abstract
The paper examines the crucial role of forests in regulating climate and biodiversity, proposing management and conservation approaches to address the climate crisis and maintain the planet’s balance. Migration to another planet is not feasible in the near term due to vast distances, the human body’s inability to thrive for extended periods outside of Earth-like conditions, and the necessity of co-evolving with a planet’s biodiversity. Biodiversity loss may be a primary driver of ongoing climate change, as living organisms profoundly influence Earth’s climate. Forest “structure” could bridge systemic and naturalistic forestry, providing a reference model for forest management, potentially including future space exploration. The humipedon, or topsoil layer, changes with tree age, preparing the next forest generation through the action of soil fauna. Prescribed burns should be limited to extreme cases to avoid negative impacts on biodiversity and soil function. To protect at least some primary forests (Intact Forest Landscapes), an economic incentive could be established for countries that preserve them, recognizing them as an inviolable planetary asset. Expanding existing forests by 25% could remove half of the CO2‚ released over the past 50 years, addressing half of the pressing climate issue. Finally, while space exploration remains compelling, a non-conflicting priority should be the restoration of planetary biodiversity. This would allow us to pursue space aspirations to connect with the distant universe as a source of biodiversity rather than as an escape from an environment we have made inhospitable to human life.
Keywords
Antropocene, Cambiamento Climatico, Humus Forestale, Intact Forest Landscape, Foreste Primarie, Foreste Nello Spazio, Space-it Up
Durante i giorni del XIV Congresso Nazionale della SISEF a Padova (9-12 settembre 2024) sono usciti due articoli su giornali nazionali a commento del tema fondante del convegno, “le Foreste nel Futuro”: il primo pubblicato sul quotidiano “La Repubblica” (⇒ https://www.repubblica.it/green-and-blue/2024/09/10/news/foreste_vergini_biodiversita_cambiamento_climatico-423487546/) e il secondo su “Il Fatto Quotidiano” (⇒ https://www.ilfattoquotidiano.it/2024/09/10/le-foreste-sono-preziose-ma-non-ci-salveranno-dal-disfacimento-dellambiente/7686419/). Alcune considerazioni in essi contenute meritano approfondimenti che riportiamo nelle sette parti in cui è stato suddiviso questo articolo.
Andare a vivere su un altro pianeta non è un’opzione ragionevole
Non abbiamo un corpo in grado di sopportare la separazione definitiva dal nostro pianeta. Alcuni astronauti hanno vissuto nello spazio per più di un anno. Valeri Polyakov è stato il più resistente di tutti, rimanendo in orbita per 437 giorni e 18 ore. Tutti gli altri tornano prima, non per nostalgia, ma per motivi di salute. Il nostro corpo è adattato alla gravità terrestre. Nello spazio, il sangue non circola più come sulla Terra. I muscoli (anche il cuore) e le ossa si atrofizzano; gli astronauti fanno esercizi quotidiani per fronteggiare il problema. L’orecchio funziona male a causa dell’orientamento nello spazio, con sensazioni di vertigini e vomito. Siamo nati in un campo gravitazionale che influisce sul funzionamento del corpo. Tornati sulla Terra, agli astronauti servono diverse settimane per riuscire a camminare come prima. Inoltre, e più vicino al tema di questo articolo, sulla Terra siamo immersi in una nuvola di microrganismi che coprono la nostra pelle, che respiriamo e mangiamo continuamente. Nell’aria di una navicella spaziale, i microrganismi sono molti di meno e non collegati a tanti altri come sulla Terra. Ci sono pericoli di infezione, poiché l’equilibrio ecologico tra i gruppi di microrganismi viene interrotto; è necessario filtrare continuamente l’aria, come in una sala operatoria. Le tecniche attuali ci permettono di arginare il problema ma non di risolverlo completamente ([51]), poiché non conosciamo ancora bene i microrganismi.
La realtà è molto diversa da quella riassunta nei programmi televisivi. Tanti di noi morirebbero durante un viaggio e una breve sosta sulla Luna, anche se questa dista solo un secondo luce dalla Terra. L’accelerazione, la paura, il mal di testa; l’ambiente lunare, poi, ha caratteristiche incompatibili con la vita: niente aria e acqua, e zero microrganismi vivi. La temperatura passa da 127 °C di giorno a -173 °C di notte, periodi che durano 14 giorni e mezzo l’uno (noi, abbiamo dei cicli circadiani di 24 ore integrati nel motore); non esiste lo scudo dell’ozono che proteggerebbe da radiazioni solari pericolose e il suolo è coperto da una polvere finissima che si attacca dappertutto, intasa le apparecchiature e fa male.
Ci vogliono 7 mesi per andare su Marte con i mezzi non ancora disponibili oggi. Se avete tempo, guardate il film “The Martian” del 2015, dove Matt Damon tenta di produrre patate su Marte usando gli escrementi degli astronauti come fertilizzante, dopo aver prodotto un’aria simile a quella terrestre in una serra ermeticamente sigillata. La storia finisce bene, ma la realtà del viaggio è più vicina a quella raccontata in un’altra opera cinematografica intitolata “First Man” del 2018, dove Ryan Gosling nel ruolo di Neil Armstrong riesce a mettere piede sulla Luna il 20 luglio del 1969. Le difficoltà sono da Reinhold Messner, l’alpinista trentino che riusciva a passare da un ottomila all’altro senza ossigeno.
Se Giulio Cesare avesse potuto parlare via “Zoom” al Senato riunito mentre era in Gallia, forse non lo avrebbero fatto fuori al rientro. Ma 2000 anni di storia separano i corrieri romani e il cellulare di oggi. Ci sono progetti di scienziati che immaginano piattaforme spaziali capaci di viaggiare a velocità pari al 12% di quella della luce. Purtroppo, anche a queste velocità per ora solo teoriche, non basterebbe una nostra vita per potere raggiungere le stelle più vicine.
La diminuzione della biodiversità potrebbe essere la causa principale del cambiamento climatico in corso
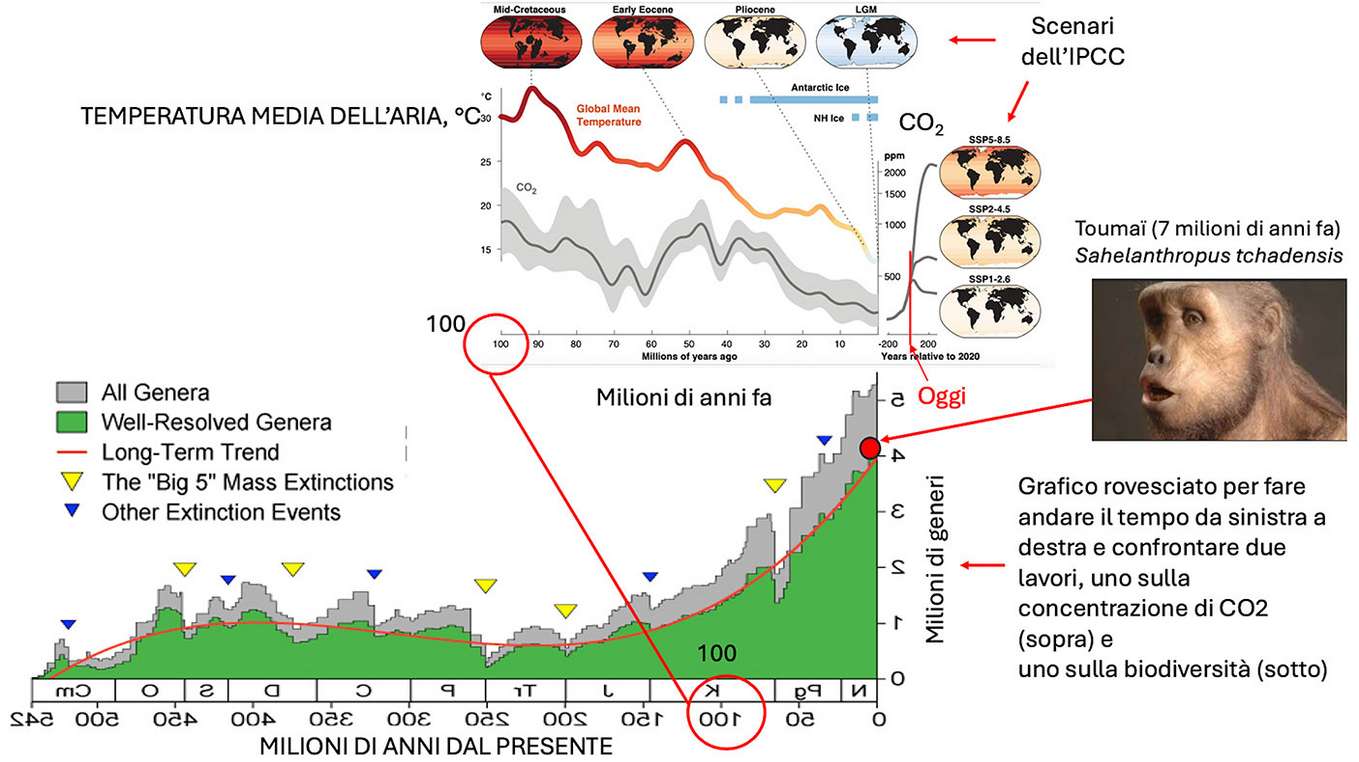
Poiché quasi tutti noi stiamo bene al di fuori delle foreste, sembra possibile che queste non siano indispensabili, a parte per il legno, per le passeggiate e forse anche per l’acqua. Si distendono su circa 1/3 della superficie abitabile del pianeta. Gli altri 2/3 sono deserti, rocce, nevi perenni, terreni agricoli (più della metà), praterie/pascoli e macchia, zone urbanizzate e città (1%). Se le foreste diventassero terreni agricoli e/o nuovi pascoli, la biodiversità del pianeta diminuirebbe in modo drastico. Nella più grande foresta primaria dell’Amazzonia, ci sono 427 specie di mammiferi, più di 1300 specie di uccelli, 378 specie di rettili e più di 400 specie di anfibi. Questa densità di specie si trova anche in altre foreste primarie (1/3 di tutte le foreste). In totale, le foreste del mondo contengono l’80% di tutte le specie terrestri di animali, piante e insetti ([19]). Se perdiamo questa biodiversità, sperimenteremo dei disagi simili a quelli affrontati dagli astronauti nello spazio con una ridotta biodiversità nella loro navicella. La riduzione dell’80% della biodiversità è già avvenuta sul pianeta verso la metà del Cretaceo, 100-150 milioni di anni fa, quando i generi erano 1/5 di quelli attuali (Fig. 1). Senza la biodiversità delle foreste non sappiamo cosa accadrebbe alla nostra specie, perché a quell’epoca l’uomo non esisteva. Da sette milioni di anni siamo ecologicamente e funzionalmente collegati alla biodiversità che ci circonda. Le zanzare, per esempio, danno da mangiare a tanti di quei viventi che molti ecosistemi non starebbero in piedi senza di loro; è noto che modificando l’ambiente favoriamo lo sviluppo delle zanzare, con conseguenze ecologiche imprevedibili ([20]).
Fig. 1 - (In alto): riduzione della temperatura media e concentrazione di CO2 nell’aria negli ultimi 100 milioni di anni ([50]). (In basso a sinistra): andamento della biodiversità durante il Fanerozoico, 545 milioni di anni, da Mannion et al. ([31]) sulla base dei dati tratti da Willig et al. ([55]) e Jenkins et al. ([24]). Si può notare che la biodiversità cresce all’inizio del Fanerozioco, rimanendo poi costante per 300 milioni di anni, e riprendendo a crescere in modo esponenziale negli ultimi 100 milioni di anni, con momenti di crisi (triangoli gialli e blu) ogni 62 milioni di anni circa. (A destra): ricostruzione della testa del nostro parente ancestrale Toumaï ([8]), nato circa 7 milioni di anni fa, in una fase di elevata biodiversità sul pianeta (circa 4 milioni di generi stimati).
Per avere un’idea del clima che potrebbe caratterizzare la Terra senza foreste, e tenendo presente che l’attività degli organismi viventi influenza il clima del pianeta ([28], [32]), possiamo ipotizzare che la temperatura media globale e la concentrazione di CO2 fossero simili a quelle di 100 milioni di anni fa (Fig. 1), quando la biodiversità era 1/5 di quella odierna. Tierney et al. ([50]) hanno confrontato le previsioni di temperatura dell’aria e concentrazione di CO2 degli scenari IPCC con quelli del periodo che va dal presente a meno 100 milioni di anni fa (Fig. 1, in alto). Lo scenario peggiore dell’IPCC corrisponderebbe al clima del pianeta a metà del Cretaceo (100 milioni di anni fa), con valori di temperatura dell’aria e di concentrazione di CO2 doppi rispetto a quelli di oggi. Noi umani non c’eravamo, nel Cretaceo. Se consideriamo la biodiversità come un macro-sistema in cui tutti i viventi siano collegati tra loro, in equilibrio in ciò che chiamiamo la biosfera, una biosfera che governa i parametri essenziali del pianeta (clima, qualità dell’acqua e dell’aria, cicli degli elementi, correnti oceaniche e venti), con la perdita delle foreste l’evoluzione del pianeta diventerebbe imprevedibile. Il fatto che siamo tra le specie nate da poco (Fig. 1), significa che abbiamo una profonda dipendenza funzionale dagli esseri viventi che sono presenti sul pianeta oggi, animali, piante, ma anche microrganismi che conosciamo ancora male ([40], [47], [22]).
Dal momento che non possiamo vivere senza foreste, dobbiamo trovare un modo di conservare quelle che ci rimangono ([5]). Che siamo già sulla strada di una sesta grande crisi della biodiversità è sicuro ([7]). È noto da tempo anche il fatto che sono gli organismi a creare il clima del pianeta ([28], [27], [45], [9], [60]). Quando la temperatura media dell’aria del pianeta sarà cosi alta che parte degli organismi che la producono cominceranno a a morire perché inadatti al nuovo clima, la temperatura si stabilizzerà di nuovo, probabilmente, per poi scendere a valori inferiori quando la nuova collettività di organismi si troverà in equilibrio con il clima che si è creato. Se il sistema biologico ripercorre le tappe del passato geologico mostrato in Fig. 1, questa comunità crescerà quando la temperatura si abbasserà, e produrrà nuovi organismi che utilizzeranno le risorse del pianeta per il loro sviluppo. Quello che conta non è il numero delle specie ma la qualità e quantità delle interazioni tra specie ([34]). Più sono le specie cha manifestano un’alta connettività funzionale con altre specie, e meglio vengono utilizzate le risorse del pianeta, il quale vede di conseguenza aumentare la sua biodiversità. Se questo aumento di biodiversità viene impedito nel lungo periodo, per una ridotta interazione tra un numero alto di specie a causa della loro estinzione (che è quello che sta succedendo ora sul nostro pianeta - [16], [52]), si innesca una regressione verso un nuovo equilibrio del sistema Terra con una minore biodiversità (simile a quella di 100 miloni di anni fa - Fig. 1). Si intravede allora il pericolo che dopo una perdita di biodiversità (e un parallelo aumento inusuale della temperatura dell’aria, che ritornerà lentamente verso valori più bassi), al momento della ripresa del sistema con nuove specie non ci sia più posto per Homo sapiens sapiens, poiché la specie necessiterebbe di un pianeta molto più biodiverso (in particolare microorganismi di connessione con il resto di nuovi viventi). La biodiversità è una maglia che si tesse nel tempo dei milioni di anni, ed è necessario proteggerla per la nostra sopravvivenza.
Il parametro della “statura” può collegare selvicoltura sistemica e selvicoltura naturalistica
La foresta sa evolvere da sola, non ha bisogno dell’uomo per sopravvivere ([2]). Detto in modo più conciso, la foresta è un sistema autopoietico ([33]). Il principio di gestione che più rispetta questa realtà è questo: “meno si taglia e meglio è per la foresta”, ma gli umani che vivono di legno e che commerciano e mangiano i prodotti dell’agricoltura non sono d’accordo. Per mettere tutti d’accordo, la selvicoltura sistemica propone tre tabelle di indirizzi silvosistemici ([10], [38], [39]). Per distinguere la selvicoltura sistemica dalla selvicoltura naturalistica, queste regole di gestione forestale sono presentate in parallelo, in una tabella di obiettivi e criteri (Tab. 1) e in una di assestamento (Tab. 2). I riferimenti numerici e le formule matematiche sono riassunte in una terza tabella (Tab. 3). Si tratta di dati espressi in percentuale, con valori che dipendono dal rapporto tra provvigione reale e potenziale, tenendo conto del tempo di ritorno nella particella per le operazioni di controllo.
Tab. 1 - Obiettivi e criteri di pianificazione: confronto fra Assestamento classico-naturalistico e Gestione sistemica.
| Criterio | Assestamento classico-naturalistico | Gestione sistemica |
|---|---|---|
| Obiettivo | Produzione e/o altri obiettivi specifici (“servizi ecosistemici”: protezione, paesaggio, ricreazione, etc.) | Aumento della complessità e della funzionalità del bosco. Rinaturalizzazione dei sistemi forestali semplificati e conseguente aumento della biodiversità |
| Concezione del bosco | Insieme di alberi di interesse economico-finanziario | Sistema biologico complesso e adattativo |
| Processo pianificatorio | Portare il bosco verso una struttura e una composizione predefinite in base al modello di riferimento - bosco normale | Sostenere l’autorganizzazione del bosco |
| Divisione del bosco | Comprese (o serie di taglio) in base agli obiettivi della gestione. Particelle omogenee (stazione, soprassuolo, trattamento selvicolturale) | Comparti come unità di gestione Individuazione dei diversi popolamenti all’interno dei comparti (unità colturali) |
| Rilievi qualitativi | Descrizione particellare, spesso standardizzata | Descrizione accurata dei diversi popolamenti presenti nel comparto, con loro localizzazione (mappatura) |
| Rilievi quantitativi | A livello di particella. Stimare provvigione reale per particella | A livello di ogni popolamento. Stima provvigione reale per ogni popolamento |
Tab. 2 - Confronto fra Assestamento classico-naturalistico e Gestione sistemica. Determinazione del percorso colturale e della ripresa.
| Criterio | Assestamento classico | Gestione sistemica |
|---|---|---|
| Ciclo colturale | Boschi coetanei: turno Boschi disetanei: diametro di recidibilità | Indefinito |
| Trattamento selvicolturale | Predefinito in relazione al modello di riferimento (bosco normale o struttura desiderata). Generalmente per particella, a volte indicazioni a livello di sottoparticella | Interventi cauti, continui e capillari con l’obiettivo di seguire i processi evolutivi dell’ecosistema. Indicazioni per i singoli popolamenti (unità colturali) presenti nei comparti |
| Determinazione della ripresa | Metodi di assestamento planimetrici, eventualmente con verifica provvigionale, Metodo colturale orientato | Metodo colturale incondizionato; “Metodo del controllo colturale” |
| Quantificazione della ripresa | In ha o m3 in base al metodo di assestamento e agli obiettivi di gestione | Tramite accurata descrizione del criterio dell’intervento. Confronto provvigione reale (Pr) con provvigione minimale (Pmin). Livelli di prelievo in funzione delle differenze fra Pr e Pmin |
| Tipo di ripresa prevista dal Piano | Ripresa predeterminata in base al modello adottato | Ripresa colturale, intensità interventi non deve intaccare la provvigione minimale nei popolamenti |
| Criteri e indicatori per la verifica dei risultati della gestione | In relazione al metodo di assestamento e agli obiettivi del Piano. Verifica del percorso di normalizzazione. Incremento legnoso del bosco | Andamento della rinnovazione naturale Differenziazione dei soprassuoli (indicatori strutturali, composizione, ecc.). Andamento della provvigione reale in confronto alla provvigione minimale e al livello provvigionale di partenza |
Tab. 3 - Limiti di prelievo in funzione del rapporto tra provvigione reale (Pr) e provvigione minimale (Pmin); prelievo espresso in percentuale sulla provvigione reale del popolamento (Pr) in funzione del tempo di ritorno sul comparto. Valori massimi di prelievo annuo e, come esempio, per un Piano che prevede un tempo di ritorno su ogni comparto pari a 10 e a 20 anni.
| Pr vs. Pmin | Prelievo (%) | ||
|---|---|---|---|
| annuo | 10 anni | 20 anni | |
| Pr ≥ 2.0 Pmin | ≤ 1.50 | ≤ 15.0 | ≤ 30 |
| Pr ≥ 1.8 Pmin | ≤ 1.25 | ≤ 12.5 | ≤ 25 |
| Pr ≥ 1.6 Pmin | ≤ 1.00 | ≤ 10.0 | ≤ 20 |
| Pr ≥ 1.4 Pmin | ≤ 0.75 | ≤ 7.5 | ≤ 15 |
| Pr ≥ 1.2 Pmin | ≤ 0.50 | ≤ 5.0 | ≤ 10 |
In sintesi, dal punto di vista “del forestale con la motosega” (quanto e come si taglia) si considerano i valori di provvigione minimale, poi si taglia al massimo l’1.5% annuo se la provvigione reale è il doppio della minimale, e meno dello 0.5% se la provvigione reale è solo fino al 20% in più di quella minimale. In altre parole, si riprenderebbe l’equivalente di tutta la foresta ogni 100 anni, in media, con una forchetta che va da ogni 65-70 anni se molto produttiva, fino a ogni 150-200 anni se la foresta produce poco. La provvigione minimale è un parametro di precauzione che serve a garantire che con l’intervento non si intacchi il funzionamento di base del sistema. La provvigione minimale varia in funzione delle caratteristiche intrinseche delle diverse specie - temperamento, longevità e ampiezza del periodo di massima funzionalità biologica delle varie specie - e dei fattori fisici ed ecologici che interagiscono con quelli biologici. Qualora il soprassuolo sia costituito da specie a temperamento eliofilo, la provvigione minimale non deve essere inferiore ai 100-150 m3 per ettaro; per specie a temperamento intermedio, la provvigione non deve scendere al di sotto di 200-250 m3 per ettaro; per specie che tollerano l’aduggiamento la provvigione minimale non può essere inferiore a 300-350 m3 per ettaro.
Le Tab. 1e Tab. 2sono prive di numeri o formule. Il modello di riferimento è quello reale della foresta che rimane in piedi dopo il taglio, verificata dopo il tempo di curazione che varia tra 0 e 20 anni, da scegliere di volta in volta. L’indicazione che viene data è che se la foresta ha perso vigore e provvigione dopo il tempo di curazione, bisogna cambiare metodo di intervento e agire con intelligenza, seguendo i principi ecologici.
Un’altro modo di gestire il bosco fu proposto da Lucio Susmel in diversi lavori e riassunto nel libro “La Normalizzazione delle foreste Alpine” ([49]). La metodologia si può riassumere in quattro punti chiave:
- Una legge nota per le foreste disetanee: la distribuzione del numero di alberi per età (o diametro) segue una curva esponenziale che si può calcolare, migliaia di individui all’inizio del ciclo, pochi alla fine.
- Una legge nota per tutte le foreste: l’altezza degli alberi più grandi di una foresta dipende dalla potenzialità dell’ambiente. Quest’altezza si può stimare misurando gli alberi più alti all’ettaro della compresa; la media di queste altezze diventa un parametro ecologico importante chiamato “statura” (S).
- Delle formule che legano la statura del punto 2 alla curva esponenziale del punto 1 ed a altri parametri della foresta. Susmel associa le formule matematiche ad alcune comuni fitocenosi, seguendo il principio che ogni fitocenosi ha leggi diverse delle altre.
I parametri che Susmel collegò alla statura (S) sono i seguenti: (i) K = coefficiente di decrescenza invariabile con il diametro = rapporto tra il numero di alberi di una classe e quello della classe precedente, considerando classi di diametro di 5 cm, dal diametro massimo fino a quelli della classe di 20 cm. (ii) N = numero medio di alberi ad ettaro della fitocenosi (costante per tipo di fitocenosi); (iii) B = area basimetrica (m2 ha-1); (iv) Dmax = diametro degli alberi dominanti (cm); (v) V = provvigione legnosa o volume cormometrico (tronchi private di radici, ceppaia, rami e cimale) della fitocenosi (m3 ha-1); (vi) ML = Massa legnosa corrispondente al Vn (q.li ha-1 di sostanza secca); (vii) SF = superficie fogliare (m2 ha-1); (viii) VC = volume della chioma (m3 ha-1); (ix) MC = massa della chioma (q.li ha-1 di sostanza secca); (x) MT = massa totale, ML+MC (q.li ha-1 di sostanza secca); (xi) Ai = area di insidenza di tutti gli alberi delle classi ≥ 20 cm (m2 ha-1).
Riportiamo qui di seguito come esempio, i valori dei parametri di due comuni fitocenosi alpine calcolati da Susmel.
- Fitocenosi 1. Altofusto puro di abete bianco, altofusto puro di abete rosso, altofusto misto di abete bianco e abete rosso in varie proporzioni, altofusto misto di abete bianco, abete rosso e faggio con faggio non superiore al 25%, altofusto di abete bianco e faggio, altofusto di abete rosso e faggio (larice e pino silvestre subordinati). Nelle formule: S = statura; K = 4.3/ 3√S; N = circa 300 individui ettaro in fitocenosi irregolari medie; B = 0.97 S (m2 ha-1); Dmax = 2.64 S (cm); V = provvigione legnosa (volume cormometrico) = 0.33 S2 (m3 ha-1); ML = 85 S - 1000 (q.li ha-1 di sostanza secca); SF = 100 S2 (m2 ha-1); VC = 1000 S + 4900 (m3 ha-1); MC = 31 S - 400 (q.li ha-1 di sostanza secca); MT = 115 S - 1400 (q.li ha-1 di sostanza secca); Ai = 110 S + 4000 (m2 ha-1).
- Fitocenosi 2. Altofusto puro di faggio, o dominato da faggio, con roveri o abete bianco e abete rosso fino al 25% del numero di alberi. Melle formule: K = 4.54 /3√S; N = circa 235 individui all’ettaro; B = 0.73 S (m2 ha-1); Dmax = 2.33 S (cm); V= provvigione legnosa (volume cormometrico) = S2 / 4.23 (m3 ha-1); ML = 46 S - 82 (q.li ha-1 di sostanza secca); SF = 3320 S + 1620 (m2 ha-1); MC = 30 S - 330 (q.li ha-1 di sostanza secca); MT = 81 S - 455 (q.li ha-1 di sostanza secca); Ai = 11858 S + 234 (m2 ha-1).
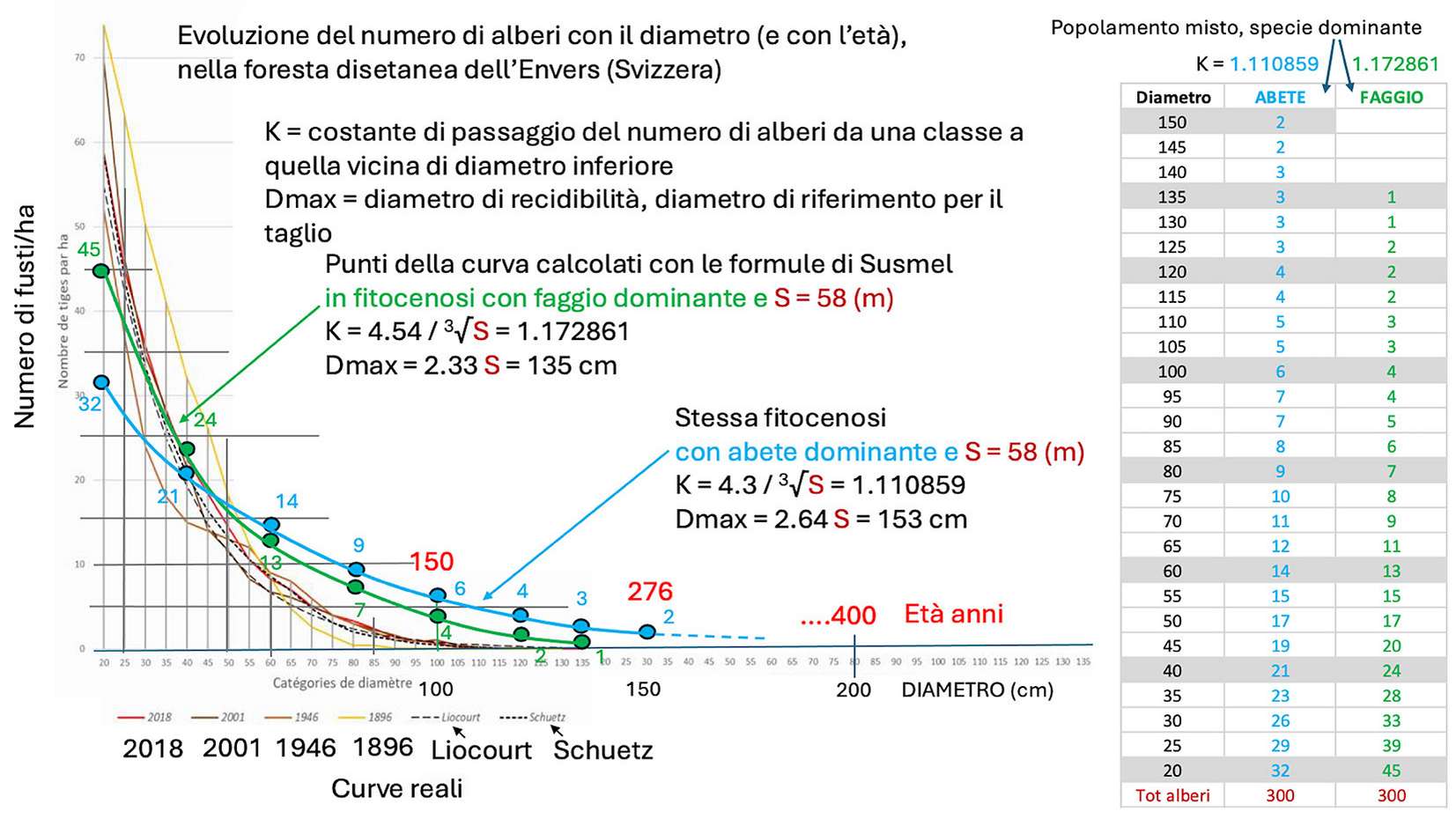
Per visualizzare la struttura matematica di una foresta reale, e comprendere le differenze tra selvicoltura naturalistica e selvicoltura sistemica, riproduciamo un grafico trovato in rete, corrispondente a una foresta mista di abete bianco, faggio e abete rosso (Fig. 2). Si tratta della magnifica foresta svizzera dell’Envers, che viene condotta seguendo le regole di PROSILVA, un’associazione internazionale di forestali che praticano una selvicoltura naturalistica.
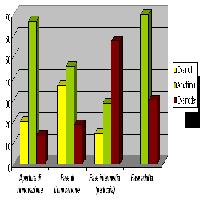
Fig. 2 - Rielaborazione della figura a pag. 4 di Pro Silva Helvetica ([42]). La figura rappresenta il numero di fusti per ettaro in ordinata e le categorie di diametro ogni 5 cm in ascissa. Le originali curve corrispondenti a quattro anni storici (2018-rosso, 2002-marrone, 1946-beige e 1896-giallo) e anche le norme (linee nere discontinue) sono visibili sullo sfondo. Sopra queste curve sono state aggiunte due funzioni normali calcolate con le formule di Susmel a partire dalla stessa statura (quella dell’albero più alto di Envers, 58 m), per ottenere due diametri massimi (Dmax), due coefficienti di passaggio (K), e considerando nei due casi serie di 300 alberi (curva in verde con faggio, e in blu con abete bianco dominanti).
Sopra le curve reali storiche abbiamo tracciato le due curve calcolate con le formule di Susmel per due popolamenti, uno con abete bianco dominante (Fitocenosi 1) e uno con faggio dominante (Fitocenosi 2), utilizzando la statura di 58 metri (!) della foresta svizzera e il numero di 300 alberi ha-1 suggerito da Susmel. Il volume cormometrico calcolato con le formule di Susmel vale 825 o 795 m3 ha-1 per le Fitocenosi 1 o 2 rispettivamente. Per la selvicoltura sistemica tali valori sono ben superiori ai 300-350 m3 ha-1 di provvigione minima assegnata a foreste con specie che tollerano l’aduggiamento, in linea con le qualità produttive di questa foresta.
In sintesi, dal punto di vista “del forestale con la motosega”, con il metodo di Susmel si determina il tipo di fitocenosi in cui si lavora, si misura la statura all’interno di una compresa (una foresta completa di tutti i tipi strutturali necessari al ciclo), e si calcolano i parametri con le formule, tracciando la curva rispettando il numero totale di alberi all’ettaro. Si confrontano poi tali parametri con quelli reali (misure dirette o per aree campione) e si prendono le decisioni per il taglio in modo da mantenere la struttura della foresta il più vicino possibile a quella empirica (che, ricordiamolo, sarebbe quella delle foreste “vergini” utilizzate per concepire le formule). Il taglio si fa per piede d’albero avendo come riferimento il diametro massimo, chiamato per questo diametro di recidibilità. Quest’ultimo parametro dipende dalla statura (nei casi illustrati di abetine con abete dominante; 2.64 · S; faggio dominante: 2.33 · S), e quindi indirettamente da quanto il popolamento viene lasciato invecchiare, o anche dal tipo di “alberi stramaturi” lasciati in foresta dal selvicoltore. Maltoni et al. ([30]) riportano diametri di recidibilità di 50, 60 (o anche più) centimetri, a discrezione del selvicoltore. Se prendiamo 60 cm troviamo stature di 23 e 26 m rispettivamente, che sembrano basse come stature (S = altezza dei 5-7 alberi più alti ha-1) e credibili come altezze dominanti. Si noti che lasciando scegliere al selvicoltore la “statura” di riferimento - e questo vale anche per il numero di alberi, entro certi limiti - si ritorna verso una selvicoltura di tipo sistemico, che lascia spazio all’apprezzamento soggettivo.
In Fig. 2si nota uno scostamento a livello di giovani fusti (in eccesso nella foresta reale, quella delle curve storiche) e in quelli con diametro superiore ai 50 cm (in difetto nella foresta reale, a causa dei tagli di produzione). Volendo intervenire diversamente da quello che si fa oggi nella foresta dell’Envers per renderla più “naturale”, si potrebbero togliere meno fusti di grosso diametro (> 50 cm). Questo spiega anche perché nella foresta reale che si vede in Fig. 2, ci sia più rinnovazione (spazio lasciato libero dagli alberi asportati), corrispondente al numero di fusti all’inizio del ciclo. Questo significa che l’humipedon di questa foresta a fine ciclo si trova nel sistema Mull o Amphi con un OH di debole spessore (sarebbe interessante verificarlo, si veda il capitolo “Novità sul suolo forestale”) e che, una volta scoperto, il suolo anche sotto gli alberi relativamente giovani rimane favorevole alla rinnovazione. A pagina 7 della scheda informativa Pro Silva Helvetica ([42]) leggiamo che dal 1974 al 2008 (35 anni), tutto il volume della foresta misurato nel 1975 è stato rimosso. A pagina 12 leggiamo che ciò corrisponde ad un tasso di taglio di circa 10 m3 per ettaro all’anno, che su 50 anni di tempo medio di ritorno (le 4 curve storiche coprono circa 2 secoli) danno 500 m3 ha-1. Per cogliere la misura degli interventi, tali prelievi corrispondono a più della metà della provvigione calcolata con le formule di Susmel (795-825 m3 ha-1), e porterebbero al limite inferiore della forchetta di 300-350 m3 ha-1 consentita per le foreste ombrofile dalla selvicoltura sistemica.
Le curve di Susmel suggeriscono che ci stiamo allontanando dalla foresta vergine di riferimento, e che il popolamento arboreo sta slittando verso una struttura più giovane (più ricca in piccoli diametri), e con un ciclo più breve (le curve storiche si fermano prima; la curva blu della fitocenosi più ricca di abete di Susmel va oltre i 150 cm per il diametro di recidibilità, alberi di 270 anni). Se l’obiettivo è di rimanere vicini alla struttura di una foresta primaria, si dovrebbero rilasciare più alberi di medio e grosso diametro. Possiamo anche scrivere che rispetto al modello più ricco di faggio (curva verde), verso il quale sta probabilmente evolvendo la foresta in risposta al cambiamento climatico, le curve reali sono più vicine, ma mancano di alberi con diametro tra 50 e 120 cm, che sono quelli che vengono asportati con il taglio.
In generale, si potrebbero aggiustare empiricamente le formule matematiche di Susmel in funzione dei risultati che esse danno nel tempo all’interno non di fitocenosi ma di tipi forestali, come quelli che sono presenti in numerose regioni ([43], [13]), che sono più precisi dal punto di vista ecologico.
Il metodo di Susmel è appropriato per foreste disetanee. Avrebbe poco senso per comprese di foreste coetanee, perché le superfici delle diverse fasi non sarebbero equilibrate e dipenderebbero dalla dimensione degli eventi catastrofici o dei tagli che le hanno generate. Considerando un periodo abbastanza lungo di più cicli forestali, o una vasta superficie su cui questi cicli possano svilipparsi, la struttura dovrebbe essere simile a quella di una foresta disetanea perché la vita dell’albero genera quella della foresta, con equilibrate fasi giovanile, adulta e scenescente distribuite nella compresa.
La selvicoltura sistemica è adatta a tutti i tipi di foresta, ma richiede molta esperienza e capacità di diagnosi poiché manca di modelli di riferimento per la struttura e per i turni. In foreste disetanee, le formule di Susmel sono utili paletti e non sembrano incompatibili con una selvicoltura sistemica. Oggi, queste selvicolture possono contare sulla misura di parametri da satellite che potrebbero nei due casi seguire nel tempo i risultati degli interventi e/o migliorare le formule dei modelli. Un esempio di applicazione della selvicoltuta sistemica è quello del piano di gestione della foresta di Vallombrosa ([11]). Il paesaggio forestale degli Appennini ha subito la pressione dell’uomo fin dall’antichità ed è arrivato ai giorni nostri in uno stato di suddivisione e di trasformazione che la volontà di riportarlo verso la sua copertura vegetale originale ha perso di significato. Per mille ragioni, tra cui anche il cambiamento di finalità in un’area di importanza strategica per il turismo regionale, queste foreste non possono ritrovare la loro struttura originale. In un caso di mosaico forestale molto frammentato e discostato dalla sua struttura primaria, la selvicoltura sistemica permette di gestire singoli comparti, favorendone l’evoluzione naturale, nel rispetto di un minimo di provvigione che garantisce di non peggiorare la situazione attraverso tagli eccessivi.
Novità sul suolo forestale
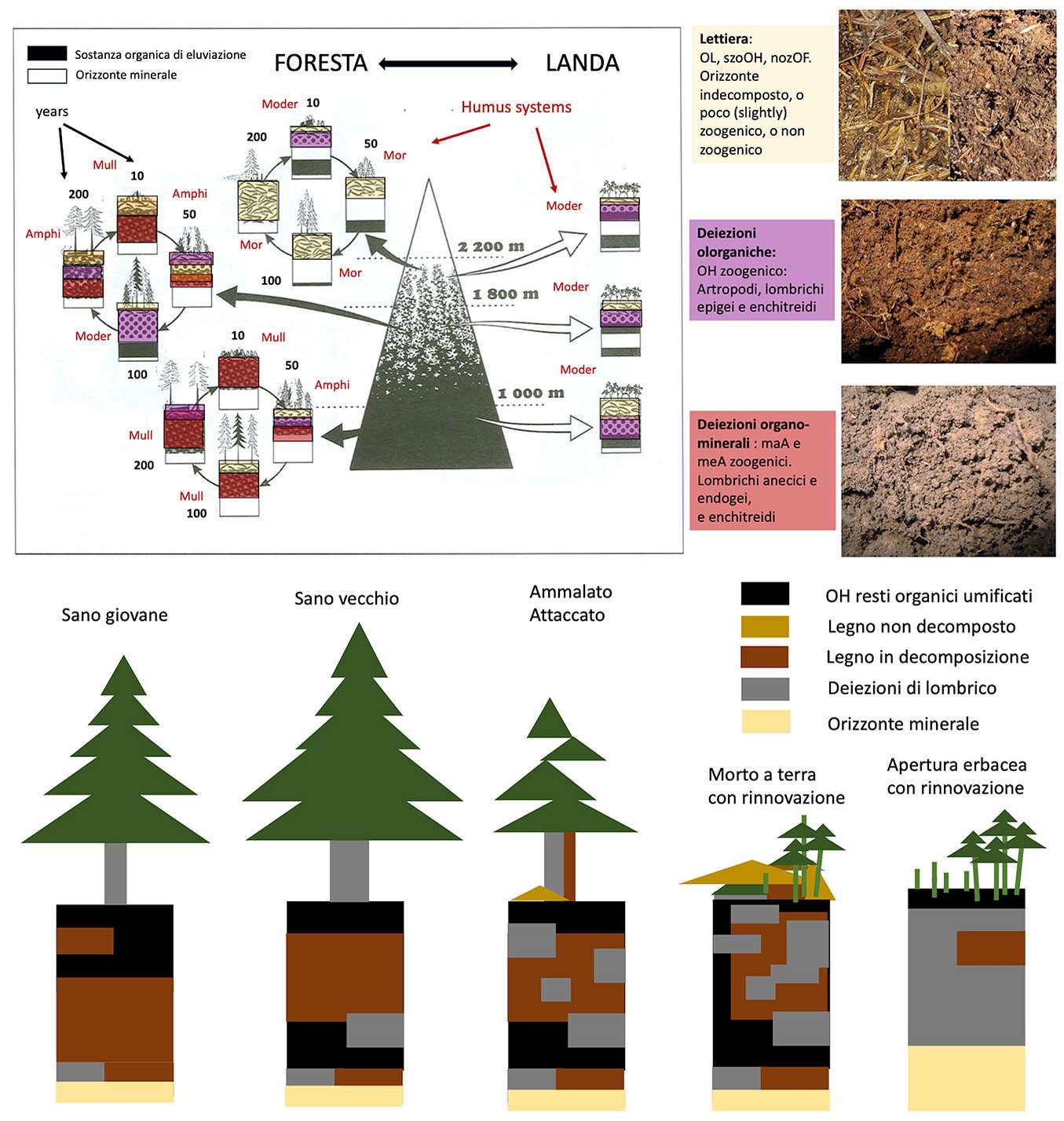
L’humus forestale cambia con l’età degli alberi. Chiamato in gergo humipedon, questa parte di suolo superficiale (primi 10-50 cm) è composto di orizzonti organici (OL, OF, OH) e di un orizzontie organo-minerali (A). In Fig. 3vengono riportati i cambiamenti di questi orizzonti del suolo in una pecceta alpina, in base all’altitudine, all’età degli alberi, alla presenza di un’estesa landa di ericacee (mirtilli e/o rododendri), o al tipo di roccia sulla quale tale popolamento cresce. Tale cambiamento si spiega con le migrazioni della pedofauna che dipendono da variazioni causate dagli alberi nel suolo. Gli alberi vecchi preparano il suolo per la nuova generazione di alberi, dialogando con la fauna del suolo. Alla fine del ciclo, questa fauna trasforma il suolo in modo da renderlo più propizio alla crescita delle nuove piantine. Nel mezzo del ciclo della foresta, invece, il suolo si impoverisce perché il sistema ha trasferito le sue risorse nella massa degli alberi. Invecchiando e morendo gli alberi ritornano quest’energia al suolo, perché possa essere reinvestita in un nuovo sistema forestale.
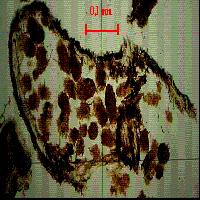
Fig. 3 - Sopra: Cambiamento dell’humipedon (humus forestale) in peccete della Savoia francese, riassunto da Bernier & Ponge ([3]). Sulla sinistra una situazione particolare dove una landa di ericacee rimpiazza la foresta grazie a un meccanismo allelopatico con cui queste piante impediscono la germinazione dei semi di picea. Sotto: osservazioni dell’humipedon in ambiente di pecceta alpina (a 1200 m s.l.m.) con alberi attaccati dagli scolitidi dopo l’evento catastrofico di Vaia (studio in corso). Si noti come soprassuolo e suolo cambino insieme.
Le quantità totali di carbonio organico non sono molto diverse lungo il ciclo, ma cambia la qualità della sostanza organica in cui si trova il carbonio nel suolo e la sua disponibilità. All’inizio del ciclo si tratta di molecole che si trovano agganciate alla parte minerale in aggregati del suolo prodotti dai lombrichi (orizzonte A). I ponti che esse formano con la parte minerale del suolo sono a base di cationi e di acqua, che corrispondono a riserve accessibili alle radici delle piante. Nella parte centrale del ciclo le molecole umiche sono invece intrappolate nei residui vegetali che rimangono indecomposti negli strati organici (OL, OF ed OH) accumulati all’ombra della chioma, dove la temperatura è più bassa e il suolo ha perso la pedofauna che si nutriva di questa lettiera. Una fauna che riesce a integrare questi resti nel suolo minerale ritorna nel profilo verso la fine del ciclo forestale, quando si creano aperture e condizioni edafiche più favorevoli, e il sistema di humus ritorna ad essere quello dell’inizio del ciclo, con un orizzonte A più propizio alla rinnovazione. Con l’altitudine e il tipo di roccia cambiano i sistemi e le forme di humus. Anche il legno morto della foresta vetusta è molto importante poiché viene trasformato dai funghi in sistemi di humus chiamati “Ligno” ([59]), diventando un substrato in cui le giovani piantine trovano una fonte preziosa di nutrienti e di acqua ([37]).
In ambienti relativamente temperati e umidi sono le migrazioni dei lombrichi in seguito ai cambiamenti che avvengono nel soprassuolo a decidere del momento in cui la sostanza organica viene integrata nel suolo minerale ([58]). In ambienti più freddi e umidi, come in quelli più siccitosi e caldi, sono gli artropodi e i funghi a condizionare il funzionamento del suolo a seconda dell’età degli alberi ([4]). In una prospettiva di conservazione e protezione della foresta e della sua biodiversità, è importante lasciare invecchiare gli alberi, perché è nella foresta vetusta che il suolo ritrova la fertilità necessaria per il rinnovo della foresta ([37], [36], [23], [6]).
Alcune riflessioni sul fuoco prescritto
Con il riscaldamento climatico le foreste bruciano più facilmente. Il fuoco prescritto è meno impattante del fuoco non prescritto ([53], [54]). In particolare il fuoco prescritto non ha grosse conseguenze negative sulla biodiversità degli ecosistemi erbacei. Mancano evidenze di lungo periodo (> 10 anni) per sostenere statisticamente lo stesso principio in foresta ([15]). A meno che la foresta non sia abitata da specie adattate al fuoco, le quali possono trarre profitto da questa situazione, negli altri casi il fuoco rappresenta una perdita momentanea di biodiversità e una diminuzione dell’energia presente sul sito per unità di superficie. L’erba, la lettiere, la ramaglia e gli arbusti bruciati dal fuoco sono una perdita importante per l’ecosistema (animali che vivono di queste risorse, perdita di habitat, uova, giovani generazioni). Togliendo la materia prima all’incendio, il fuoco prescritto risolve il problema per un breve periodo. La sostanza organica messa all’aria con l’aratura si ossidava, liberava i suoi elementi minerali e le piante producevano di più. Ora sappiamo che una volta finita la riserva organica del suolo, fu necessario fertilizzare chimicamente ed irrigare. Il fuoco è un’ossidazione con fiamma, con una parte dell’energia chimica liberata in forma di onde elettromagnetiche. Rimane sul posto la cenere, fatta di minerali disponibili che possono stimolare la crescita dell’ecosistema. Come per i campi agricoli, il bilancio complessivo è negativo per il sistema (Fig. 4). Da un lato l’agricoltura intensiva ha permesso di produrre cibo a costi accessibili con il conseguente benessere e sviluppo della popolazione umana. Dall’altro non eravamo coscienti che quest’agricoltura implicava una perdita importante di sostanza organica nel suolo ([35]). Ora l’agricoltura è diventata più rispettosa dell’ambiente. I fuochi prescritti sono pratiche ancestrali. Usiamoli solo in casi di estrema urgenza e pericolosità per l’ecosistema. Anche se alcuni autori dimostrano che sono poco impattanti ([14], [53]), semplici osservazioni dirette possono rivelare conseguenze importanti sul funzionamento del suolo. Nell’area descritta in Fig. 4, c’erano cipressi ancora intatti (prima del fuoco) e altri invece con il suolo bruciato ai loro piedi (dopo il fuoco). Quel suolo bruciato non può più funzionare come prima. L’orizzonte OH composto di aggregati organo-minerali, corrispondenti essenzialmente a deiezioni di artropodi, è diventato uno strato compatto di fuliggine. Il fuoco ha anche bruciato la sostanza organica che si trovava nel primo centimetro dell’orizzonte A.
Fig. 4 - Sopra: dettaglio dei particolari del suolo sotto un cespo di graminacea prima e dopo il passaggio di un fuoco prescritto. Le parti scure (OH) diventano nere e dure dopo il fuoco; le radici chiare scompaiono; l’orizzonte A diventa più scuro in superficie sul primo centimetro circa. Sotto: suolo prima e dopo il fuoco prescritto, lungo un filare di cipressi che limita il campo bruciato qui sopra. Quello che si vede è che il suolo dopo il fuoco è molto diverso dal punto di vista funzionale, rispetto al suolo non bruciato. C’era più sostanza organica sotto i cipressi e il fuoco ha cambiato la struttura anche dell’orizzonte A, che da grumosa e viva diventa compatta e amorfa.
Applicati alle aree estremamente fragili - boschi disequilibrati nella struttura e nella composizione specifica, con segni evidenti di malfunzionamento come coetaneità e monospecificità del popolamento arboreo, mancanza di sottobosco arbustivo, tagli non conformi alla selvicoltura naturalistica e suolo con segni di erosione - i fuochi prescritti permettono di aspettare le vere misure efficaci contro il fuoco: pompieri, mezzi antincendio, controlli dallo spazio, telecamere, sensori. Le cause dei fuochi in Europa sono di origine antropica nel 96-98% dei casi ([44], [1]). Il rimedio non va cercato nell’ambiente, ma nella testa degli umani, e nel monitoraggio, anche del tappeto erbaceo ([26]), per prevenire il fuoco ([57]) e per curare dopo il fuoco ([48]).
Come proteggere le foreste tropicali
Per ragioni legate alla nutrizione e alle esigenze contingenti dell’umanità, più della metà dell’area che un tempo apparteneva alla foresta è stata trasformata in campi coltivabili e zone urbanizzate ([17]). Circa 4 degli 8 miliardi di ettari rimangono foresta. Di questi, un quarto (circa 1 miliardo di ettari) è ancora nello stato naturale di foresta primaria, cioè una foresta che ha raggiunto un’età molto avanzata senza aver subito grandi perturbazioni da parte delle attività umane; il 20% di questa foresta primaria può essere classificato come “Paesaggio forestale intatto”, un’estensione di area forestale di almeno 500 km2 senza azioni umane remote ([41]). Circa la metà della biodiversità del pianeta si trova nelle foreste tropicali. Man mano che la loro superficie decresce, diminuisce anche la biodiversità. Le perdite complessive di biodiversità stimate al di fuori delle foreste nel periodo compreso tra il 1970 e il 2022 variano dal 18% al 94%, a seconda della regione del pianeta ([25]).
Le foreste hanno un impatto importante sul clima e funzionano come “pompe biotiche”, generando e alimentando dei “fiumi volanti” ([29]), la cui esistenza è stata dimostrata per le foreste amazzoniche e del Congo ([46], [21]).
Il fabbisogno umano di legname aumenterà del 37% da qui al 2050 ([18]).
Nel 2021 abbiamo perso altri 3.75 milioni di ettari di foreste primarie ([56]). Anche le foreste primarie sono influenzate dai cambiamenti climatici ma rimangono, tuttavia, foreste da cui non viene prelevato nulla, foreste che completano il loro ciclo investendo tutte le loro parti morte nel suolo. È forse giunto il momento di decidere a livello mondiale di impedire lo sfruttamento diretto di una percentuale di queste foreste, almeno l’attuale 20% di foreste primarie chiamate “Intact Forest Landscape”, come se queste fossero un bene inviolabile del Pianeta. Per queste foreste “intatte”, si potrebbe stabilire un reddito da versare ai Paesi in cui queste foreste crescono, al fine di preservarle come bene dell’umanità.
Alla luce dell’importanza delle foreste per la biodiversità, è probabile che se il pianeta fosse coperto da foreste su una buona parte del loro areale potenziale, queste sarebbero in grado di agire sul clima del pianeta per riportarlo nella situazione in cui era prima della crisi. Le foreste potrebbero essere l’unico mezzo sicuro che abbiamo: volendolo davvero, potremmo ricostruirle tutte in 100 anni, non proprio funzionanti al 100% ma quasi; l’altra risposta “sicura”, al giorno d’oggi, sono le centrali nucleari, che lasciano molto perplessi, per via dei costi, delle conseguenze sui corsi d’acqua che servono per raffreddarle, delle difficoltà nello smantellamento e dei rischi per la salute che comportano) per fronteggiare il guaio climatico in cui siamo finiti.
La verità si trova sempre nel futuro
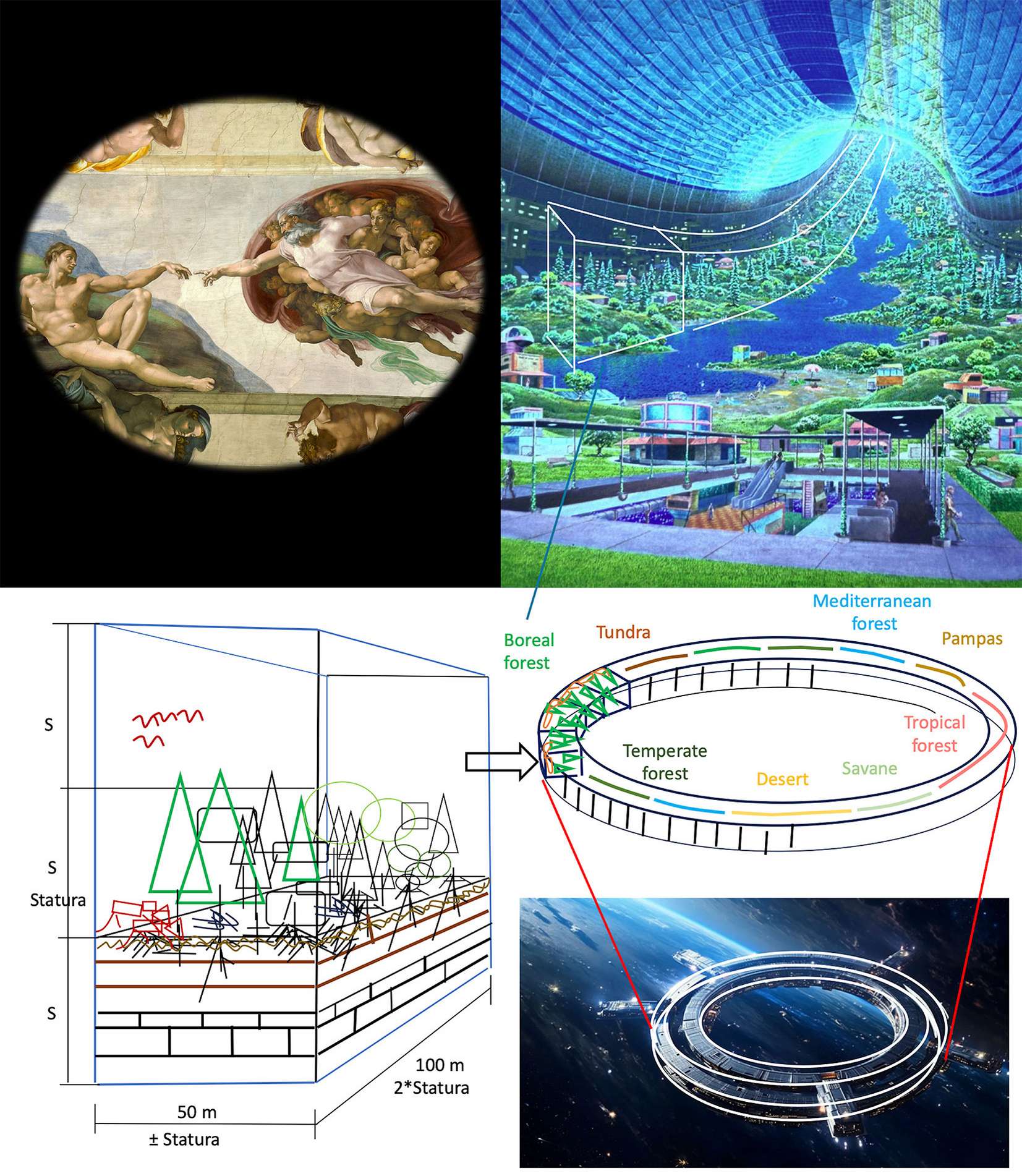
Le cose che si imparano da piccoli non si dimenticano mai, nemmeno quelle sbagliate. È su queste ultime che bisogna lavorare. Tornando al titolo dell’articolo e a una visione futurista, le foreste potrebbero finire su piattaforme spaziali che lasceranno il nostro sistema solare per andare altrove. Uno dei più famosi progetti teorici di habitat spaziali ideato dalla NASA negli anni ÂÂ70 si chiamava Stanford Torus. Si trattava di una struttura ad anello con un diametro di 1.8 km che ruotava su se stessa per creare gravità artificiale grazie alla forza centrifuga. L’interno del torus poteva ospitare foreste, fattorie, corsi d’acqua e insediamenti umani, in un ambiente che ricordava la Terra, con cicli ecologici autosufficienti (Fig. 5). Questi progetti partivano dal principio giusto che i viventi sono interconnessi e co-evolvono in uno stesso ambiente. Per divertimento proponiamo un progetto simile a quello riportato in Fig. 5ma con foreste vicine a quelle vere. La dimensione dellla “cella” proposta tiene conto della “statura” della foresta (un parametro ecologico collegato alla potenzialità dell’ambiente) ed ha misure compatibili con la gestione forestale.
Fig. 5 - Sopra: a fianco della Creazione, lo Stanford Torus di ([12]). Sotto: la rielaborazione di un torus tenendo conto della necessità che abbiamo di coevolvere con i biomi del pianeta per mantenere alta ed equilibrata la biodiversità, considerando anche il parametro della statura (S) per la dimensione delle celle forestali. Potrebbero essere moduli costruiti uno ad uno nello spazio, a formare un anello il più grande possibile, dinamico e vivo.
Purtroppo, non siamo ancora in grado di progettare delle piattaforme che siano abbastanza grandi da contenere biodiversità simile a quella terrestre e che permetta di sopravvivere nel tempo in serre separate dal pianeta. Non sappiamo quanto è grande questa minima biodiversità del pianeta compatibile con la specie Homo sapiens. Siamo “pianeta”, non è vero che possiamo tranquillamente andarcene dalla Terra, e che è solo una questione tecnologica. In questi giorni è stato dato il premio Nobel per la Chimica a Baker, Hassabis e Jumper perché hanno compiuto un enorme passo vanti nella conoscenza dei meccanismi di formazione delle proteine. La strada è entusiasmante, ma quali sono le proteine che servono a noi per vivere in buona salute senza il resto dei viventi? Abbiamo bisogno di tempo.
A questo punto viene addirittura in mente una soluzione ancora più futurista: muoverci con tutto il pianeta. Funzionerebbe. Se è vero che siamo solo una parte non indipendente del pianeta, viaggiare con celle di foreste potrebbe non bastare. Curare e convivere con gli organismi e gli ambienti del nostro pianeta diventerebbe obbligatorio. Oggi sembra impossibile muovere tutto il sistema solare nella galassia. Ma un giorno sapremo gestire i gravitoni come facciamo oggi con i fotoni. Nel frattempo, potremmo concentrare gli sforzi sulla ristrutturazione delle foreste e delle società umane. Il Papa si batte come può, tutte le domeniche ai potenti del mondo: “Fermate le guerre, per l’amor del Cielo!”. Per fortuna esiste anche Don Ciotti che con “Libera” sta perfino vincendo la mafia. Cinquant’anni fa uno zio prete mi portò in Piazza San Pietro: “Urca che grande, e che bel disegno, tutte quelle colonne in cerchio!”. “Quella lì in fondo è la Basilica di San Pietro, la testa di Dio, le file di colonne sono invece le braccia di Dio”. “Wouu, che bella idea, zio!”. “Michelangelo! Non vi insegnano proprio più niente a scuola. Vieni ti mostro un’altra cosa”. Davanti alla porta mi ordinò di chiudere gli occhi, poi mi prese per mano e mi condusse in mezzo alla Cappella Sistina: “Adesso guarda”. Era buia all’inizio, poi vidi apparire qualche turista (allora erano rari) e rimasi di stucco puntando alle pareti: corpi, teste, occhi, diavoli, e colori. Dappertutto, anche sul soffitto. “È talmente piena e fuori di testa… che fa paura” - dissi. “Per forza”, rispose a bassa voce, “è il Giudizio Universale. Dove sono Dio e Adamo? Mhhhh, là in fondo, che si toccano col dito. Che cosa sta dicendo Dio a Adamo? Una cosa importante”. “Non so, forse: svegliati!” - che era quello che diceva mia madre quando si accorgeva che non l’ascoltavo. Sorrise. “Gli sta dicendo: Su cole rece, se sbagli, paghi!”.
Conclusione generale sulle “Foreste nel Futuro”
Trasformare aree povere di carbonio organico in foreste ricche di biodiversità è un’impresa difficile. D’altro canto, dobbiamo ammettere che lo spettro della riduzione drastica del numero di umani non è facilepiù facile da accettare.
L’ipotesi Gaia, proposta da James Lovelock e Lynn Margulis già negli anni ’70, suggerisce che la biosfera, ovvero l’insieme di tutti gli organismi viventi, interagisca attivamente con l’atmosfera, le rocce, i sedimenti e le acque per mantenere condizioni ambientali favorevoli alla vita stessa. Studi più recenti hanno confermato che i microrganismi del suolo, le piante, gli oceani e le foreste influenzano profondamente i cicli biogeochimici di elementi chiave come carbonio, azoto, zolfo, regolando di fatto la composizione dell’atmosfera e il clima.
Quindi, sebbene l’aumento delle emissioni antropogeniche di gas serra abbia innescato il riscaldamento globale attuale, si può sostenere che la causa radice sia il disturbo apportato dall’uomo ai delicati equilibri biogeochimici regolati dagli organismi viventi del pianeta.
Cinquant’anni fa il carbonio nell’aria in forma di CO2 era circa 200 miliardi di tonnellate più basso rispetto a quello attuale (330 ppm, rispetto agli attuali 420 ppm). Un ettaro di foresta corrisponde a 100 tonnellate di carbonio organico all’ettaro, in media. Questo vuole dire che 2 miliardi di ettari di foresta in più tirerebbero via dall’aria il carbonio che pone problemi climatici. Due miliardi di ettari sono tanti e corrispondono a metà della superficie delle foreste attuali. Ma se riuscissimo ad aumentare del 25 % la superficie forestale del pianeta, ridurremmo di metà il problema climatico. Non è impossibile, anzi, e avrebbe conseguenze molto importanti sulla biodiversità. Gli organismi viventi gestiscono effettivamente molti aspetti del sistema Terra, incluso il clima, e l’alterazione di questi cicli naturali da parte umana è alla base dei cambiamenti climatici in corso. Le foreste in particolare, attraverso i processi di fotosintesi, respirazione, evapotraspirazione e produzione di composti organici volatili, i fiumi volanti, impattano sui livelli di anidride carbonica, vapore acqueo e altri gas nell’atmosfera, modulando il clima. Il succo che esce dai libri di Darwin, Lovelock e Margulis ha questo sapore: non andremo noi nel futuro, ma eventualmente quello che il pianeta diventerà in blocco, con noi dentro, se lo rispettiamo.
Il ripristino della biodiversità forestale è probabilmente l’unica sostenibile via di uscita che abbiamo dalla grave crisi climatica in cui siamo finiti.
Ringraziamenti
Agli amanti della natura e a tutti coloro che si impegnano a gestire le foreste come se fossero una parte interattiva ed indispensabile alla vita del nostro pianeta. L’articolo è stato scritto nell’ambito del Programma Space-it up, finanziato dall’Agenzia Spaziale Italiana (ASI) e dal Ministero dell’Universityà e della Ricerca (MUR).
References
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Online | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
Online | Google Scholar
Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar