The soil seed bank of active and abandoned Quercus cerris coppice forests: results from an experimental study in Val di Cecina (Tuscany)
Forest@ - Journal of Silviculture and Forest Ecology, Volume 22, Pages 69-77 (2025)
doi: https://doi.org/10.3832/efor4917-022
Published: Oct 30, 2025 - Copyright © 2025 SISEF
Research Articles
Abstract
The soil seed bank is a key component in the dynamic processes of many terrestrial ecosystems. It consists of a reserve of viable spermatophyte seeds stored in the soil for variable periods, potentially lasting several decades. In forest environments, the seed bank serves as an important mechanism of resilience, playing a crucial role in vegetation recovery following both natural regeneration processes and disturbances. Additionally, it acts as a hidden reservoir of plant diversity, often preserving traces of past vegetation. Despite its ecological importance, many characteristics and processes of the seed bank remain poorly understood, particularly in Mediterranean forests and in relation to forest management. To help fill these knowledge gaps, we analyzed the soil seed bank of two supra-Mediterranean turkey oak-dominated forests in the Val di Cecina (central-western Tuscany), which are similar in site conditions but differ in management regimes: the former is actively managed as a coppice-with-standards, while the latter has been abandoned for over 60 years. Seed bank density and composition were assessed through a germination experiment, in which 24 soil samples (12 per management type) were placed in a greenhouse under uniform conditions of temperature, light, and humidity, promoting germination of all viable seeds. The herb layer vegetation was surveyed to compare species richness and composition with that of the seed bank. The obtained data were analyzed using statistical tests and principal component analysis (PCA) to evaluate differences in floristic structure, diversity, and ecological-functional profiles attributable to management practices. Our results show that coppicing promotes a richer and more abundant seed bank, dominated by generalist and ruderal species. In contrast, abandoned stands host a greater proportion of forest specialists and Mediterranean taxa. The presence of species lacking from the current vegetation highlights the role of the seed bank as an “ecological memory”, capable of preserving latent species and potentially crucial for ecosystem resilience. Finally, the observed floristic homogeneity among seed banks, compared to the greater variability in the standing vegetation, suggests a filtering effect driven by seed persistence, which contributes to compositional stability across different management regimes.
Keywords
Soil Seed Bank, Understory, Forest Management, Coppice-with-standards, Biodiversity, Cluster Analysis
Introduzione
La vegetazione reale delle foreste italiane è segnata da una lunga storia di utilizzazioni, le cui tracce ecologiche (legacies) sono in molti casi ancora rinvenibili ([1]). Il sistema ceduo è una forma di governo del bosco antica ([18], [6]) e tutt’oggi molto diffusa nelle regioni dell’Italia centrale ([25]). A partire dal basso medioevo e fino alla seconda metà del XX secolo, i boschi di Berignone-Tatti (Volterra, Toscana centro-occidentale) sono stati intensamente utilizzati, specialmente per la produzione di carbone o come zone idonee al pascolo arborato, comportando in molti casi situazioni di degradazione ([7]).
Con l’abbandono della ceduazione vengono ad innescarsi una serie di processi dinamici di rinaturalizzazione di grande interesse ecologico, in particolare se si considera l’evoluzione relativamente recente di questi soprassuoli e la loro struttura profondamente alterata ([14], [13], [55]). La capacità della vegetazione forestale di rigenerarsi in seguito a un disturbo dipende anche dalla conservazione di specie caratteristiche, che possono risultare temporaneamente escluse dalla comunità e il cui ritorno può avvenire attraverso fenomeni di disseminazione da aree contigue e/o grazie alla presenza in loco di propaguli vitali ([67], [26], [27], [24]).
Una componente poco conosciuta, ma strettamente coinvolta nei processi di rigenerazione e conservazione della vegetazione ([32]), specialmente erbacea, è la soil seed bank, ovvero la banca dei semi nel suolo (da qui in poi, seed bank), che consiste in una riserva di semi vitali di spermatofite, immagazzinati nel suolo per un lasso di tempo variabile, fino al momento della loro germinazione o morte ([57]). Attraverso lo studio della seed bank è possibile ampliare le conoscenze sul funzionamento delle comunità vegetali, anche in relazione alla storia dei consueti tagli forestali cui sono state soggette ([10], [45], [31]), integrando quanto già desumibile dalle indagini floristico-vegetazionali ([47]).
In molti ecosistemi terrestri, la seed bank del suolo rappresenta una componente ecosistemica fondamentale per il mantenimento del dinamismo della vegetazione, la cui importanza varia in base alle caratteristiche ecologiche e funzionali dei semi immagazzinati, nonché ai meccanismi che ne regolano il reclutamento ([48]). La coesistenza diacronica (ossia nello stesso spazio, ma in momenti diversi) di specie con esigenze ecologiche complementari ([17]) si traduce in un incremento della ricchezza specifica complessiva delle comunità vegetali ([46]), contribuendo al mantenimento della potenzialità rigenerativa della vegetazione, anche al variare di fattori ecologici limitanti. In questo senso, la banca semi rappresenta una forma di resilienza in situ, che permette alla vegetazione di rispondere a disturbi ed eventi distruttivi attraverso meccanismi di rigenerazione post-perturbativa ([29], [53]).
La seed bank viene convenzionalmente suddivisa in base alla persistenza dei semi che la compongono, ovvero alla loro capacità di rimanere vitali senza germinare, fino a che le condizioni ambientali non diventano favorevoli ([62]). La seed bank transiente è composta da semi che germinano entro un anno dal momento della loro dispersione (si escludono quelli recalcitranti), mentre la seed bank persistente comprende i semi in grado di rimanere vitali nel suolo per più di un anno. La persistenza dei semi è controllata dai fattori ambientali coinvolti nei processi di germinazione e può dipendere da specifici tratti adattativi, sia fisiologici (p.es., dormienza/quiescenza) che morfologici ([63], [4], [34]), ma anche da fattori stocastici come la profondità di interramento ([56], [37]).
Ogni seed bank è caratterizzata da una densità (numero di semi vitali per unità di superficie) e composizione specifica proprie, che variano lungo gradienti ambientali e temporali ([58], [52], [26]), anche in base agli attributi delle rispettive comunità e dei loro habitat ([12], [34], [35], [61]). Densità e composizione possono essere stimate valutando quantità e qualità dei semi in grado di germinare nel corso di almeno un anno in condizioni controllate ([57], [64], [50], [5]).
Densità, ricchezza specifica e similarità composizionale con la vegetazione realizzata sono mediamente basse nei suoli delle formazioni forestali più evolute ([21], [11], [12], [52]) e vengono influenzate dall’estensione e dalla frequenza dei disturbi, siano essi di origine naturale ([42]) o artificiale ([19], [58], [41]). La formazione di aperture avvantaggia specie ruderali che richiedono calore (o fluttuazioni di temperatura) ed un sufficiente apporto luminoso per germinare ([8]). Disturbi troppo frequenti o estesi possono invece sfavorire le specie nemorali, che sono meno competitive, hanno più limitazioni nella dispersione dei semi e semi meno persistenti ([11]).
Questo studio si propone di analizzare le caratteristiche strutturali (densità, composizione, ricchezza specifica) e funzionali (ritmi di germinazione, diversità, profili ecologici, similarità con la vegetazione realizzata) della seed bank in alcune cerrete supra-mediterranee sottoposte a differenti regimi di gestione forestale, evidenziando le pressioni selettive esercitate dal mantenimento del governo ceduo matricinato e il suo impatto sulla diversità floristica.
Materiali e metodi
Area di studio e campionamento in campo
L’indagine si è svolta all’interno del complesso forestale di Berignone-Tatti in Alta Val di Cecina (Volterra, Toscana centro-occidentale), in un’area di cerreta supramediterranea della serie preappenninica tirrenica acidofila del cerro (Erico arboreae-Querco cerridis sigmetum, [9]) relativamente omogenea per fattori stazionali ed in parte inclusa in proprietà privata. Le due porzioni scelte differiscono esclusivamente per la forma di governo adottata nel corso degli ultimi 60 anni. Nella parte privata si è mantenuta la gestione a ceduo (oggi matricinato), mentre nella parte pubblica, la quale rientra nel Complesso Forestale Regionale “Macchia di Berignone”, la gestione attiva dei soprassuoli è stata intenzionalmente interrotta alla fine degli anni ’70, lasciando il bosco al suo dinamismo naturale e quindi favorendone la conversione spontanea ad una struttura d’alto fusto. Per rappresentare queste due situazioni gestionali sono stati selezionati sei siti di campionamento rappresentativi (da qui in poi “plots”), tre nel ceduo invecchiato, tre nel ceduo matricinato a regime. Per quest’ultimo, il taglio più recente risale all’inverno 2016-2017, quando furono rilasciate circa 180 matricine ha-1. I principali parametri strutturali e stazionali dei sei plots, sono riportati in Tab. 1.
Tab. 1 - Parametri stazionali descrittivi per i sei plot scelti. Area basimetrica e numero di matricine ad ettaro sono stati stimate a partire dal cavallettamento dei diametri in aree di saggio circolari con raggio di 10 metri posizionate al centro di ogni plot. Le coordinate geografiche (Lat N, Lat E) sono riferite ai centri di ogni plot nel sistema di riferimento geodetico mondiale WGS84.
| Parametri Stazionali | Ceduo matricinato | Ceduo invecchiato in conversione spontanea |
||||
|---|---|---|---|---|---|---|
| CED1 | CED2 | CED3 | INV1 | INV2 | INV3 | |
| Lat N | 43.345597 | 43.344689 | 43.345146 | 43.35157 | 43.34605 | 43.34767 |
| Long E | 10.98259 | 10.982349 | 10.982825 | 10.97823 | 10.95455 | 10.96409 |
| Altitudine (m s.l.m.) | 482 | 470 | 480 | 415 | 505 | 534 |
| Esposizione | N | SE | W | NE | N | NE |
| Pendenza (°) | 3 | 3 | 10 | 15 | 3 | 3 |
| Età delle matricine (anni) | ca. 8 | ca. 8 | ca. 8 | ca. 60 | ca. 60 | ca. 60 |
| Area basimetrica (m2 ha-1) | 15.4 | 8.5 | 16.7 | 19.8 | 32.7 | 35.3 |
| Densità di matricine (n ha-1) | 180 | 180 | 180 | N.D. | N.D. | N.D. |
All’interno di ogni plot sono stati delimitati 4 quadrati di 5 × 5 m (25 m2) per un totale di 24 quadrati (12 per ciascuna tipologia di governo), dove nel gennaio-febbraio 2024 si è svolto il campionamento del suolo. Lungo i lati di ciascun quadrato sono stati prelevati 24 campioni cilindrici di suolo di 5 cm di profondità e 4 cm di diametro (escludendo la lettiera), per un volume totale di 1.5 dm3 per quadrato (18 dm3 per ciascuna tipologia gestionale). I campioni prelevati per ciascun quadrato sono stati mescolati per ottenere 12 campioni per ognuna delle tipologie gestionali. Nel maggio 2024, negli stessi quadrati, è stato condotto il rilevamento totale della vegetazione con il metodo fitosociologico di Braun-Blanquet.
Esperimento di germinazione in serra
Una volta setacciati in laboratorio, i campioni di suolo sono stati suddivisi in due porzioni di uguale volume. Il suolo di ogni replica è stato disposto a formare uno strato di 1 cm di spessore all’interno di contenitori di plastica (37 × 25 × 17 cm, da qui in poi “box”) precedentemente riempiti con circa 11 dm3 di terriccio universale sterile. Per prevenire marciumi e migliorare il drenaggio, il fondo di ogni box è stato dotato di fori e ricoperto con argilla espansa. Nel gennaio 2024 i box sono stati posti in serra non climatizzata chiusa e mantenuti in completo isolamento (per evitare l’introduzione di semi dall’esterno) fino a settembre 2024, con irrigazione quotidiana automatizzata. Dal 10 febbraio al 27 settembre 2024 (circa 9 mesi), si sono registrati con frequenza settimanale il numero di semenzali germinati all’interno di ogni box e l’identità specifica dei semenzali via via emersi.
Analisi dati
A partire dai dati raccolti tramite il conteggio dei semenzali sono state costruite sei curve di germinazione, che riportano la variazione nel tempo del numero cumulato di semenzali emersi. Per ogni replica è stata calcolata la densità media della seed bank per unità di superficie (numero di semenzali m-2). Le differenze tra ceduo a regime e ceduo invecchiato sono state valutate mediante test di Mann-Whitney.
A partire dalle matrici di presenza/assenza e di abbondanza delle specie rilevate, sono state calcolate la ricchezza specifica, la similarità floristica espressa mediante indice di similarità di Sørensen ([60]) e la densità media di specie per box, data dal rapporto tra numero il numero di specie riconosciute e la superficie di ogni box (0.07 m2). Le differenze tra ceduo a regime e ceduo invecchiato per quest’ultimo parametro sono state valutate attraverso t-test. La diversità tassonomica della seed bank è stata calcolata, per ogni plot, attraverso l’indice di Shannon ([59]) ponderato per il numero di individui di ogni specie e normalizzato con il numero di individui totali rilevati nel box.
Per ogni specie identificata è stata svolta una profilazione ecologico-funzionale, definendo nome scientifico aggiornato ([23]), famiglia di appartenenza, forma biologica di Raunkiaer, corotipo ([43]), valori degli indici ecologici di Ellenberg revisionati per la flora italiana ([44]) e categoria di affinità per l’ambiente forestale di appartenenza della specie, secondo la recente classificazione di Heinken et al. ([30]). Per le specie mancanti, la categoria di affinità forestale è stata assegnata in base a informazioni ottenute da flore italiane, in particolare Pignatti et al. ([43]) ed Arrigoni ([2]), e grazie a conoscenze personali del gruppo di ricerca del Plant-Dive Lab.
Per ogni quadrato è stata calcolata la frequenza relativa di ogni forma biologica (spettro biologico) rapportando il numero di specie appartenenti ad ogni categoria con il numero totale di specie emerse nel quadrato. I valori ottenuti sono serviti a calcolare l’abbondanza media percentuale delle diverse forme biologiche nelle seed bank del ceduo a regime e di quello invecchiato.
I valori ricavati per ognuno dei sei indici ecologici di Ellenberg ([44]), una volta normalizzati, sono serviti alla costruzione di due ecogrammi ([65]) con cui è stato possibile confrontare gli spazi sinecologici medi delle comunità rilevate per ognuna delle due situazioni gestionali, secondo il livello medio di adattamento delle specie a diversi fattori ambientali. La similarità tra gli spazi ecologici dei diversi gruppi di specie è stata valutata qualitativamente tramite test di Mann-Whitney.
Per confrontare le due seed bank, è stata eseguita un’analisi delle componenti principali (Principal Component Analysis, PCA) sulla matrice di varianza-covarianza ottenuta dai dati relativi al numero di semenzali emersi durante l’esperimento di germinazione. Le specie con un coefficiente di correlazione > 0.6 con almeno una delle prime due componenti principali sono state selezionate per costruire una matrice di abbondanza “ridotta”. Su questa matrice è stata condotta una seconda PCA, da cui è stato infine ricavato un grafico biplot utile a evidenziare analogie e differenze composizionali tra i campioni di seed bank rilevati all’interno dei singoli quadrati. Per il confronto tra seed bank e vegetazione realizzata, data la diversa natura delle metriche di abbondanza impiegate (numero di semenzali per la seed bank, copertura percentuale per la vegetazione realizzata), l’ordinamento è stato effettuato utilizzando le matrici di presenza/assenza.
Risultati
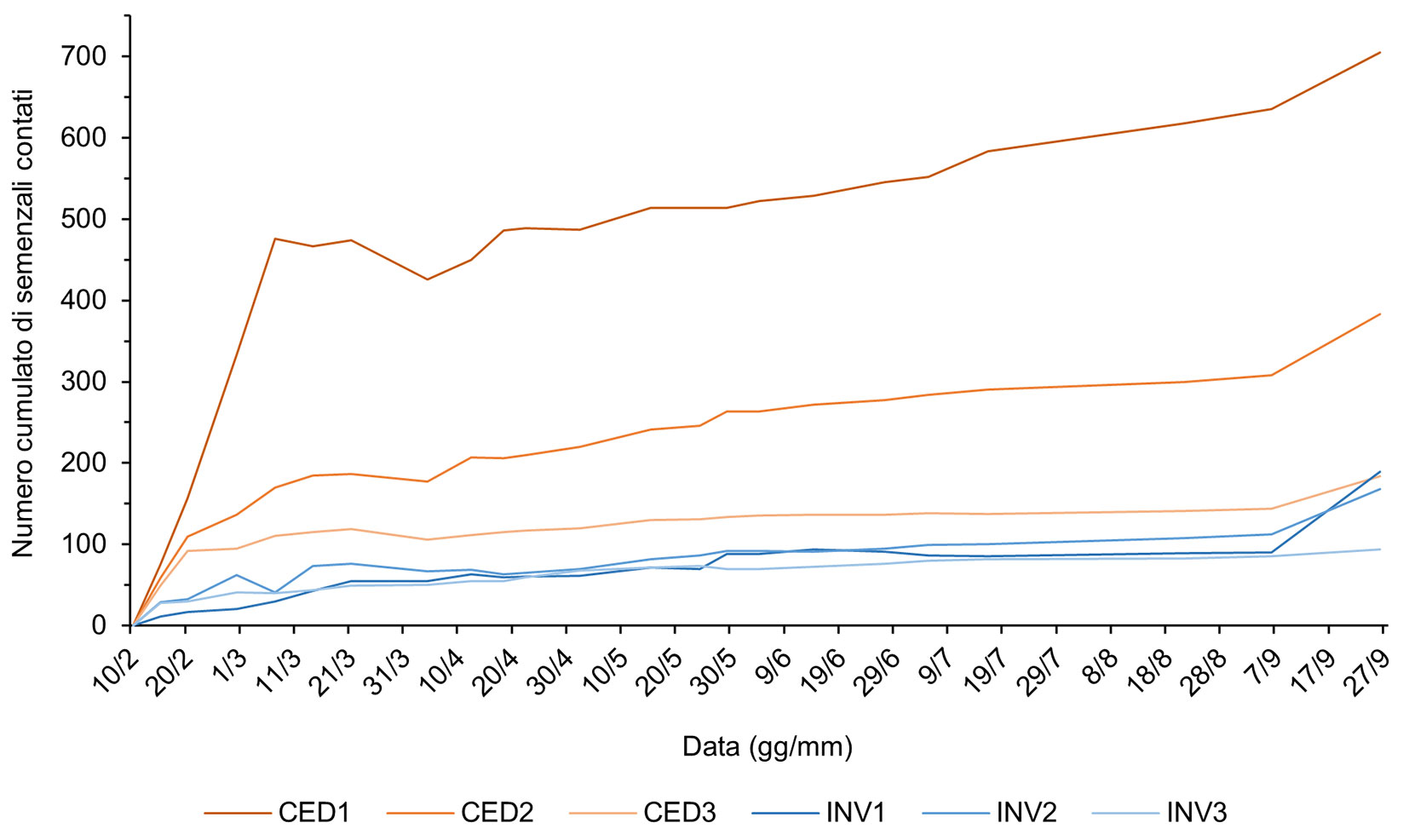
Nel corso dei 9 mesi di esperimento, sono germinati un totale di 1460 semenzali dalla seed bank del ceduo a regime e 574 da quella del ceduo invecchiato. L’abbondanza di semenzali rilevata nel ceduo utilizzato è rimasta superiore rispetto al ceduo invecchiato per quasi tutta la durata dell’esperimento (Fig. 1).
Fig. 1 - Curve di germinazione riportanti il numero cumulato di semenzali contati nel corso dell’esperimento in serra per ogni plot (CED: ceduo a regime; INV: ceduo invecchiato).
La densità di semenzali per unità di superficie è significativamente superiore (p<0.001) nel ceduo utilizzato rispetto a quello invecchiato (811 ± 772 vs. 319 ± 233 semenzali m-2, rispettivamente), soprattutto grazie al contributo di Erigeron canadensis L. (303 semenzali su 1085, pari al 27.9% delle plantule identificate), Juncus bufonius L. (213/1085 = 20%), Erica arborea L. (147/1085 = 14%), Oxalis corniculata L. (69/1085 = 6%), Cerastium glomeratum Thuill. e Veronica officinalis L. (entrambe con 41/1085 semenzali = 4%). Per quanto riguarda il ceduo invecchiato, il maggior numero di semenzali germinati è risultato appartenere a E. arborea (92/287 = 31%), seguita anche in questo caso da J. bufonius (23/287 = 8%), e quindi da Moehringia pentandra J. Gay (sempre 23/287 = 8%), Cardamine hirsuta L. (18/287 = 6%), O. corniculata (13/287 = 5%), Luzula forsteri (Sm.) Dc. e Umbilicus rupestris (Salisb.) Dandy (ambedue con 10/287 semenzali = 3%).
La seed bank del ceduo utilizzato è risultata più diversificata dal punto di vista tassonomico, con 60 specie appartenenti a 24 famiglie, contro 39 specie in 19 famiglie nel ceduo invecchiato.
L’indice di Shannon medio per plot è risultato 2.29 ± 0.27 nel ceduo invecchiato e 2.09 ± 0.7 nel ceduo utilizzato, senza differenze statisticamente significative.
Per il ceduo a regime è emersa una proporzione leggermente superiore di specie avventizie naturalizzate (3% vs. 2% nel ceduo invecchiato) e specie ad ampia distribuzione (29% vs. 26%), mentre sono risultate meno rappresentate le specie mediterranee (22% vs. 28%) e quelle europee (24% vs. 26%). Per entrambe le forme di governo l’unica presenza endemica è costituita da Digitalis micrantha (Plantaginaceae), più abbondante nel ceduo invecchiato (3%) che in quello a regime (2%).
La seed bank del ceduo utilizzato presenta un corredo di specie mediamente associate ad ambienti più luminosi, umidi, ricchi di nutrienti e caratterizzati da condizioni di continentalità più accentuate, mentre nel ceduo invecchiato le specie emerse sono mediamente più termofile e associate a suoli leggermente meno acidi. I test statistici di confronto tra le due seed bank hanno confermato l’esistenza di differenze significative tra i valori medi calcolati, per tutti i sei indici ecologici di Ellenberg (Tab. 2).
Tab. 2 - Confronto dei profili ecologici delle seed bank per le due forme di governo. Sono riportati valori medi e deviazione standard degli indici di Ellenberg, ponderati e normalizzati (L=luce; T=temperatura; C=continentalità; U=umidità; R=reazione del suolo (pH); N=nutrienti). La significatività statistica (p-value) è stata valutata con test di Mann-Whitney (*** = differenza molto significativa, p-value < 0.001; ** = differenza significativa, p-value = 0.001 - 0.01; * = differenza debolmente significativa, p-value = 0.01 - 0.05)
| Fattore ecologico | Ceduo utilizzato |
Ceduo invecchiato |
Significatività statistica |
|---|---|---|---|
| Luce | 6.4 ± 1.8 | 5.8 ± 1.8 | *** |
| Temperatura | 6.1 ± 1.3 | 7.0 ± 1.2 | *** |
| Continentalità | 4.4 ± 0.8 | 2.2 ± 0.8 | *** |
| Umidità | 4.6 ± 1.3 | 3.9 ± 1 | *** |
| Reazione del suolo (pH) | 2.4 ± 1.9 | 2.9 ± 2.1 | * (0.027) |
| Nutrienti | 3.9 ± 2.1 | 3.3 ± 2.4 | ** (0.004) |
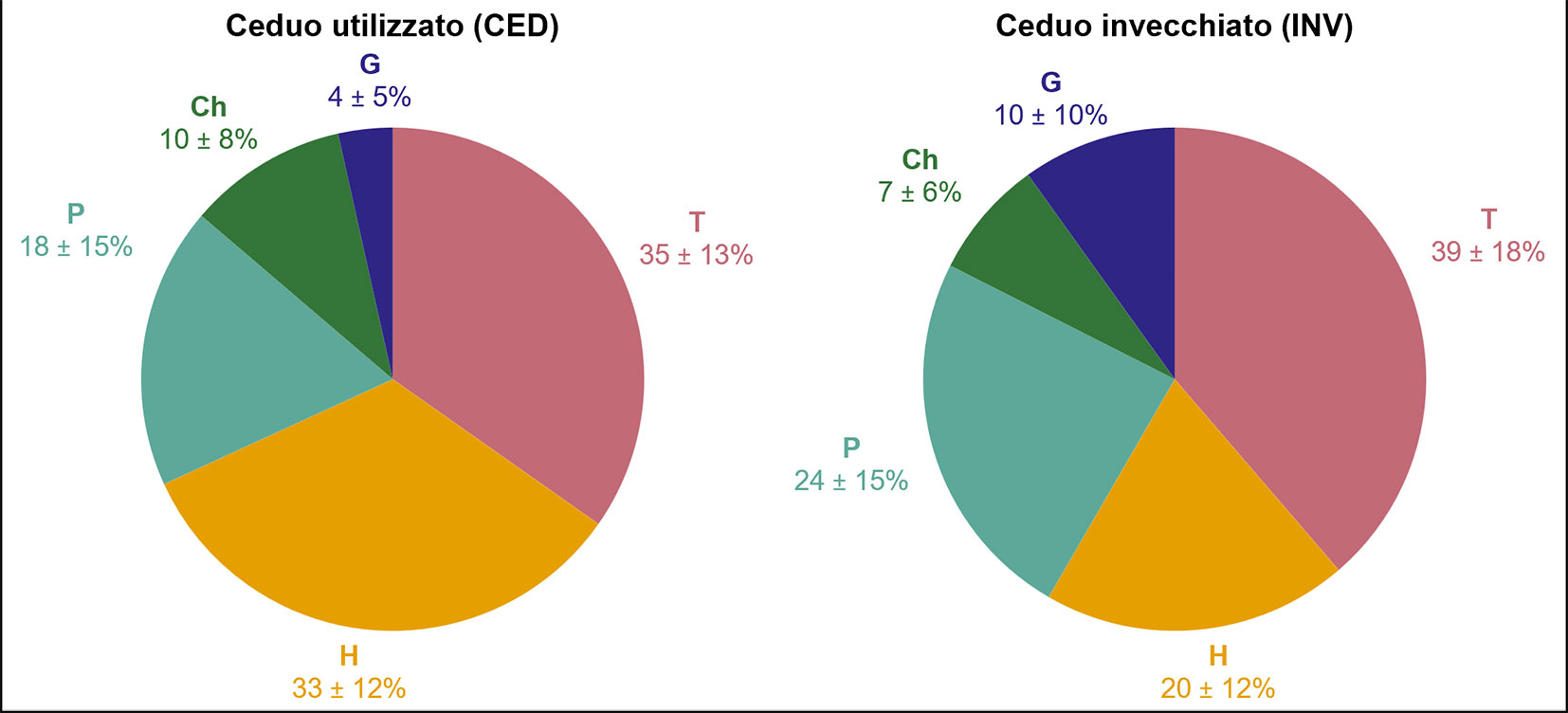
Dal confronto tra gli spettri biologici ottenuti per le due situazioni gestionali (Fig. 2), si è notata una differenza significativa tra le due situazioni gestionali per quanto riguarda l’abbondanza media di emicriptofite (specie erbacee perenni), maggiore nel ceduo utilizzato (33 ± 12% vs. 20 ± 12%) con un livello di significatività di 0.011. Per le altre forme biologiche non sono state osservate differenze statisticamente significative, ma è comunque interessante notare come nel ceduo invecchiato vi sia una maggior quota di terofite (specie erbacee annuali, 39 ± 18% vs. 35 ± 13%), fanerofite (24 ± 15% vs. 18 ± 15% - Fig. 2) e geofite (10 ± 10% vs. 4 ± 5%). Assieme alle emicriptofite, solo le camefite risultano maggiormente rappresentate nella seed bank del ceduo utilizzato (10 ± 8% vs. 7 ± 6%).
Fig. 2 - Spettri biologici medi riferiti alle due situazioni gestionali, riportanti l’abbondanza media percentuale delle diverse forme biologiche (T = terofite; H = emicriptofite; P = fanerofite e nano-fanerofite; Ch = camefite; G = geofite).
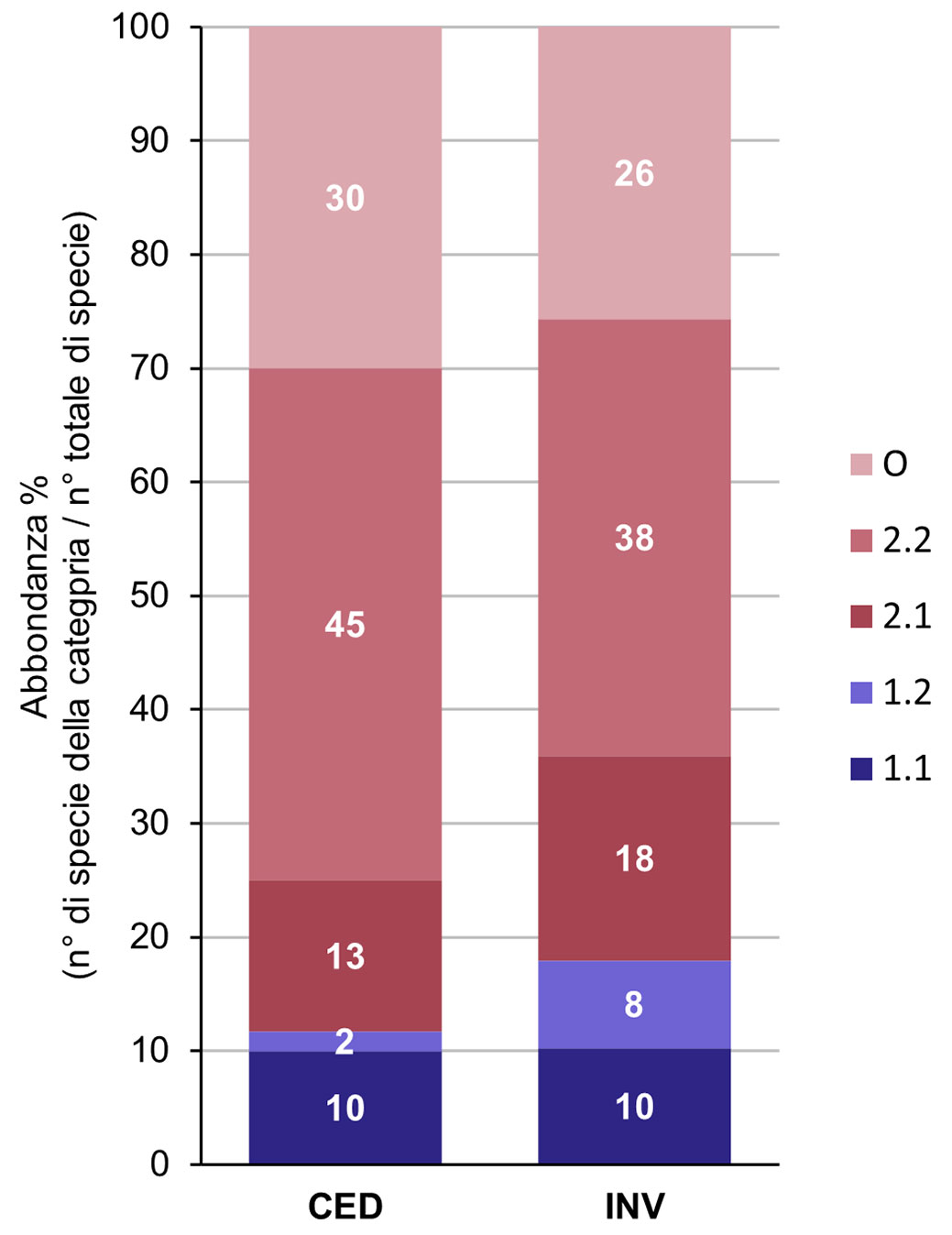
La proporzione di specialiste forestali, che comprende sia le nemorali che le specie più legate ai margini e alle aperture (categorie 1.1 e 1.2), è risultata a favore del ceduo invecchiato (18% vs. 12% - Fig. 3). Questa differenza dipende esclusivamente da specie dei margini e delle aperture, nettamente più rappresentate all’interno del ceduo invecchiato, dal momento che la proporzione di specie nemorali è risultata essere la medesima per entrambe le tipologie di gestione (10%). Diversamente, per quanto riguarda il ceduo utilizzato, si è notata una maggior proporzione di specie di spazi aperti nella seed bank del ceduo utilizzato (30% vs. 26%, Fig. 3). L’aliquota di generaliste (categorie 2.2 e 2.1) è simile per entrambe le tipologie di gestione (58% nel ceduo utilizzato vs. 56% nel ceduo invecchiato - Fig. 3).
Fig. 3 - Proporzione percentuale di specie appartenenti ai vari gruppi di affinità forestale ([30]) per le due forme di governo. Le categorie 1.1 e 1.2 indicano le specialiste forestali, mentre le categorie 2.1 e 2.2 le generaliste (1.1 = specie nemorali; 1.2 = specie dei margini e delle aperture; 2.1 = specie che possono essere trovate sia in bosco che negli spazi aperti; 2.2 = specie legate specialmente a spazi aperti, ma che possono essere trovate anche in foresta; O = specie di spazi aperti)
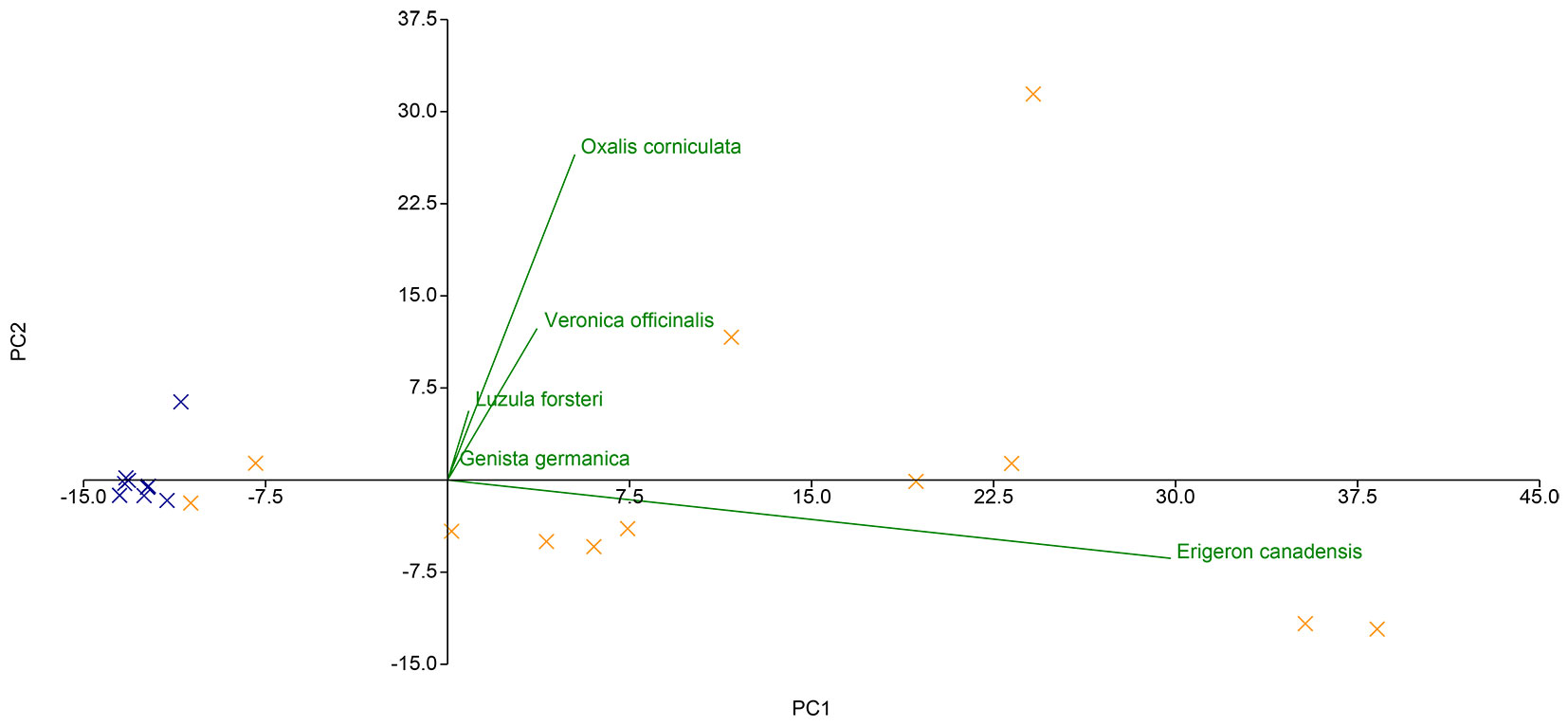
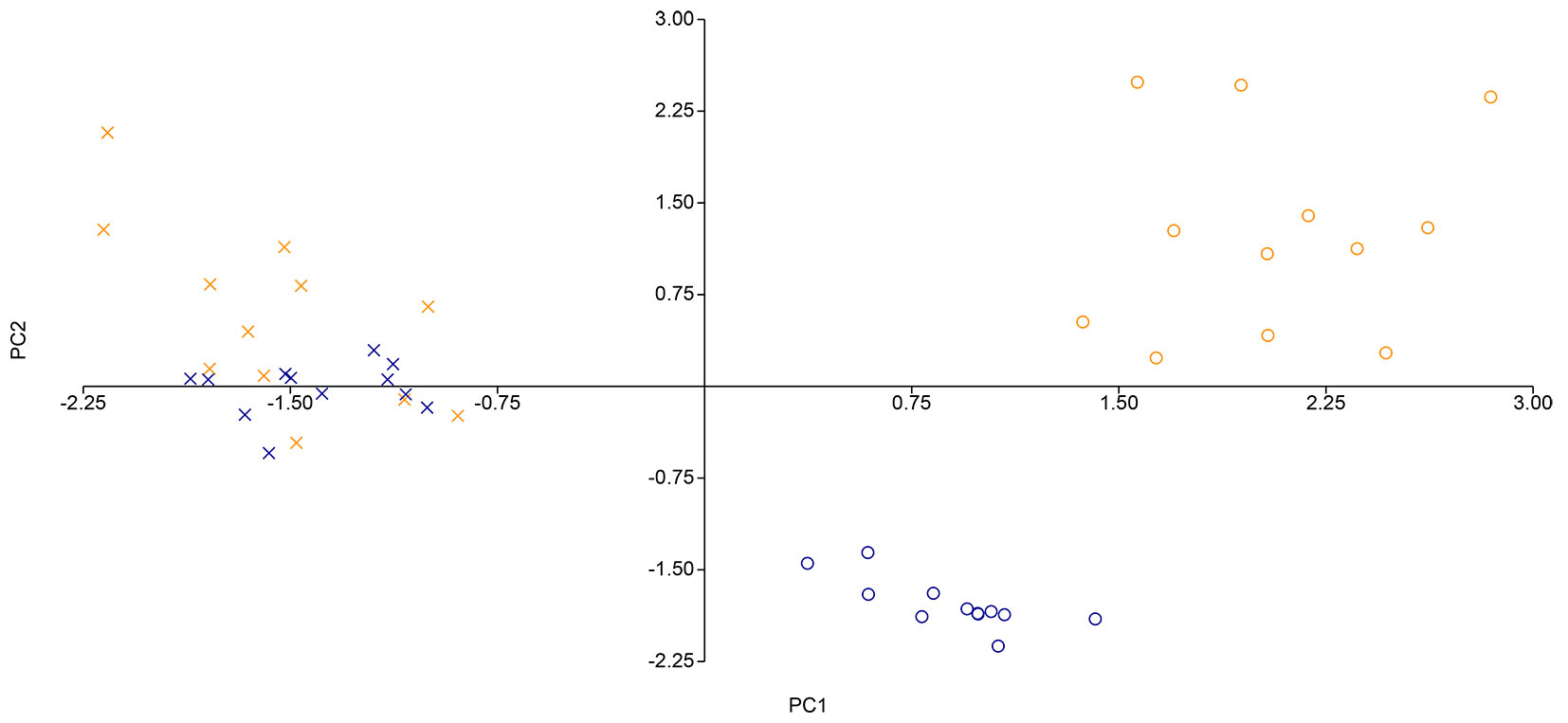
La PCA svolta sulla matrice di abbondanza delle specie rilevate nei quadrati (Fig. 4) mette in luce due gruppi distinti in base alla tipologia di gestione. Il gradiente di distribuzione dei punti varia prevalentemente lungo la prima componente principale (PC1), mentre la loro dispersione, che riflette la similarità floristica tra i campioni di comunità rilevati nei quadrati, risulta inferiore nel caso del ceduo invecchiato. Quest’ultima dipende chiaramente da due specie altamente rappresentate nella seed bank del ceduo utilizzato (O. corniculata e E. canadensis), ambedue caratterizzate da una spiccata ruderalità.
Fig. 4 - Diagramma a dispersione biplot della PCA svolta sulla matrice di abbondanza delle seed bank, ridotta e al netto del quadrato QC1_Q4 (Croci arancioni = seed bank del ceduo utilizzato; Croci blu = campioni di comunità del ceduo invecchiato). La matrice di abbondanza ridotta è stata ottenuta rimuovendo dalla matrice di abbondanza originale tutte le specie con coefficiente di correlazione < 0.6 per entrambe le componenti principali.
Nel ceduo utilizzato, la vegetazione realizzata risulta più ricca di specie (79) rispetto alla corrispondente seed bank (60). Al contrario, nel caso del ceduo invecchiato, il numero di specie della vegetazione realizzata (29) è inferiore a quello della relativa seed bank (39).
Il ceduo utilizzato è risultato avere un maggior numero di specie esclusive sia per la seed bank (19 vs. 7) che per la vegetazione realizzata (31 vs. 5). Ne consegue, per il ceduo utilizzato, una similarità floristica tra seed bank e vegetazione realizzata (indice di Sørensen) due volte superiore rispetto a quella ottenuta per il ceduo invecchiato (31% vs. 14%). Confrontando invece le due forme di governo, le seed bank sono risultate più simili tra loro rispetto alle rispettive vegetazioni realizzate (48% vs. 45%).
Dalla PCA svolta sulla matrice presenza/assenza (Fig. 5) è emersa una netta differenziazione tra le due forme di governo per quanto riguarda la composizione della vegetazione realizzata dello strato erbaceo, mentre le rispettive seed bank sono risultate meno dissimili. Allo stesso tempo, la dispersione dei punti, è risultata superiore nel ceduo utilizzato rispetto al ceduo invecchiato.
Fig. 5 - Scattergram PCA ottenuto con il dato di presenza/assenza delle specie rilevate per quadrato nella seed bank (Croci arancioni = seed bank del ceduo utilizzato; Croci blu = seed bank del ceduo invecchiato) e a livello di vegetazione realizzata dello strato erbaceo (Cerchi arancioni = vegetazione realizzata nel ceduo utilizzato; Cerchi blu = vegetazione realizzata nel ceduo invecchiato).
Discussione
Densità e composizione della seed bank
I risultati di questo studio evidenziano che la gestione forestale può aver influenzato la composizione della seed bank nei querceti misti decidui della foresta di Berignone-Tatti. La ceduazione attiva favorisce una seed bank più ricca ed un maggior turnover di specie ruderali e generaliste. Al contrario, la sua interruzione comporta un incremento nella proporzione relativa di specialiste forestali (Fig. 3) e specie mediterranee come Cyclamen repandum Sm. subsp. repandum, Lotus hispidus Desf. ex DC. e Erica arborea. Questi dati confermano quanto emerso in letteratura: una seed bank abbondante e ricca di specie è tipica di ecosistemi disturbati, mentre tende a ridursi con la stabilizzazione delle condizioni ambientali ([21], [11], [12], [58], [52]). Tuttavia, l’aumento della ricchezza specifica non si traduce necessariamente in una maggiore diversità tassonomica. Le comunità più ricche di specie non possiedono infatti necessariamente livelli di alfa-diversità tassonomica più elevati, dal momento che su tali indici pesa in modo significativo il grado di equipartizione delle specie all’interno delle comunità e quindi le loro abbondanze relative ([36]).
Nonostante la minor ricchezza specifica nella seed bank del ceduo invecchiato, la quota di specialiste forestali è maggiore che nel ceduo utilizzato, soprattutto grazie al contributo di C. repandum, M. pentandra ed Emerus major Mill. Questi risultati confermano che la proporzione tra specie generaliste e specialiste forestali accumulate nella seed bank varia notevolmente in base al tipo di gestione, in accordo con quanto già rilevato da Leckie et al. ([35]), Olano et al. ([40]) e Plue et al. ([45]).
Le differenze osservate tra ceduo invecchiato e ceduo utilizzato in termini di densità della seed bank e numero cumulato di semenzali sono in gran parte dovute al contributo di poche specie particolarmente feconde, specificamente J. bufonius, E. arborea, E. canadensis e O. corniculata. Diverse specie del genere Juncus sono note per produrre un ingente numero di semi di piccole dimensioni e dotati di una notevole persistenza, anche di lungo periodo ([33]), raggiungendo densità che possono arrivare a diverse migliaia di unità per m2 ([11]). E. arborea è una specie indicatrice di suoli acidi, piuttosto comune nelle prime fasi delle serie di vegetazione mediterranea e supra-mediterranea ([66]) e presente in Italia sia nelle formazioni di macchia che in alcune tipologie di querceti misti ([20]). Non sorprende quindi la sua abbondanza sia nella seed bank che nella vegetazione realizzata nel ceduo di recente utilizzazione, mentre è di interesse la sua presenza nella seed bank del ceduo invecchiato, soprattutto considerata la sua assenza nella vegetazione realizzata. La capacità di E. arborea di formare seed bank longeve ([40]) suggerisce che parte dei semi presenti possa essersi accumulata in un periodo antecedente all’ultimo taglio. La seed bank, infatti, rappresenta un pool selezionato di specie provenienti sia dalla vegetazione realizzata che da quella passata ([4]), e può essere utilizzata come indicatore della storia gestionale e del regime dei disturbi di un ecosistema, offrendo informazioni preziose sulla resilienza del sistema e sul suo potenziale rigenerativo in risposta a cambiamenti ambientali o interventi antropici.
Come evidenziato dai risultati della PCA (Fig. 4), la prima componente può essere interpretata come un gradiente di ruderalità, fortemente influenzato dalla presenza di E. canadensis e O. corniculata, due specie ampiamente riconosciute per la loro affinità con ambienti disturbati ([2]). L’elevata abbondanza di E. canadensis e altre emicriptofite nella seed bank del ceduo utilizzato può essere interpretata come indicativa della presenza di condizioni ecologiche favorevoli a specie pioniere e tolleranti ai disturbi. Questa specie erbacea annuale, di origine nordamericana, è oggi naturalizzata in tutta la penisola italiana, dove si diffonde con facilità in habitat primitivi o degradati, spesso caratterizzati da suoli poveri e ricchi di scheletro ([15]).
Le ripetute utilizzazioni creano microambienti temporaneamente instabili, in cui specie come E. canadensis riescono a stabilirsi e accumulare semi in quantità rilevanti. Come dimostrato anche da Santi et al. ([54]) e Chelli et al. ([16]), le condizioni di maggior irraggiamento, escursione termica e disponibilità di nutrienti che si vengono a creare con la ceduazione svantaggiano le specie del sottobosco più tolleranti l’ombra e legate ad ambienti più stabili favorendo invece l’ingresso a quelle più ruderali e tolleranti nei confronti di disturbi. Le specie generaliste e ruderali tendono a produrre una quantità elevatissima di semi, spesso molto piccoli e dotati di una buona capacità di dispersione e persistenza nel suolo ([38], [51]). Questa strategia riproduttiva fa sì che i loro semi si accumulino progressivamente nella seed bank, dove possono rimanere vitali anche per lunghi periodi ([39]), in attesa di condizioni ambientali favorevoli alla germinazione. Questo meccanismo contribuisce a spiegare l’abbondanza di semenzali di queste specie rilevata nei campioni di suolo, anche in assenza di un’elevata rappresentanza nella vegetazione realizzata.
Data la presenza dominante di J. bufonius nei campioni di seed bank analizzati, l’interpretazione dei profili ecologici presentati nella Tab. 2richiede particolare cautela, dal momento che il calcolo degli indici ecologici medi tiene conto dell’abbondanza relativa dei semenzali emersi di ogni specie. J. bufonius è una specie pioniera tollerante ai disturbi, ma associata a suoli umidi, e per questo la sua abbondanza contribuisce significativamente all’innalzamento del valore medio dell’indice di umidità. D’altro canto, il maggior numero di semi di J. bufonius rilevato nella seed bank del ceduo utilizzato potrebbe sembrare a prima vista in contrasto con le condizioni ambientali generate dalla ceduazione, che sono tendenzialmente meno umide in virtù del maggior irraggiamento solare. Questo aspetto può essere spiegato se si considera che specie particolarmente inclini a formare seed bank, seppur caratterizzate da una maggior igrofilia, tendono ad accumularsi nel suolo quando, a causa del microclima più estremo determinato dai ripetuti interventi di taglio, non trovano le condizioni ecologiche favorevoli alla germinazione.
Seed bank e strato erbaceo
Mentre nel caso del ceduo utilizzato a regime la ricchezza specifica dello strato erbaceo è maggiore che nella seed bank, il rapporto si inverte nel caso del ceduo invecchiato, dove è la seed bank a risultare più ricca di specie. Nel ceduo sottoposto a utilizzazioni regolari, la composizione della vegetazione riflette sia il contributo della seed bank, che conserva tracce della vegetazione passata e delle sue trasformazioni, sia quello dei processi di disseminazione, che comportano l’introduzione nel sistema di semi da fonti esterne. In queste condizioni aperte e disturbate, tali semi trovano spesso ambienti favorevoli alla germinazione e all’affermazione, favorendo così l’ingresso di nuove specie all’interno della comunità vegetale ([10], [49]). Al contrario, nel bosco invecchiato, la progressiva chiusura della copertura arborea e la maggiore stabilità microclimatica creano condizioni meno favorevoli alla germinazione e all’insediamento ([3]), limitando così il ricambio floristico e riducendo la diversità delle specie presenti nella vegetazione realizzata ([28], [22]). I semi di queste specie permangono nel suolo del bosco invecchiato in attesa di eventi in grado di stimolare l’uscita dalla dormienza. La maggiore ricchezza specifica osservata nella seed bank del ceduo invecchiato rispetto a quella della vegetazione del sottobosco suggerisce che nelle foreste più mature il suolo ha un potenziale rigenerativo non trascurabile. Il mantenimento in forma latente di specie diverse da quelle presenti nella vegetazione realizzata può infatti rappresentare un importante meccanismo di assicurazione contro disturbi di diversa origine, con implicazioni di natura conservazionistica ([53], [27]).
La divergenza composizionale tra seed bank e vegetazione realizzata può variare sensibilmente in base alle condizioni ambientali e gestionali del soprassuolo ([12]). Dai nostri risultati emerge come l’ambiente forestale maturo agisca da filtro ecologico più restrittivo, limitando la germinazione e l’affermazione di molte delle specie presenti nella seed bank. Al contrario, nel ceduo utilizzato, le condizioni più aperte e dinamiche permettono una maggiore corrispondenza tra la composizione della seed bank e quella della vegetazione realizzata, favorendo la traduzione effettiva del potenziale floristico latente in realtà vegetazionale. Non tutte le specie presenti nella vegetazione realizzata sono in grado di formare una seed bank persistente: ciò dipende principalmente dalla capacità di produrre semi in grado di sopravvivere nel suolo per lunghi periodi. Questa distinzione si riflette chiaramente nei risultati della PCA (Fig. 5) e nel confronto tra gli indici di similarità floristica. Mentre la composizione della vegetazione varia sensibilmente in base al tipo di governo (con l’invecchiamento del bosco che tende a favorire specie più termofile e acidofile, forse legate al ritorno di taxa mediterranei), la composizione delle seed bank appare più omogenea. Questo risultato può essere interpretato come effetto della selezione ecologica esercitata dal suolo stesso: solo le specie in grado di produrre semi persistenti riescono a mantenersi nella seed bank, riducendo le differenze tra i due tipi di gestione.
Conclusioni
Il mantenimento o meno del governo ceduo matricinato è in grado di influenzare densità, ricchezza e composizione floristica delle seed bank forestali. Da un lato, la ceduazione favorisce una seed bank più ricca e abbondante, composta prevalentemente da specie generaliste e adattate ad ambienti disturbati che riflettono condizioni di maggiore esposizione alla luce, variazioni termiche e disponibilità di nutrienti. In questi casi, la formazione di una riserva di semi vitali pronti a germinare costituisce un adattamento cruciale nei processi di rigenerazione e conservazione della vegetazione ([3]). Parallelamente, con la cessazione della ceduazione aumenta la proporzione di specialiste forestali, in particolare quelle che dipendono dalla formazione di gap nella copertura per il loro sviluppo, oltre a specie con distribuzione mediterranea.
Un aspetto chiave emerso dallo studio riguarda il ruolo della seed bank come sede di una “memoria ecologica”: nel ceduo invecchiato, la presenza di specie come E. arborea e J. bufonius, i cui semi possono persistere nel suolo per decenni, evidenzia l’importanza di questa riserva biologica nel conservare la biodiversità e nel mantenimento della resilienza degli ecosistemi forestali. Questo aspetto rappresenta un potenziale meccanismo di assicurazione contro i cambiamenti ambientali, in quanto permette la sopravvivenza latente di specie che, pur non concretizzandosi nella vegetazione realizzata, potrebbero fare ritorno in caso di modifiche nelle condizioni ambientali.
Stando a quanto osservato, le condizioni ambientali determinate dalla ceduazione ([54]) possono limitare la germinazione di specie igrofile ma capaci di formare seed bank abbondanti, nel nostro caso rappresentate dalla terofita J. bufonius, favorendo l’accumulo di semi vitali nel suolo. Per questo motivo è necessario procedere con cautela nella valutazione dei profili ecologici delle seed bank, in particolare quelli basati su indici e bioindicatori.
Infine, la maggiore omogeneità floristica osservata tra le seed bank rispetto a quella rilevata a livello di vegetazione realizzata suggerisce, in accordo con quanto già riportato da Gasperini et al. ([27]), come la capacità delle specie di produrre semi persistenti possa agire da filtro ecologico primario, influenzando la composizione della seed bank e la sua tendenza a presentare pool di specie condivisi anche al variare dei parametri gestionali.
Ringraziamenti
Questa ricerca è stata supportata dal Ministero della Ricerca e dell’Università tramite il Piano Nazionale di Ripresa e Resilienza (PNRR), finanziato dall’Unione Europea - Next Generation EU; CN_00000033, CUP B83C22002910001 - National Biodiversity Future Center (NBFC).
References
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Online | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar
Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
CrossRef | Google Scholar
Google Scholar
Google Scholar
CrossRef | Google Scholar